Белки высокомолекулярные органические вещества. Что такое белки. Такие разные белки
"Введение в общую биологию и экологию. 9 класс". А.А. Каменский (гдз)
Состав и структура белков
Вопрос 1. Какие вещества называются белками или протеинами?
Белки (протеины)
- это гетерополимеры, состоящие из 20 различных мономеров - природных альфа-аминокислот. Белки - нерегулярные полимеры.
Общее строение аминокислоты может быть представлено следующим образом:
R-С(NH 2)-СООН. Все аминокислоты имеют аминогруппу (-МН2) и карбоксильную группу (-СООН) и различаются строением и свойствами радикалов. Аминокислоты в белке связаны пептидной
связью -N(Н)-С(=О), поэтому белки ещё называют пептидами.
Казеин для молочного белка или кератина для белка волос. Пространственное расположение белков: вещь о складывании: белки - это природные вещества с наибольшим химическим разнообразием. Уже из 3 разных аминокислот 6 можно комбинировать структурно разные трипептиды. Атом азота с его большой электроотрицательностью привлекает к нему связующий электрон; он создает отрицательный частичный заряд δ-. Пример: такие молекулы называются дипольными молекулами, потому что их заряды вызывают такие аттракционы, как два полюса магнита.
Если другой диполь приближается к форме водородных связей. Например: - результат воздействия водородных связей между пептидными группами, а именно между открытой кето и аминогруппами. Димер - несколько третичных структур объединяются, образуя эти очень большие функциональные единицы.
Вопрос 2. Что такое первичная структура белка?
В молекуле белка аминокислоты связаны друг с другом пептидной связью между атомами углерода и азота. В строении молекулы белка различают первичную структуру - последовательность аминокислотных остатков.
Вопрос 3. Как образуются вторичная, третичная и четвертичная структуры белка?
Вторичная структура белка - как правило, это спиральная структура (альфа-спираль), которая удерживается множеством водородных связей, возникающих между находящимся близко друг от друга С=О и NН-группами. Другой тип вторичной структуры - это бета-слой, или складчатый слой; это две параллельные полипептидные цепи, связанные водородными связями, перпендикулярными цепям.
Третичная структура белковой молекулы - это пространственная конфигурация, напоминающая компактную глобулу. Она поддерживается ионными, водородными и дисульфидными (S=S) связями, а также гидрофобными взаимодействиями.
Четвертичная структура образуется при взаимодействии нескольких глобул, которые объединяются в комплекс (например, молекула гемоглобина состоит из четырех таких субъединиц).
Пример: пермы. Редуцирующие агенты разлагают водородные связи в кератине. Затем волосы вводят в желаемую форму и создаются окислителями новыми поперечными связями. Осаждение белков: - образование осадка, осаждаемого вещества, которое затем осаждается - что? Добавляя определенные вещества - увеличивая концентрацию выше точки насыщения, так что вещество больше не может растворяться - добавление другого растворителя, так что вещество больше не может растворяться. Денататура. Увлажняющая оболочка больше не может быть образована, потому что гидрофильные Боковые цепи больше не направлены наружу.
Вопрос 4. Что такое денатурация белка?
Утрата белковой молекулой своей структуры называется денатурацией; она может быть вызвана повышением температуры, обезвоживанием, облучением и т.д. Если при денатурации первичная структура не нарушается, то при восстановлении нормальных условий полностью воссоздается структура белка. Если же действие фактора нарастает, разрушается и первичная структура белка - полипептидная цепь. Это уже необратимый процесс - восстановить структуру белок не может. Например, при высокой температуре (выше 42oС) в организме человека многие белки денатурируют необратимо.
Белок больше не может растворяться и выпадать в осадок. Электрофорез. Как и аминокислоты, белки также могут быть отделены друг от друга. Этот метод очень полезен в медицине. Процедура: белковая смесь наносится на гель и затем накладывается напряжение. Белки начинают мигрировать по-разному, причем скорость миграции зависит от размера и заряда белков. Через определенное время значения считываются. При различных заболеваниях одна или другая белковая группа теперь может быть увеличена или уменьшена. Функция белков: - биокатализ: ферменты - белки; активировать метаболические реакции в качестве биокатализаторов.
Вопрос 5. По какому признаку белки делятся на простые и сложные?
Простые белки (протеины) состоят исключительно из аминокислот (альбумины, глобулины, кератин, коллаген, гистон и другие). В состав сложных белков могут входить другие органические вещества: углеводы (тогда они называются гликопротеидами), жиры (липопротеиды), нуклеиновые кислоты (нуклеопротеиды), фосфорная кислота (фосфопротеиды), при сочетании белка с каким-либо окрашенным веществом образуются так называемые хромопротеиды. Из хромопротеидов наиболее изучен гемоглобин – красящее вещество красных кровяных шариков (эритроцитов).
Коммуникация: многие сигнальные вещества являются белками; например Инсулин, соматотропин, транспорт эритропоэтина: глобулярные белки растворимы в воде и крови; могут связываться с веществами, которые не растворимы в воде и, следовательно, транспортируются через кровь.
Кислород связывается с гемоглобином. Лист решения для построения аминокислот. Аминокислоты - белковые белки состоят из аминокислот. Аминокислоты составляют основу живого мира. 1 Структура аминокислот. Аминокислоты являются органическими молекулами, которые по меньшей мере.
В основе жизнедеятельности клетки лежат биохимические процессы, протекающие на молекулярном уровне и служащие предметом изучения биохимии. Соответственно и явления наследственности и изменчивости тоже связаны с молекулами органических веществ, и в первую очередь с нуклеиновыми кислотами и белками.
Состав белков
Белки представляют собой большие молекулы, состоящие из сотен и тысяч элементарных звеньев - аминокислот. Такие вещества, состоящие из повторяющихся элементарных звеньев - мономеров, называются полимерами. Соответственно белки можно назвать полимерами, мономерами которых служат аминокислоты.
Аминокислоты 1 Структура аминокислот Аминокислоты состоят из группы карбоновой кислоты и аминогруппы. Простейшей аминокислотой является глицин с 2 атомами углерода. Фармацевтическая биология Основы биохимии Проф. Учебник Иерархическая организация биологических структур Три этапа эволюции жизни Что такое биохимия? Изучение жизни на молекулярном уровне Жизнь, как мы ее знаем.
Белки: начинаем с теории
Аминокислоты и пептиды для улучшения растений доктором Инг. Экономика применения листьев. День 1: Концентрация денатурации и определение концентрации осадков в осадочных средах. День 2: Хроматография гелеобразования. Аминокислоты. Аминокислоты называются углеродными кислотами, в которых один или несколько атомов водорода алкильной группы замещены аминогруппой.
Всего в живой клетке известно 20 видов аминокислот. Название аминокислоты получили из-за содержания в своем составе аминной группы NHy, обладающей основными свойствами, и карбоксильной группы СООН, имеющей кислотные свойства. Все аминокислоты имеют одинаковую группу NH2-СН-СООН и отличаются друг от друга химической группой, называемой радикалом - R. Соединение аминокислот в полимерную цепь происходит благодаря образованию пептидной связи (СО - NH) между карбоксильной группой одной аминокислоты и аминогруппой другой аминокислоты. При этом выделяется молекула воды. Если образовавшаяся полимерная цепь короткая, она называется олигопептидной, если длинная - полипептидной.
Введение в биохимия, аминокислоты Проф. Альберт Душл Темы лекции Введение в биохимия; Аминокислоты пептиды и белки ферменты белковые функции углеводы липиды нуклеотиды. Электролиты Электролиты проводят электричество в водном растворе. Электролиты включают кислоты, основания и соли, поскольку все они присутствуют в водном растворе, по меньшей мере частично, в ионной форме.
Аминокислоты, пептиды и белки. Белки выполняют самые разнообразные функции в биологических системах. Целью набора слайдов является объяснение формирования и структуры инсулина с белковым гормоном. Давайте кратко объясним, как искусственно сделать инсулин. Структура: - Аминокислоты - Пептидная связь - Первичная структура - Вторичная структура - Третичные и четвертичные структуры.
Строение белков
При рассмотрении строения белков выделяют первичную, вторичную, третичную структуры.
Первичная структура определяется порядком чередования аминокислот в цепи. Изменение в расположении даже одной аминокислоты ведет к образованию совершенно новой молекулы белка. Число белковых молекул, которое образуется при сочетании 20 разных аминокислот, достигает астрономической цифры.
Пептиды и полипептиды представляют собой цепи из 20 различных. Какие качества у них есть? Как они реагируют с водой? Как вы реагируете друг с другом? Как определяются различия в силе? Помощь: Калькулятор. Начисления баллов: Всего очков: Примечание: Задачи 1 Сегодня аммиак снижается в промышленном масштабе. Производные азота являются слабыми органическими основаниями. Функциональные группы Простейший амин, метанамин. Аммиак имеет три атома, которые можно формально заменить органическими эфирами.
Что важно, поскольку они дают 3 примера! Что такое гликопаноза? Структура аминокислот Задача Внимательно прочитайте следующий текст и выполните работу в письменной форме. Попробуйте ответить на все вопросы. Ред. Гл. 3 введение: незаменимые аминокислоты, деградация биосинтеза, метаболическое значение.
Если бы большие молекулы (макромолекулы) белка располагались в клетке в вытянутом состоянии, они занимали бы в ней слишком много места, что затруднило бы жизнедеятельность клетки. В связи с этим молекулы белка скручиваются, изгибаются, свертываются в самые различные конфигурации. Так на основе первичной структуры возникает вторичная структура - белковая цепь укладывается в спираль, состоящую из равномерных витков. Соседние витки соединены между собой слабыми водородными связями, которые при многократном повторении придают устойчивость молекулам белков с этой структурой.
Структура биологически релевантных молекул и нуклеиновых кислот: - Хранение генетической информации. Белки: - Регуляторные функции. - Строительные блоки из биомембранов. Липиды и липиды: - Строительные блоки. Рабочий лист, примечание, рисунок 1. Биологические классы веществ. Три наиболее важных класса биологии - жиры, сахара и белки. Они относятся к питательным веществам нашего рациона и будут.
И почему они так важны? Основы Концепция протона-донора-акцептора. Водородные, протонные и кислотные основания. Есть много интересных вещей, чтобы рассказать об этой великой науке, которая является биологией, и, таким образом, руки. Биомолекулы - это химические соединения, которые составляют в основном живые существа. Эти вещества подразделяются на четыре основных типа: белки, нуклеиновые кислоты, углеводы и липиды.
Спираль вторичной структуры укладывается в клубок, образуя третичную структуру. Форма клубка у каждого вида белков строго специфична и полностью зависит от первичной структуры, т. е. от порядка расположения аминокислот в цепи. Третичная структура удерживается благодаря множеству слабых электростатических связей: положительно и отрицательно заряженные группы аминокислот притягиваются и сближают даже далеко отстоящие друг от друга участки белковой цепи. Сближаются и иные участки белковой молекулы, несущие, например, гидрофобные (водоотталкивающие) группы.
Белки представляют собой биомолекулы, состоящие из одной или нескольких цепей меньших единиц, называемых аминокислотами. Существует 20 различных типов аминокислот, и в зависимости от последовательности, которую они образуют в цепи, она будет идентичной белком. Эти цепи складываются по-разному, которые руководствуются аминокислотной последовательностью, дающей разные свойства белкам. Белки обладают широким спектром функций, от сокращения мышц до переноса кислорода и катализа метаболических процессов.
Все действия, осуществляемые живыми существами, от дыхания животных до фотосинтеза растений, являются химическими реакциями, и большая разница между живым и неживым миром заключается в том, что в первом случае специальные белки, называемые ферментами, облегчают и они делают эти реакции намного быстрее, что называется катализом.
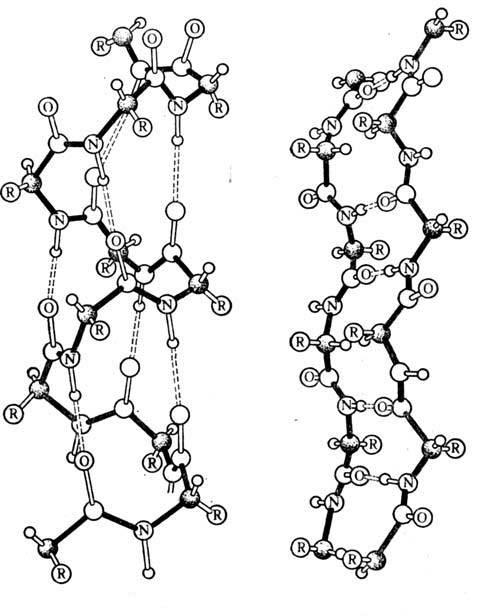
Некоторые белки, например гемоглобин, состоят из нескольких цепей, различающихся по первичной структуре. Объединяясь вместе, они создают сложный белок, обладающий не только третичной, но и четвертичной структурой (рис. 2).
В структурах белковых молекул наблюдается следующая закономерность: чем выше структурный уровень, тем слабее поддерживающие их химические связи. Связи, образующие четвертичную, третичную, вторичную структуру, крайне чувствительны к физико-химическим условиям среды, температуре, радиации и т. д. Под их воздействием структуры молекул белков разрушаются до первичной - исходной структуры. Такое нарушение природной структуры белковых молекул называется денатурацией. При удалении денатурирующего агента многие белки способны самопроизвольно восстанавливать исходную структуру. Если же природный белок подвергается действию вьюокой температуры или интенсивному действию других факторов, то он необратимо денатурируется. Именно фактом наличия необратимой денатурации белков клеток объясняется невозможность жизни в условиях очень высокой температуры.
Эти изображения представляют собой компьютерные представления некоторых белков. Нуклеиновые кислоты образуются длинными цепями единиц, называемыми нуклеотидами, которые, в свою очередь, состоят из трех основных компонентов: фосфатной группы, сахара из пяти атомов углерода и азотистого основания. Существует два разных типа нуклеиновых кислот, в зависимости от того, какой сахар образует нуклеотиды; молекула будет рибонуклеиновой кислотой, если сахар является рибозой или дезоксирибонуклеиновой кислотой, если это дезоксирибоза.
Основания Аденина и Гуанина больше и называются пуринами, тогда как тимин, цитозин и урацил меньше и известны как пиримидины. Это химическая структура нуклеотида. В синем - фосфатная группа, в черном - сахар пяти атомов углерода, а в красном - азотистая основа. Название соединения составляет 5 монофосфат-аденозин, хотя для облегчения вещей вы можете просто сказать «аденин».


Биологическая роль белков в клетке
Белки, называемые также протеинами (греч. протос - первый}, в клетках животных и растений выполняют многообразные и очень важные функции, к которым можно отнести следующие.
Цепи связываются посредством своих нуклеотидов посредством электростатических взаимодействий через их азотистые основания. Вот простая строка нуклеиновой кислоты. Нуклеотиды связаны фосфатными группами и пятиуглеродным сахаром, в то время как азотистые основания подвергаются воздействию. Когда они являются двойной цепью, две цепи соединяются своими азотистыми основаниями.
Все белки происходят из генов. Другой является дополнением к кодированию и называется закаленной цепью или плесенью. Какая цепь представляет собой форму и которая кодируется в зависимости от гена. Нельсон; Кокс Лехнингер Принципы биохимии. Это была веха как социального обеспечения, так и социального обеспечения.
Каталитическая. Природные катализаторы - ферменты представляют собой полностью или почти полностью белки. Благодаря ферментам химические процессы в живых тканях ускоряются в сотни тысяч или в миллионы раз. Под их действием все процессы идут мгновенно в «мягких» условиях: при нормальной температуре тела, в нейтральной для живой ткани среде. Быстродействие, точность и избирательность ферментов несопоставимы ни с одним из искусственных катализаторов. Например, одна молекула фермента за одну минуту осуществляет реакцию распада 5 млн. молекул пероксида водорода (Н202). Ферментам характерна избирательность. Так, жиры расщепляются специальным ферментом, который не действует на белки и полисахариды (крахмал, гликоген). В свою очередь, фермент, расщепляющий только крахмал или гликоген, не действует на жиры.
Углеводы, липиды, нуклеиновые кислоты, белки и мышечная биохимия. Отправленный: Наталья Пиньейру Мора Кустодио. Углеводы - Классификация - Метаболизм: Гликолиз - Гликогенолиз - Гликогенез. Углеводы химически определяются как полигидроксикетоны или полигидроксиальдегиды, то есть органические соединения с по меньшей мере тремя атомами углерода, где все атомы углерода имеют гидроксил, за исключением одного, имеющего первичный карбонил или вторичный карбонил.
Это вещества, характеризующиеся низкой растворимостью в воде и других полярных растворителях и высокой растворимостью в неполярных растворителях. Они широко известны как жиры, и их физические свойства связаны с гидрофобным характером их структур, все из которых синтезированы из ацетил-СоА.
Процесс расщепления или синтеза любого вещества в клетке, как правило, разделен на ряд химических операций. Каждую операцию выполняет отдельный фермент. Группа таких ферментов составляет биохимический конвейер.
Считают, что каталитическая функция белков зависит от их третичной структуры, при ее разрушении каталитическая активность фермента исчезает.
Это биологический полимер, но он обильно в организме человека. Они состоят из мономеров, называемых аминокислотами. Слово «белок» происходит от греческих протеосов, что означает его важность. Нуклеиновые кислоты: дезоксирибонуклеиновая кислота и рибонуклеиновая кислота.
Важность дезоксирибонуклеиновой кислоты, рибонуклеиновой кислоты и аденозинтрифосфата. Нуклеиновые кислоты представляют собой гигантские органические молекулы, содержащие углерод, водород, кислород, азот и фосфор. Существует два основных типа: дезоксирибонуклеиновая кислота и рибонуклеиновая кислота. Основными структурами нуклеиновых кислот являются нуклеотиды.
Защитная. Некоторые виды белков защищают клетку и в целом организм от попадания в них болезнетворных микроорганизмов и чужеродных тел. Такие белки носят название антител. Антитела связываются с чужеродными для организма белками бактерий и вирусов, что подавляет их размножение. На каждый чужеродный белок организм вырабатывает специальные «антибелки» - антитела. Такой механизм сопротивления возбудителям заболеваний называется иммунитетом.
Сократительное устройство мышечного волокна формируется белковыми цепями, которые скользят, чтобы сократить мышечное волокно. Среди них миозин и актин, которые составляют толстую и тонкую нити, соответственно. Когда импульс проникает через нервное волокно, мышцы сжимаются.
Углеводы Простейшие углеводы называются моносахаридами, имеющими по крайней мере один асимметричный атом углерода, который характеризует область, называемую хиральным центром, поскольку она обеспечивает оптические изомеры. У них есть от 3 до 8 атомов углерода, которые называются соответственно триосами, тетросами, пентозами, гексозами, гептозами и октодами. Наиболее распространенные естественные моносахариды, такие как рибоза, глюкоза, фруктоза и манноза, существуют как полуацетали общей циклической цепи, либо в виде фуранозы, либо пиранозы. В этих соединениях, когда углерод С1 представляет собой свободный гидроксил, углевод обладает восстанавливающей способностью при нагревании. Эта характеристика часто используется в реакциях идентификации. Моносахариды Это самые простые углеводы, из которых производятся все остальные классы. Из них наиболее важными являются пенетосы и гексозы. Такие формы взаимопревращаются через явление муртатрования. . Наиболее важными гексами являются.
Чтобы предупредить заболевание, людям и животным вводят ослабленные или убитые возбудители (вакцины), которые не вызывают болезнь, но заставляют специальные клетки организма производить антитела против этих возбудителей. Если через некоторое время болезнетворные вирусы и бактерии попадают в такой организм, они встречают прочный защитный барьер из антител.
Гормональная. Многие гормоны также представляют собой белки. Наряду с нервной системой гормоны управляют работой разных органов (и всего организма) через систему химических реакций.
Отражательная. Белки клетки осуществляют прием сигналов, идущих извне. При этом различные факторы среды (температурный, химический, механический и др.) вызывают изменения в структуре белков - обратимую денатурацию, которая, в свою очередь, способствует возникновению химических реакций, обеспечивающих ответ клетки на внешнее раздражение. Эта способность белков лежит в основе работы нервной системы, мозга.
Двигательная. Все виды движений клетки и организма: мерцание ресничек у простейших, сокращение мышц у высших животных и другие двигательные процессы - производятся особым видом белков.
Энергетическая. Белки могут служить источником энергии для клетки. При недостатке углеводов или жиров окисляются молекулы аминокислот. Освободившаяся при этом энергия используется на поддержание процессов жизнедеятельности организма.
Транспортная. Белок гемоглобин крови способен связывать кислород воздуха и транспортировать его по всему телу. Эта важнейшая функция свойственна и некоторым другим белкам.
Пластическая. Белки - основной строительный материал клеток (их мембран) и организмов (их кровеносных сосудов, нервов, пищеварительного тракта и др.). При этом белки обладают индивидуальной специфичностью, т. е. в организмах отдельных людей содержатся некоторые, характерные лишь для него, белки-
Таким образом, белки - эти важнейший компонент клетки, без которого невозможно проявление свойств жизни. Однако воспроизведение живого, явление наследственности, как мы увидим позже, связано с молекулярными структурами нуклеиновых кислот. Это открытие - результат новейших достижений биологии. Теперь известно, что живая клетка обязательно обладает двумя видами полимеров-белками и нуклеиновыми кислотами. В их взаимодействии заключены самые глубокие стороны явления жизни.