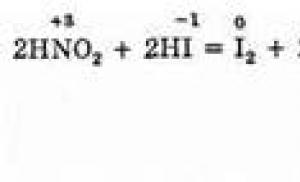Азотистая кислота. Свойства азотистой кислоты. В.с.вагина, учитель химии (г. черняховск, калининградская обл.) Hno2 разложение
Азотистая кислота существует либо в растворе, либо в газовой фазе. Она неустойчива и при нагревании распадается в парах:
2HNO 2 «NO+NO 2 +Н 2 О
Водные растворы этой кислоты при нагревании разлагаются:
3HNO 2 «HNO 3 +H 2 O+2NO
Эта реакция обратимая, поэтому, хотя растворение NO 2 и сопровождается образованием двух кислот: 2NO 2 + Н 2 O=HNO 2 +HNO 3
практически взаимодействием NO 2 с водой получают HNO 3:
3NO 2 +H 2 O=2HNO 3 +NO
По кислотным свойствам азотистая кислота лишь немного сильнее уксусной. Соли ее называются нитритами и в отличие от самой кислоты являются устойчивыми. Из растворов ее солей можно добавлением серной кислоты получить раствор HNO 2:
Ba(NO 2) 2 +H 2 SO 4 =2HNO 2 +BaSO 4 ¯
На основе данных о ее соединениях предполагают два типа структуры азотистой кислоты:
которым соответствуют нитриты и нитросоединения. Нитриты активных металлов имеют структуру I типа, а малоактивных металлов - II типа. Почти все соли этой кислоты хорошо растворимы, но нитрит серебра труднее всех. Все соли азотистой кислоты ядовиты. Для химической технологии важны KNO 2 и NaNO 2 , которые необходимы для производства органических красителей. Обе соли получают из оксидов азота:
NO+NO 2 +NaOH=2NaNO 2 +Н 2 О или при нагревании их нитратов:
KNO 3 +Pb=KNO 2 +PbO
Pb необходим для связывания выделяющегося кислорода.
Из химических свойств HNO 2 сильнее выражены окислительные, при этом сама она восстанавливается до NO:

Однако можно привести много примеров таких реакций, где азотистая кислота проявляет восстановительные свойства:

Определить присутствие азотистой кислоты и ее солей в растворе можно, если прибавить раствор иодида калия и крахмала. Нитрит-ион окисляет анион иода. Эта реакция требует присутствия Н + , т.е. протекает в кислой среде.
Азотная кислота
В лабораторных условиях азотную кислоту можно получить действием концентрированной серной кислоты на нитраты:
NaNO 3 +H 2 SO 4(к) =NaHSO 4 +HNO 3 Реакция протекает при слабом нагревании.
Получение азотной кислоты в промышленных масштабах осуществляется каталитическим окислением аммиака кислородом воздуха:
1. Вначале смесь аммиака с воздухом пропускают над платиновым катализатором при 800°С. Аммиак окисляется до оксида азота (II):
4NH 3 + 5O 2 =4NO+6Н 2 О
2 . При охлаждении происходит дальнейшее окисление NO до NO 2: 2NO+O 2 =2NO 2
3. Образующийся оксид азота (IV) растворяется в воде в присутствии избытка О 2 с образованием HNO 3: 4NO 2 +2Н 2 O+O 2 =4HNO 3
Исходные продукты - аммиак и воздух - тщательно очищают от вредных примесей, отравляющих катализатор (сероводород, пыль, масла и т.п.).
Образующаяся кислота является разбавленной (40-60% -ной). Концентрированную азотную кислоту (96-98% -ную) получают перегонкой разбавленной кислоты в смеси с концентрированной серной кислотой. При этом испаряется только азотная кислота.
Физические свойства
Азотная кислота - бесцветная жидкость, с едким запахом. Очень гигроскопична, «дымит» на воздухе, т.к. ее пары с влагой воздуха образуют капли тумана. Смешивается с водой в любых соотношениях. При -41,6°С переходит в кристаллическое состояние. Кипит при 82,6°С.
В HNO 3 валентность азота равна 4, степень окисления +5. Структурную формулу азотной кислоты изображают так:
Оба атома кислорода, связанные только с азотом, равноценны: они находятся на одинаковом расстоянии от атома азота и несут каждый по половинному заряду электрона, т.е. четвертая часть азота разделена поровну между двумя атомами кислорода.
Электронную структуру азотной кислоты можно вывести так:
1. Атом водорода связывается с атомом кислорода ковалентной связью:
2. За счет неспаренного электрона атом кислорода образует ковалентную связь с атомом азота:
3. Два неспаренных электрона атома азота образуют ковалентную связь со вторым атомом кислорода:
4. Третий атом кислорода, возбуждаясь, образует свободную 2р- орбиталь путем спаривания электронов. Взаимодействие неподеленной пары азота со свободной орбиталью третьего атома кислорода приводит к образованию молекулы азотной кислоты:
Химические свойства
1. Разбавленная азотная кислота проявляет все свойства кислот. Она относится к сильным кислотам. В водных растворах диссоциирует:
HNO 3 «Н + +NO - 3 Под действием теплоты и на свету частично разлагается:
4HNO 3 =4NO 2 +2Н 2 O+O 2 Поэтому хранят ее в прохладном и темном месте.
2. Для азотной кислоты характерны исключительно окислительные свойства. Важнейшим химическим свойством является взаимодействие почти со всеми металлами. Водород при этом никогда не выделяется. Восстановление азотной кислоты зависит от ее концентрации и природы восстановителя. Степень окисления азота в продуктах восстановления находится в интервале от +4 до -3:
HN +5 O 3 ®N +4 O 2 ®HN +3 O 2 ®N +2 O®N +1 2 O®N 0 2 ®N -3 H 4 NO 3
Продукты восстановления при взаимодействии азотной кислоты разной концентрации с металлами разной активности приведены ниже в схеме.

Концентрированная азотная кислота при обычной температуре не взаимодействует с алюминием, хромом, железом. Она переводит их в пассивное состояние. На поверхности образуется пленка оксидов, которая непроницаема для концентрированной кислоты.

3. Азотная кислота не реагирует с Pt, Rh, Ir, Та, Au. Платина и золото растворяются в «царской водке» - смеси 3 объемов концентрированной соляной кислоты и 1 объема концентрированной азотной кислоты:
Au+НNO 3 +3НСl= AuСl 3 +NO+2Н 2 О НСl+AuСl 3 =H
3Pt+4HNO 3 +12НСl=3PtCl 4 +4NO+8H 2 O 2HCl+PtCl 4 =H 2
Действие «царской водки» заключается в том, что азотная кислота окисляет соляную до свободного хлора:
HNO 3 +HCl=Сl 2 +2Н 2 О+NOCl 2NOCl=2NO+Сl 2 Выделяющийся хлор соединяется с металлами.
4. Неметаллы окисляются азотной кислотой до соответствующих кислот, а она в зависимости от концентрации восстанавливается до NO или NO 2:
S+бНNO 3(конц) =H 2 SO 4 +6NO 2 +2Н 2 ОР+5НNO 3(конц) =Н 3 РO 4 +5NO 2 +Н 2 О I 2 +10HNO 3(конц) =2HIO 3 +10NO 2 +4Н 2 О 3Р+5HNO 3(p азб) +2Н 2 О= 3Н 3 РО 4 +5NO
5. Она также взаимодействует с органическими соединениями.
Соли азотной кислоты называются нитратами, представляют собой кристаллические вещества, хорошо растворимые в воде. Их получают при действии HNO 3 на металлы, их оксиды и гидроксиды. Нитраты калия, натрия, аммония и кальция называются селитрами. Селитры используются главным образом как минеральные азотные удобрения. Кроме того, KNO 3 применяют для приготовления черного пороха (смесь 75% KNO 3 , 15% С и 10% S). Из NH 4 NO 3 , порошка алюминия и тринитротолуола изготавливают взрывчатое вещество аммонал.
Соли азотной кислоты при нагревании разлагаются, причем продукты разложения зависят от положения солеобразующего металла в ряду стандартных электродных потенциалов:

Разложение при нагревании (термолиз) - важное свойство солей азотной кислоты.
2KNO 3 =2KNO 2 +O 2
2Cu(NO 3) 2 =2CuO+NO 2 +O 2
Соли металлов, расположенных в ряду левее Mg, образуют нитриты и кислород, от Mg до Cu - оксид металла, NO 2 и кислород, после Си - свободный металл, NO 2 и кислород.
Применение
Азотная кислота - важнейший продукт химической промышленности. Большие количества расходуются на приготовление азотных удобрений, взрывчатых веществ, красителей, пластмасс, искусственных волокон и др. материалов. Дымящая
азотная кислота применяется в ракетной технике в качестве окислителя ракетного топлива.
HNO 2 имеет слабый характер. Весьма неустойчива, может быть только в разбавленных растворах:2 HNO 2 NO + NO 2 + H 2 O .
Соли азотистой кислоты называются нитритами или азотистокислыми . Нитриты гораздо более устойчивы, чем HNO 2 , все они токсичны.
2HNO 2 + 2HI = I 2 + 2NO + 2H 2 O,
HNO 2 + H 2 O 2 = HNO 3 + H 2 O,
5KNO 2 + 2KMnO 4 + 3H 2 SO 4 = 5KNO 3 + K 2 SO 4 + 2MnSO 4 + 3H 2 O.
Строение азотистой кислоты.
В газовой фазе планарная молекула азотистой кислоты существует в виде двух конфигураций цис- и транс-:

При комнатной температуре преобладает транс-изомер: эта структура является более устойчивой. Так, для цис - HNO 2 (г) DG° f = −42,59 кДж/моль, а для транс-HNO 2 (г) DG = −44,65 кДж/моль.
Химические свойства азотистой кислоты.
В водных растворах существует равновесие:
Нагреваясь, раствор азотистой кислоты распадается с выделением NO и образованием азотной кислоты:
HNO 2 в водных растворах диссоциирует (K D =4,6·10 −4), немного сильнее уксусной кислоты. Легко вытесняется более сильными кислотами из солей:
Азотистая кислота проявляет окислительные и восстановительные свойства. При действии более сильных окислителей (пероксид водорода , хлор , перманганат калия) происходит окисление в азотную кислоту:
Кроме того, она может окислять вещества, которые обладают восстановительными свойствами:
Получение азотистой кислоты.
Азотистую кислоту получают при растворении оксида азота (III) N 2 O 3 в воде:
Кроме того, она образуется при растворении в воде оксида азота (IV) NO 2 :
.
Применение азотистой кислоты.
Азотистая кислота применяется для диазотирования первичных ароматических аминов и образования солей диазония. Нитриты применяются в органическом синтезе в производстве органических красителей.
Физиологическое действие азотистой кислоты.
Азотистая кислота является токсичной и обладает ярко выраженным мутагенным действием, так как является деаминирующим агентом.
Азотистая кислота в чистом виде не выделена и существует лишь в растворах, которые получают на холоде подкислением растворов ее солей:
Ba(NO 2) 2 + H 2 SO 4 = 2HNO 2 + BaSO 4
Эти растворы имеют голубую окраску, они относительно устойчивы при 0 °С, а при нагревании до комнатной температуры разлагаются: 3HNO 2 = HNO 3 + 2NO + H 2 O
Азотистая кислота легко диспропорционирует.
Окислительные свойства и прочность HNO 3 и HNO 2 удобно сопоставить с помощью диаграммы вольт-эквивалент - степень окисления. Легко заметить, что значение вольт-эквивалента HNO 2 лежит выше прямой, соединяющей значения вольт-эквивалентов NO и HNO 3 . Следовательно, G реакции диспропорционирования оказывается меньше нуля, иными словами, HNO 2 является неустойчивой кислотой и стремится диспропорционировать на NO и HNO 3 . Кроме того, в разбавленных растворах одинаковой концентрации (0,1 М) HNO 2 оказывается сильным окислителем, по силе превосходящим даже HNO 3 . Так, 0,05 М HNO 2 , мгновенно окисляет иодид калия:
2NaNO 2 + 2H 2 SO 4 + 2KI = I 2 + 2NO + K 2 SO 4 + Na 2 SO 4 + 2H 2 O
а азотная кислота той же концентрации с KI не реагирует. Это следует и из диаграммы вольт-эквивалент-степень окисления. Действительно, наклон прямой, соединяющей значения вольт-эквивалентов HNO 2 и NO, оказывается круче, чем в случае пары HNO 3 и NO. Атом азота в HNO 2 находится в промежуточной степени окисления, поэтому для азотистой кислоты и ее солей характерны не только окислительные, но и восстановительные свойства. Так, нитриты обесцвечивают подкисленный раствор перманганата калия: 5KNO 2 + 2KMnO 4 + 3H 2 SO 4 = 2MnSO 4 + 5KNO 3 + K 2 SO 4 + 3H 2 O
Нитриты щелочных, щелочноземельных металлов и аммония - бесцветные или желтоватые кристаллические вещества, хорошо растворимые в воде и плавящиеся без разложения. Нитриты переходных металлов в воде малорастворимы, а при нагревании легко разлагаются.
Отношение нитратов металлов к нагреванию.
Ме находящиеся левее Mg (кроме Li): МеNO 2 +O 2
Ме находящиеся между (и Li): MeO+NO 2 +O 2
Ме находящиеся правее Cu: Ме+NO 2 +O 2
Азотноватистая (гипоазотистая) кислота H 2 N 2 O 2 . Бесцветные кристаллы.Азотноватистая кислота - слабая и очень неустойчивая. Она и ее соли проявляют восстановительные свойства. При обезвоживании H 2 N 2 O 2 концентрированной H 2 SO 4 образуется оксид азота N 2 O, который формально можно рассматривать как ее ангидрид.
Нитроксиловая кислота H 4 N 2 O 4 . В свободном виде она неустойчива.
2. Все щелочные металлы взаимодействуют с водой, выделяя водород:
2Ме+2H 2 O=2МеOH+H 2
Эта экзотермическая реакция протекает очень быстро, натрий часто воспламеняется, а более тяжелые металлы реагируют со взрывом. Относительно низкая активность лития по отношению к воде определяется прежде всего кинетическими, а не термодинамическими причинами: литий наиболее твердый из щелочных металлов и имеет самую высокую температуру плавления, поэтому он медленнее дробится на капли и реагирует спокойнее других щелочных металлов.
Состав продуктов, образующихся при сгорании щелочных металлов на воздухе или в кислороде, зависит от природы металла. Так, литий образует оксид Li 2 O, натрий - пероксид Na 2 O 2 , калий, рубидий и цезий - супероксиды (надпероксиды) КO 2 , RbO 2 , CsO 2 . Все эти вещества имеют ионную кристаллическую решетку. Пероксиды: ст.окисл. -1, а супероксиды (надпероксиды) ст.окисл .
Взаимодействие с серой : При сплавлении натрия с серой образуются персульфиды типа Na 2 S 2 , Na 2 S 3 , Na 2 S 4 и Na 2 S 5 .
Li не образует полисульфидов. Остальные образуют: K 2 S+nS=K 2 S n
Э 2 S гидролизуются медленно, окисляются до тиосульфатов:
2Na 2 S+2O 2 +H 2 O=Na 2 S 2 O 3 +2NaOH
Взаимодействие с водородом:
Получают: Li(расплав)+H 2 =2LiH
NaH,KH,Cs,Rb разлагаются при нагревании. Все гидролизуются в воде: 2LiH+2H 2 O=2LiOH+H 2
Взаимодействие с галогенами:
LiF- малорастворим. LiCl,LiBr,LiI-гигроскопичны, образуют кристаллогидраты.
NaГ, KГ, CsГ, RbГ- хорошо растворимые соли.
Прочность связи Li-Г в ряду F, Cl, Br, I уменьшается, причина- сильное поляризующее влияние иона лития.
Взаимодействие с азотом:
Li 3 N синтезируется при обычных условиях. Остальные нитриды получают действием тихого электрического разряда на пары щелочных металлов в атмосфере азота. Они не устойчивы. В воде гидролизуются: Li 3 N+3H 2 O=3LiOH+NH 3
Оксиды, гидроксиды, соли.
Оксиды М 2 O их можно получить путем дозированного окисления металлов, однако в
этом случае конечный продукт будет содержать примеси. Цвет оксида изменяется
от белого (Li 2 O и Na 2 O) к желтому (K 2 O, Rb 2 O) и оранжевому (Cs 2 O). Удобным способом получения оксида натрия является взаимодействие натрия с расплавленным едким натром: 2NaOH + 2Na=2Na 2 O + H 2
Для всех щелочных металлов получены озониды МO 3 , в состав которых входит парамагнитный ион - . Солеобразные КO 3 , RbO 3 , CsO 3 получают действием озона на пероксиды, супероксиды или гидроксиды: КO 2 + O 3 = КO 3 + O 2
Все озониды представляют собой оранжево-красные кристаллические вещества. Они чрезвычайно взрывоопасны и неустойчивы.
Пероксиды, надпероксиды и озониды щелочных металлов при нагревании pазлагаются. Их термическая устойчивость увеличивается с ростом радиуса катиона. Пероксиды, надпероксиды и озониды являются сильными окислителями:
Na 2 O 2 + CO = Na 2 CO 3
Гидроксиды элементов первой группы являются сильными основаниями. Они представляют собой бесцветные гигроскопичные вещества, легко расплывающиеся на воздухе и постепенно превращающиеся в карбонаты. Гидроксиды щелочных металлов прекрасно растворимы в воде.
Гидроксиды натрия, калия, рубидия и цезия плавятся без разложения, в то время как LiOH при прокаливании выделяет воду: 2LiOH = Li 2 O + Н 2 O
Взаимодействие гидроксидов щелочных металлов с кислотами и кислотными оксидами приводит к образованию солей.
Нитраты щелочных Ме при нагревании разлагаются:
4LiNO 3 =2Li 2 O+4NO 2 +O 2
Но остальные: 2NaNO 3 =2NaNO 2 +O 2
Na 2 CO 3 *10H 2 O – кристаллическая сода
NaHCO 3 – питьевая сода (Получение- аммиачный способ, метод Сольве:
NaCl+NH 3 +CO 2 +H 2 O=NaHCO 3 +NH 4 Cl
2NaHCO 3 = Na 2 CO 3 +CO 2 +H 2 O (при нагревании)
Литий Li от остальных щелочных металлов отличает большее значение энергии ионизации и небольшой размер атома и иона. Литий по свойствам напоминает магний (диагональное сходство в периодической системе).
3. В окислительно-восстановительном процессе всегда участвуют две (сопряженные)
пары, каждая из которых включает окислитель и восстановитель. Процессу образования ионов способствует увеличение энтропии (энтропия ионов в растворе гораздо больше, чем энтропия металла) и образование гидратов, а препятствуют процессы ионизации (энергия ионизации достаточно высока) и разрушения кристаллической решетки. В состоянии равновесия на пластинке локализуется положительный заряд, который компенсируется противоионами, находящимися в растворе. Так возникает двойной электрический слой, характеризующийся некоторым скачком потенциала который зависит от природы металла, температуры и концентрации ионов металла в растворе. Величину , нельзя ни измерить, ни рассчитать. Однако, если такой полуэлемент соединить проводником с другим полуэлементом (например, то между ними будет протекать электрический ток, обусловленный разностью потенциалов. Электродвижущая сила (Е) процесса, например реакции:
будет равна с высокой степенью приближения разности потенциалов полуэлементов:
Вот эту величину - электродвижущую силу - измерить можно! Поэтому для характеристики полуэлементов (окислительно-восстановительных пар) используют величину ЭДС между данным полуэлементом и так называемым электродом сравнения. За электрод сравнения принят стандартный водородный электрод
2Н + (р)+2e - =H 2 0
и активности Н + , равной 1. ЭДС цепи, составленной из стандартного водородного электрода и изучаемого электрода, называют электродным потенциалом последнего. Если активности (концентрации) ионов равны единице, то этот потенциал называют
стандартным (Е°). Так, для окислительно-восстановительной пары Cu 2+ /Cu°, при
[Си 2+ ] = 1 моль/л: Е = = Е° (Cu 2+ /Cu°).
Уравнение 1. для окислительно-восстановительного процесса в целом можно записать так:
или в более общем виде: E=Eок-Евос
где Еок - электродный потенциал пары, выступающей в качестве окислителя; Евос - электродный потенциал пары, выступающей как восстановитель.
Реакционная способность Р оказывается более высокой, чем азота. С металлами Р взаимодействуют с образованием фосфидов. Их получают нагреванием смеси пниктогена с металлом в инертной атмосфере или в запаянной ампуле.
Гидролиз фосфида: Mg 3 P 2 +6H 2 O=2PH 3 +3Mg(OH) 2
Mg 3 P 2 +6HCl=2PH 3 +3MgCl 2
Фосфор диспропорционирует
Р 4 + 6Н 2 O = РН 3 + ЗН 3 PO 2
В кислой и нейтральной средах равновесие сильно смещено влево, и реакция практически не протекает. Равновесие смещается вправо под действием
щелочей: Р 4 + ЗКОН + ЗH 2 O=PH 3 + ЗКН 2 PO 2
Фосфин образует с воздухом взрывчатые смеси, а при поджигании сгорает, превращаясь в метафосфорную кислоту: РН 3 + 2O 2 =НРО 3 + Н 2 O
Фосфин плохо растворим в воде. Реагирует только с очень сильными кислотами (HI, HClO 4)
Алотропия фосфора.
Белый фосфор. Мягкое кристаллическое вещество с неприятным чесночным запахом, практически не растворим в воде, мало растворим в бензоле, хорошо растворим в сероуглероде. Он сильно ядовит, на воздухе горит. Имеет молекулярную решетку в узлах которой находятся тетраэдрические молекулы
P 4 . Высокая реакционная способность.
Красный фосфор.P ∞ Образуется при нагревании белого до 320 градусов без доступа воздуха.Он не растворим в сероуглероде, но растворяется в расплавленном висмуте и свинце.
Черный фосфор. При нагревании 200 о С и давлении 1200 атм. Красный переходит в черный фосфор- термодинамически более выгодную форму. Напоминает графит.
Оксиды.
Оксиды Э 2 O 3 получают при взаимодействии простых веществ с кислородом. Оксид фосфора(III) представляет собой белый рыхлый кристаллический порошок, легко возгоняющийся. Оксид фосфора(III) называют фосфористым ангидридом, так как он взаимодействует с холодной водой с образованием фосфористой кислоты:
Р 4 O 6 +6Н 2 O = 4Н 3 PO 3
Оксиды фосфора(III) проявляют кислотные свойства
Оксиды Э 2 O 5 (Э 4 О 10). Оксид фосфора(V) (или фосфорный ангидрид) представляет
собой рыхлый белый порошок. Оксид фосфора(V) чрезвычайно жадно присоединяет воду. Реакция сопровождается сильным разогреванием и приводит к образованию
сложной смеси, состоящей из метафосфорных кислот разного состава, которые при кипячении гидролизуются до ортофосфорной кислоты Н 3 PO 4 .
HNO3, кислородосодержащая одноосновная сильная кислота. Твёрдая азотная кислота образует две кристаллические модификации с моноклинной и ромбической решётками.
Азотная кислота смешивается с водой в любых соотношениях. В водных растворах она практически полностью диссоциирует на ионы.
Получается при каталитическом окислении синтетического аммиака на платино-родиевых катализаторах (метод Габера) до смеси оксидов азота (нитрозных газов), с дальнейшим поглощением их водой
4NH3 + 5O2 (Pt) > 4NO + 6H2O
2NO + O2 > 2NO2 4NO2 + O2 + 2H2O > 4HNO3 Концентрация полученной таким методом азотной кислоты колеблется, в зависимости от технологического оформления процесса от 45 до 58 %. Впервые азотную кислоту получили алхимики, нагревая смесь селитры и железного купороса:
4KNO3 + 2(FeSO4 7H2O) (t°) > Fe2O3 + 2K2SO4 + 2HNO3^ + NO2^ + 13H2O
Чистую азотную кислоту получил впервые Иоганн Рудольф Глаубер, действуя на селитру концентрированной серной кислотой:
KNO3 + H2SO4(конц.) (t°) > KHSO4 + HNO3^
Дальнейшей дистилляцией может быть получена т. н. «дымящая азотная кислота», практически не содержащая воды.
Применение:
в производстве минеральных удобрений;
в военной промышленности;
в фотографии - подкисление некоторых тонирующих растворов;
в станковой графике - для травления печатных форм (офортных досок, цинкографических типографских форм и магниевых клише).
1.Разбавленная азотная кислота проявляет все свойства сильных кислот, в водных растворах она диссоциирует по следующей схеме:
HNO3 H+ + NO3–,
безводная кислота:
2HNO3® NO2+ + NO3–+ H2O.
Постепенно, особенно на свету или при нагревании азотная кислота разлагается, при хранении раствор становится коричневатым из-за диоксида азота:
4HNO3 4NO2 + 2H2O + O2.
2.Азотная кислота взаимодействует почти со всеми металлами. Разбавленная азотная кислота со щелочными и щелочноземельными металлами, а также с железом и цинком образует соответствующие нитраты, нитрат аммония или гемиоксид азота в зависимости от активности металла и воду:
4Mg + 10HNO3® 4Mg(NO3)2 + N2O + 5H2O,
С тяжелыми металлами разбавленная кислота образует соответствующие нитраты, воду и выделяется оксид азота, а в случае более сильного разбавления азот:
5Fe + 12HNO3(оч. разб.)®5Fe(NO3)3 + N2+ 6H2O,
3Cu + 8HNO3® 3Cu(NO3)2 + 2NO + 4H2O.
Концентрированная азотная кислота при взаимодействии со щелочными и щелочными металлами образует соответствующие нитраты, воду и выделяется гемиоксид азота:
8Na + 10HNO3® 8NaNO3 + N2O + 5H2O.
Такие металлы как железо, хром, алюминий, золото, платина, иридий, тантал концентрированная кислота пассивирует, т.е. на поверхности металла образуется пленка оксидов не проницаемая для кислоты. Другие тяжелые металлы при взаимодействии с концентрированной азотной кислотой образуют соответствующие нитраты, воду и выделяется оксид или диоксид азота:
3Hg + 8HNO3(хол.)®3Hg(NO3)2 + 2NO + 4H2O,
Hg + 4HNO3(гор.)®Hg(NO3)2 + 2NO2+ 2H2O,
Ag + 2HNO3® AgNO3 + NO2+ 2H2O.
3.Азотная кислота способна растворить золото, платину и другие благородные металлы, но в смеси с соляной кислотой. Их смесь в отношении три объема концентрированной соляной кислоты и один объем концентрированной азотной кислоты называют “царской водкой”. Действие царской водки заключается в том, что азотная кислота окисляет соляную до свободного хлора, который соединяется с металлами:
HNO3 + HCl ® Cl2 + 2H2O + NOCl,
2NOCl ® 2NO + Cl2.
Царская водка способна растворить золото, платину, родий, иридий и тантал, которые не растворяются ни в азотной, а уж тем более соляной кислоте:
Au + HNO3 + 3HCl ® AuCl3 + NO + 2H2O,
HCl + AuCl3® H;
3Pt + 4HNO3 + 12HCl ® 3PtCl4 + 4NO + 8H2O,
2HCl + PtCl4® H2.
4.Неметаллы также окисляются азотной кислотой до соответствующих кислот, разбавленная кислота выделяет оксид азота:
3P + 5HNO3 + 2H2O ® 3H3PO4 + 5NO ,
концентрированная кислота выделяет диоксид азота:
S + 6HNO3® H2SO4 + 6NO2+ 2H2O,
зотная кислота способна также окислять некоторые неорганические соединения:
3H2S + 8HNO3® 3H2SO4 + 8NO + 4H2O.
HNO2 - слабая одноосновная кислота, существует только в разбавленных водных растворах, окрашенных в слабый голубой цвет, и в газовой фазе. Соли азотистой кислоты называются нитритами или азотистокислыми. Нитраты гораздо более устойчивы, чем HNO2, все они токсичны.
В газовой фазе планарная молекула азотистой кислоты существует в виде двух конфигураций цис- и транс-. При комнатной температуре преобладает транс-изомер
Хим. св-ва
В водных растворах существует равновесие:
2HNO2 - N2O3 + H2O - NO^ + NO2^ + H2O
При нагревании раствора азотистая кислота распадается с выделением NO и NO2:
3HNO2 - HNO3 + 2NO^ + H2O.
HNO2 немного сильнее уксусной кислоты. Легко вытесняется более сильными кислотами из солей:
H2SO4 + Ba(NO2)2 > BaSO4v + HNO2.
Азотистая кислота проявляет как окислительные, так и восстановительные свойства. При действии более сильных окислителей (Н2О2, КМпО4) окисляется в HNO3:
2HNO2 + 2HI > 2NO^ + I2v + 2H2O;
5HNO2 + 2HMnO4 >2Mn(NO3)2 + HNO3 + 3H2O;
HNO2 + Cl2 + H2O > HNO3 + 2HCl.
Азотистая кислота применяется для диазотирования первичных ароматических аминов и образования солей диазония. Нитриты применяются в органическом синтезе при производстве органических красителей.
Получение:
N2O3 + H2O 2HNO2,
NaNO2 + H2SO4 (0° C)® NaHSO4 + HNO2
AgNO2 + HCl ® AgCl + HNO2
Свойства солей
Все нитраты хорошо растворимы в воде. С повышением температуры их растворимость сильно увеличивается. При нагревании нитраты распадаются с выделением кислорода. Нитраты аммония, щелочных и щелочноземельных металлов называют селитрами, например NaNO3 - натриевая селитра (чилийская селитра), KNO3 - калиевая селитра, NH4NO3 - аммиачная селитра. Нитраты получают действием азотной кислоты HNO3 на металлы, оксиды, гидроксиды, соли. Практически все нитраты хорошо растворимы в воде.
Нитраты устойчивы при обычной температуре. Они обычно плавятся при относительно низких температурах (200-600°C), зачастую с разложением.
Нитраты щелочных металлов разлагаются до нитритов с выделением кислорода (а при длительном нагревании ступенчато разлагаются на оксид металла, молекулярные азот и кислород, ввиду чего являются хорошими окислителями).
Нитраты металлов средней активности разлагаются при нагревании до оксидов металлов с выделением диоксида азота и кислорода.
Нитраты самых малоактивных металлов (благородные металлы) разлагаются в основном до свободных металлов с выделением диоксида азота и кислорода.
Нитраты являются достаточно сильными окислителями в твёрдом состоянии (обычно в виде расплава), но практически не обладают окислительными свойствами в растворе, в отличие от азотной кислоты.
Нитрит - соль азотистой кислоты HNO2. Нитриты термически менее устойчивы, чем нитраты. Применяются в производстве азокрасителей и в медицине.
Азотистая кислота - это одноосновная слабая кислота, которая может существовать только в разбавленных водных растворах голубого цвета и в газовой форме. Соли данной кислоты называют азотистокислым или нитритами. Они токсичны и более устойчивы, чем сама кислота. Химическая формула данного вещества выглядит так: HNO2.
Физические свойства:
1. Молярная масса равна 47 г/моль.
2. равна 27 а.е.м.
3. Плотность составляет 1,6.
4. Температура плавления равна 42 градусам.
5. Температура кипения равна 158 градусам.
Химические свойства азотистой кислоты
1. Если раствор с азотистой кислотой нагреть, то произойдет следующая химическая реакция:
3HNO2 (азотистая кислота) = HNO3 (кислота азотная) + 2NO выделяется в виде газа)+ H2O (вода)
2. В водных растворах диссоциирует и легко вытесняется из солей более сильными кислотами:
H2SO4 (серная кислота) + 2NaNO2 (нитрит натрия) = Na2SO4 (сульфат натрия) + 2HNO2 (азотистая кислота)
3. Рассматриваемое нами вещество может проявлять как окислительные, так и восстановительные свойства. При воздействии на него более сильных окислителей (например: хлор, пероксид водорода H2O2, окисляется до азотной кислоты (в некоторых случаях происходит образование соли азотной кислоты):
Восстановительные свойства:
HNO2 (азотистая кислота) + H2O2 (пероксид водорода) = HNO3 (азотная кислота) + H2O (вода)
HNO2 + Cl2 (хлор) + H2O (вода) = HNO3 (кислота азотная) + 2HCl (соляная кислота)
5HNO2 (азотистая кислота)+ 2HMnO4 = 2Mn(NO3)2 (нитрат марганца, соль азотной кислоты) + HNO3 (кислота азотная) + 3H2O (вода)
Окислительные свойства:
2HNO2 (азотистая кислота)+ 2HI = 2NO (оксид кислорода, в виде газа) + I2 (йод) + 2H2O (вода)
Получение азотистой кислоты
Данное вещество можно получить несколькими способами:
1. При растворении азота оксида (III) в воде:
N2O3 (оксид азота) + H2O (вода) = 2HNO3 (азотистая кислота)
2. При растворении азота оксида (IV) в воде:
2NO3 (оксид азота) + H2O (вода) = HNO3 (азотная кислота) + HNO2 (азотистая кислота)
Применение азотистой кислоты:
- диазотирование ароматических первичных аминов;
- производство солей диазония;
- в синтезе органических веществ (например, для производства органических красителей).
Воздействие азотистой кислоты на организм
Данное вещество токсично, обладает ярким мутагенным эффектом, так как по сути своей является деаминирующим агентом.
Что такое нитриты
Нитриты - это различные соли азотистой кислоты. К воздействию температур они менее устойчивы, чем нитраты. Необходимы при производстве некоторых красителей. Применяются в медицине.
Особенное значение приобрел для человека нитрит натрия. Это вещество имеет формулу NaNO2. Используется в качестве консерванта в пищевой промышленности при производстве изделий из рыбы и мяса. Представляет собой порошок чистого белого или слегка желтоватого цвета. Нитрит натрия гигроскопичен (исключение составляет очищенный нитрит натрия) и хорошо растворяется в H2O (воде). На воздухе способен постепенно окислиться до имеет сильные восстановительные свойства.
Натрия нитрит применяется в:
- химическом синтезе: для получения диазо-аминных соединений, для дезактивирования избытка натрия азида, для получения кислорода, натрия оксида и натрия азота, для поглощения углекислого газа;
- в производстве пищевых продуктов (пищевая добавка Е250): в качестве антиокислителя и антибактериального агента;
- в строительстве: в качестве противоморозной добавки к бетону в изготовлении конструкций и строительных изделий, в синтезе органических веществ, в роли ингибитора коррозии атмосферной, в производстве каучуков, попперсов, раствора добавки для взрывчатых веществ; при обработке металла для снятия слоя олова и при фосфатировании;
- в фотографии: как антиокислитель и реагент;
- в биологии и медицине: сосудорасширяющее, спазмолитическое, слабительное, бронхолитическое; как антидот при отравлении животного или человека цианидами.
В настоящее время также используются и другие соли азотистой кислоты (например, нитрит калия).