Valoarea legii periodice a lui Mendeleev. Raport: Sistemul periodic și importanța acestuia în dezvoltarea chimiei D.I. Mendeleev Care este sensul legii periodice
Semnificația științifică a legii periodice. Viața și opera lui D.I. Mendeleev
Descoperirea legii periodice și crearea sistemului periodic de elemente chimice este cea mai mare realizare a științei în secolul al XIX-lea. Confirmarea experimentală a maselor atomice relative modificate de D. I. Mendeleev, descoperirea elementelor cu proprietățile lor, aranjarea gazelor inerte descoperite în sistemul periodic a condus la recunoașterea universală a legii periodice.
Descoperirea legii periodice a condus la dezvoltarea rapidă în continuare a chimiei: în următorii treizeci de ani, au fost descoperite 20 de noi elemente chimice. Legea periodică a contribuit la dezvoltarea în continuare a lucrărilor privind studiul structurii atomului, în urma cărora s-a stabilit relația dintre structura atomului și schimbarea periodică a proprietăților lor. Pe baza legii periodice, oamenii de știință au putut extrage substanțe cu proprietăți dorite, pentru a sintetiza noi elemente chimice. Legea periodică a permis oamenilor de știință să construiască ipoteze despre evoluția elementelor chimice din univers.
Legea periodică a lui D. I. Mendeleev are semnificație științifică generală și este o lege fundamentală a naturii.
Dmitri Ivanovici Mendeleev s-a născut în 1834 în orașul Tobolsk. După ce a absolvit gimnaziul din Tobolsk, a studiat la Institutul Pedagogic din Sankt Petersburg, pe care l-a absolvit cu medalie de aur. Ca student, D. I. Mendeleev a început să se angajeze în cercetarea științifică. După studii, a petrecut doi ani în străinătate în laboratorul celebrului chimist Robert Bunsen. În 1863 a fost ales profesor mai întâi la Institutul Tehnologic din Sankt Petersburg, iar mai târziu la Universitatea din Sankt Petersburg.
Mendeleev a efectuat cercetări în domeniul naturii chimice a soluțiilor, al stării gazelor și al căldurii de ardere a combustibilului. A fost interesat de diverse probleme ale agriculturii, mineritului, metalurgiei, a lucrat la problema gazificării subterane a combustibilului și a studiat afacerile cu petrol. Cel mai semnificativ rezultat al activității sale creatoare, care a adus lui D. I. Mendeleev faima mondială, a fost descoperirea în 1869 a Legii periodice și a Tabelului periodic al elementelor chimice. A scris aproximativ 500 de articole despre chimie, fizică, tehnologie, economie, geodezie. A organizat și a fost directorul primei camere rusești de măsuri și greutăți, a încheiat începutul metrologiei moderne. A inventat ecuația generală de stare a unui gaz ideal, a generalizat ecuația Clapeyron (ecuația Clapeyron-Mendeleev).
Mendeleev a trăit 73 de ani. Pentru realizările sale a fost ales membru al a 90 de academii de științe străine și doctor onorific al multor universități. Cel de-al 101-lea element chimic (Mendelevius) este numit în onoarea sa.
D. I. Mendeleev scria: „Înainte de legea periodică, elementele reprezentau doar fenomene aleatorii fragmentare ale naturii; nu exista niciun motiv să ne așteptăm la altele noi, iar cele nou găsite erau o noutate complet neașteptată. Regularitatea periodică a fost prima care a făcut posibil să se vadă elemente care nu fuseseră încă descoperite la o asemenea distanță, la care viziunea neînarmată cu această regularitate nu ajunsese până atunci.
Odată cu descoperirea Legii periodice, chimia a încetat să mai fie o știință descriptivă - a primit un instrument de previziune științifică. Această lege și reprezentarea sa grafică - tabelul Tabelului periodic al elementelor chimice de D. I. Mendeleev - au îndeplinit toate cele trei funcții importante ale cunoștințelor teoretice: generalizare, explicație și prognostic. Pe baza lor, oamenii de știință:
- a sistematizat și a rezumat toate informațiile despre elementele chimice și substanțele pe care le formează;
- a dat o justificare pentru diferite tipuri de dependență periodică care există în lumea elementelor chimice, explicându-le pe baza structurii atomilor elementelor;
- a prezis, a descris proprietățile elementelor chimice încă nedescoperite și a substanțelor formate de acestea și a indicat, de asemenea, modalitățile de descoperire a acestora.
D. I. Mendeleev însuși a trebuit să sistematizeze și să generalizeze informații despre elementele chimice când a descoperit Legea periodică, și-a construit și și-a îmbunătățit tabelul. Mai mult, erorile în valorile maselor atomice și prezența elementelor încă nedescoperite au creat dificultăți suplimentare. Dar marele om de știință era ferm convins de adevărul legii naturii pe care o descoperise. Pe baza asemănării proprietăților și crezând în corectitudinea determinării locului elementelor în tabelul sistemului periodic, el a schimbat semnificativ masele și valențele atomice acceptate la acel moment în compușii cu oxigen pentru zece elemente și le-a „corectat” pentru alţi zece. El a plasat opt elemente în tabel, contrar ideilor acceptate atunci despre asemănarea lor cu altele. De exemplu, a exclus taliul din familia naturală a metalelor alcaline și l-a plasat în grupa III în funcție de cea mai mare valență pe care o prezenta; el a transferat beriliul cu o masă atomică relativă incorect determinată (13) și valența III din grupul III la II, schimbând valoarea masei sale atomice relative la 9 și valența cea mai mare la II.
Majoritatea oamenilor de știință au perceput amendamentele lui D. I. Mendeleev ca o frivolitate științifică, o insolență nerezonabilă. Legea periodică și tabelul elementelor chimice au fost considerate ca o ipoteză, adică o presupunere care trebuia verificată. Omul de știință a înțeles acest lucru și tocmai pentru a verifica corectitudinea legii pe care a descoperit-o și a sistemului de elemente, a descris în detaliu proprietățile elementelor care nu au fost încă descoperite și chiar metodele de descoperire a acestora, pe baza scopului propus. loc în sistem. Conform primei versiuni a tabelului, el a făcut patru predicții despre existența unor elemente necunoscute (galiu, germaniu, hafniu, scandiu), iar conform celei de-a doua versiune îmbunătățită, încă șapte (tehnețiu, reniu, astatin, franciu, radiu). , actiniu, protactiniu).
În perioada 1869-1886 au fost descoperite trei elemente prezise: galiu (P. E. Lecoq de Boisbaudran, Franța, 1875), scandiul (L. F. Nilsson, Suedia, 1879) și germaniul (K. Winkler, Germania, 1886). Descoperirea primului dintre aceste elemente, care a confirmat corectitudinea predicției marelui om de știință rus, a stârnit doar interes și surpriză în rândul colegilor săi. Descoperirea germaniului a fost un adevărat triumf al Legii Periodice. K. Winkler a scris în articolul „Mesaj despre germaniu”: „Nu mai există nicio îndoială că noul element nu este altceva decât ecasiliența prezisă de Mendeleev cu cincisprezece ani mai devreme. Căci o dovadă mai convingătoare a validității doctrinei periodicității elementelor cu greu poate fi dată decât întruchiparea ecasilienței până acum ipotetice și este cu adevărat ceva mai mult decât o simplă confirmare a unei teorii îndrăznețe prezentate - înseamnă o extindere remarcabilă a câmpului vizual chimic, un pas puternic în domeniul cunoașterii”.
Pe baza legii și a tabelului lui D. I. Mendeleev au fost prezise și descoperite gazele nobile. Și acum această lege servește ca o stea călăuzitoare pentru descoperirea sau crearea artificială de noi elemente chimice. De exemplu, s-ar putea argumenta că elementul #114 este similar cu plumbul (ekaslead) și #118 ar fi un gaz nobil (ekaradon).
Descoperirea Legii periodice și crearea unui tabel al Sistemului periodic al elementelor chimice de către D. I. Mendeleev a stimulat căutarea motivelor relației elementelor, a contribuit la identificarea structurii complexe a atomului și la dezvoltarea teoria structurii atomului. Această învățătură, la rândul său, a făcut posibilă dezvăluirea semnificației fizice a Legii periodice și explicarea aranjamentului elementelor în Sistemul periodic. A dus la descoperirea energiei atomice și la utilizarea acesteia pentru nevoile omenirii.
Întrebări și sarcini la § 5
- Analizați distribuția macronutrienților biogene pe perioade și grupuri din Tabelul periodic al lui D. I. Mendeleev. Amintiți-vă că acestea includ C, H, O, N, Ca, S, P, K, Mg, Fe.
- De ce elementele principalelor subgrupe ale perioadei a 2-a și a 3-a sunt numite analogi chimici? Care este această analogie?
- De ce hidrogenul, spre deosebire de toate celelalte elemente, este înregistrat de două ori în Tabelul periodic al lui D. I. Mendeleev? Demonstrați legitimitatea poziției duale a hidrogenului în sistemul periodic prin compararea structurii și proprietăților atomului său, substanței simple și compușilor acestuia cu formele corespunzătoare de existență a altor elemente - metale alcaline și halogeni.
- De ce sunt atât de asemănătoare proprietățile lantanului și lantanidelor, actiniului și actinidelor?
- Ce forme de compuși vor fi aceleași pentru elementele subgrupurilor principale și secundare?
- De ce formulele generale ale compușilor hidrogen volatili din sistemul periodic sunt scrise numai sub elementele subgrupurilor principale, iar formulele oxizilor superiori - sub elementele ambelor subgrupe (în mijloc)?
- Care este formula generală a hidroxidului superior corespunzător elementelor grupei VII? Care este caracterul lui?
Sistemul periodic al D.I. Mendeleev a devenit o piatră de hotar în dezvoltarea științei atomice și moleculare. Datorită ei, s-a format un concept modern de element chimic, s-au clarificat ideile despre substanțe și compuși simpli.
Această lege avea putere de predicție. El a permis să efectueze o căutare țintită pentru elemente noi, încă nedescoperite. Greutățile atomice ale multor elemente, determinate anterior insuficient de precis, au fost supuse verificării și perfecționării tocmai pentru că valorile lor eronate intrau în conflict cu Legea periodică.
Rolul predictiv al sistemului periodic, arătat de Mendeleev, s-a manifestat în secolul al XX-lea în evaluarea proprietăților chimice ale elementelor transuraniului.
Noutatea fundamentală a Legii periodice, descoperită și formulată de D.I. Mendeleev a fost după cum urmează:
1. S-a stabilit o conexiune între elemente NU ASEMĂNĂRĂ în proprietățile lor. Această relație constă în faptul că proprietățile elementelor se schimbă fără probleme și aproximativ în mod egal cu creșterea greutății lor atomice, iar apoi aceste modificări se repetă PERIOD.
2. În acele cazuri în care părea că lipsește o legătură în succesiunea modificărilor proprietăților elementelor, Tabelul Periodic prevedea GAPS care trebuiau completate cu elemente încă nedescoperite. Mai mult, Legea periodică a făcut posibilă PREVIZIA proprietăților acestor elemente.
De la apariția Legii Periodice, chimia a încetat să mai fie o știință descriptivă. După cum celebrul chimist rus N.D. Zelinsky, Legea periodică a fost „descoperirea interconexiunii tuturor atomilor din univers”.
Descoperirile ulterioare în chimie și fizică au confirmat în mod repetat sensul fundamental al Legii periodice. Au fost descoperite gaze inerte care se potrivesc perfect în Tabelul Periodic - acest lucru este arătat în mod deosebit de forma lungă a tabelului. Numărul de serie al elementului s-a dovedit a fi egal cu sarcina nucleului atomului acestui element. Multe elemente necunoscute anterior au fost descoperite datorită unei căutări țintite pentru exact acele proprietăți care au fost prezise de Tabelul Periodic.
Sistemul periodic al lui Mendeleev a fost un fel de hartă de ghidare în studiul chimiei anorganice și lucrările de cercetare în acest domeniu.
Apariția sistemului periodic a deschis o nouă eră, cu adevărat științifică, în istoria chimiei și a unui număr de științe conexe - în loc de informații împrăștiate despre elemente și compuși, a apărut un sistem armonios, pe baza căruia a devenit posibilă generalizarea, trage concluzii și prevede.
În istoria dezvoltării științei, sunt cunoscute multe descoperiri majore. Dar puține dintre ele pot fi comparate cu ceea ce a făcut Mendeleev. Legea periodică a elementelor chimice a devenit baza științifică naturală pentru doctrina materiei, structura și evoluția ei în natură.
Oamenii de știință americani (G. Seaborg și alții), care au sintetizat elementul nr. 101 în 1955, i-au dat numele Mendelevium „... în semn de recunoaștere a priorității marelui chimist rus, care a fost primul care a folosit sistemul periodic de elemente. . Pentru a prezice proprietățile chimice ale elementelor nedescoperite atunci. Acest principiu a fost cheia descoperirii aproape tuturor elementelor transuraniului.
În 1964, numele lui Mendeleev a fost inclus în Consiliul de Onoare al Științei al Universității din Bridgeport (SUA) printre numele celor mai mari oameni de știință din lume.
Posibilitatea predicției științifice a elementelor necunoscute a devenit realitate abia după descoperirea legii periodice și a sistemului periodic de elemente. D. I. Mendeleev a prezis existența a 11 elemente noi: ekabor, ekasilicon, ekaaluminiu etc. „Coordonatele” elementului din sistemul periodic (număr de serie, grup și perioadă) au făcut posibilă prezicerea aproximativă a masei atomice, precum și a celor mai importante proprietăți ale elementului prezis. Precizia acestor predicții a crescut mai ales atunci când elementul prezis a fost înconjurat de elemente cunoscute și suficient studiate.
Datorită acestui fapt, în 1875 în Franța, L. de Boisbaudran a descoperit galiul (ekaaluminiu); în 1879 L. Nilson (Suedia) a descoperit scandiul (ekabor); în 1886 în Germania K. Winkler a descoperit germaniul (ecasilicon).
În ceea ce privește elementele nedescoperite ale rândurilor al nouălea și al zecelea, afirmațiile lui D. I. Mendeleev au fost mai precaute, deoarece proprietățile lor au fost studiate extrem de prost. Deci, după bismut, pe care s-a încheiat perioada a șasea, au rămas două liniuțe. Unul corespundea unui analog al telurului, celălalt aparținea unui halogen greu necunoscut. În a șaptea perioadă, au fost cunoscute doar două elemente - toriu și uraniu. D. I. Mendeleev a lăsat mai multe celule cu liniuțe, care ar fi trebuit să aparțină elementelor din primul, al doilea și al treilea grup, precedând toriu. Între toriu și uraniu a rămas și o cușcă goală. Au rămas cinci locuri goale pentru uraniu, adică. aproape 100 de ani mai târziu, au fost prevăzute elemente transuraniu.
Pentru a confirma acuratețea predicțiilor lui D. I. Mendeleev cu privire la elementele din seria a noua și a zecea, putem da un exemplu cu poloniu (numărul de serie 84). Prevăzând proprietățile elementului cu numărul atomic 84, D. I. Mendeleev l-a desemnat ca un analog al telurului și l-a numit diteluriu. Pentru acest element, el a presupus o masă atomică de 212 și capacitatea de a forma un oxid de tip EO e. Acest element ar trebui să aibă o densitate de 9,3 g/cm 3 și să fie un metal cenușiu cu punct de topire scăzut, cristalin și nevolatil. Poloniul, care a fost obținut în formă pură abia în 1946, este un metal moale, fuzibil, de culoare argintie, cu o densitate de 9,3 g/cm 3 . Proprietățile sale sunt similare cu cele ale telurului.
Legea periodică a lui D. I. Mendeleev, fiind una dintre cele mai importante legi ale naturii, are o importanță excepțională. Reflectând relația naturală care există între elemente, etapele de dezvoltare a materiei de la simplu la complex, această lege a pus bazele chimiei moderne. Odată cu descoperirea sa, chimia a încetat să mai fie o știință descriptivă.
Legea periodică și sistemul de elemente ale lui D. I. Mendeleev sunt una dintre metodele de încredere pentru înțelegerea lumii. Deoarece elementele sunt unite printr-o proprietate sau structură comună, aceasta indică tiparele de interconectare și interdependență a fenomenelor.
Toate elementele împreună constituie o linie de dezvoltare continuă de la cel mai simplu hidrogen până la al 118-lea element. Un astfel de model a fost observat pentru prima dată de D. I. Mendeleev, care a reușit să prezică existența unor elemente noi, arătând astfel continuitatea dezvoltării materiei.
Prin compararea proprietăților elementelor și compușilor acestora în cadrul grupurilor, se poate detecta cu ușurință manifestarea legii privind trecerea modificărilor cantitative în cele calitative. Deci, în orice perioadă, există o tranziție de la un metal tipic la un nemetal tipic (halogen), cu toate acestea, trecerea de la un halogen la primul element al perioadei următoare (un metal alcalin) este însoțită de apariția proprietăților. care sunt net opus acestui halogen. Descoperirea lui D. I. Mendeleev a pus o bază exactă și de încredere pentru teoria structurii atomului, având un impact imens asupra dezvoltării tuturor cunoștințelor moderne despre natura materiei.
Lucrările lui D. I. Mendeleev privind crearea sistemului periodic a marcat începutul unei metode bazate științific pentru căutarea intenționată a unor noi elemente chimice. Numeroase progrese în fizica nucleară modernă pot servi drept exemple. În ultima jumătate de secol, au fost sintetizate elemente cu numerele de serie 102-118. Studiul proprietăților lor, precum și obținerea lor, ar fi imposibil fără cunoașterea tiparelor relației dintre elementele chimice.
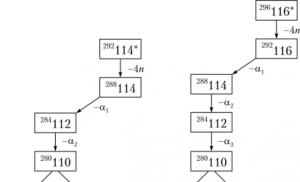
Dovezile pentru o astfel de afirmație sunt rezultate cercetări privind sinteza elementelor 114, 116, 118 .
Izotopul elementului 114 a fost obținut prin interacțiunea plutoniului cu izotopul 48Ca, iar al 116-lea izotop prin interacțiunea curiumului cu izotopul 48Ca:
Stabilitatea izotopilor rezultați este atât de mare încât nu se fisiază spontan, ci suferă dezintegrare alfa, adică. fisiunea nucleului cu emisia simultană de particule alfa.
Datele experimentale obținute confirmă pe deplin calculele teoretice: pe măsură ce alfa se descompun succesive, se formează nucleele elementelor 112 și 110, după care începe fisiunea spontană:

Comparând proprietățile elementelor, suntem convinși că acestea sunt interconectate printr-o caracteristică structurală comună. Astfel, prin compararea structurii învelișurilor de electroni exterioare și pre-exterioare, este posibil să se prezică cu mare precizie toate tipurile de compuși caracteristici unui element dat. O astfel de relație clară este foarte bine ilustrată de exemplul celui de-al 104-lea element - rutherfordium. Chimiștii au prezis că, dacă acest element este un analog al hafniului (72 Hf), atunci proprietățile sale de tetraclorură ar trebui să fie aproximativ aceleași cu HfCl 4 . Studiile chimice experimentale au confirmat nu numai prognoza chimiștilor, ci și descoperirea unui nou element supergreu 1 (M Rf. Aceeași analogie poate fi urmărită în proprietățile - Os (Z = 76) și Ds (Z = 110) - ambele elementele formează oxizi volatili de tip R0 4. Toate acestea vorbesc manifestare a legii interconectarii si interdependentei fenomenelor.
Compararea proprietăților elementelor atât în cadrul grupurilor, cât și al perioadelor și compararea lor cu structura atomului indică legea trecerea de la cantitate la calitate. Trecerea modificărilor cantitative în cele calitative este posibilă numai prinnegaţia negaţiei.În anumite perioade, odată cu creșterea sarcinii nucleului, are loc o tranziție de la un metal alcalin la un gaz nobil. Următoarea perioadă începe din nou cu un metal alcalin - un element care neagă complet proprietățile gazului nobil care l-a precedat (de exemplu, He și Li; Ne și Na; Ar și Kg etc.).
În fiecare perioadă, sarcina nucleului următorului element crește cu unul față de cel precedent. Acest proces este observat de la hidrogen la al 118-lea element și indică continuitatea dezvoltării materiei.
În fine, combinarea sarcinilor opuse (proton și electron) într-un atom, manifestarea proprietăților metalice și nemetalice, existența oxizilor și hidroxizilor amfoteri este o manifestare a legii. unitatea și lupta contrariilor.
De asemenea, trebuie remarcat faptul că descoperirea legii periodice a fost începutul cercetărilor fundamentale privind proprietățile materiei.
În cuvintele lui Niels Bohr, sistemul periodic este „o stea călăuzitoare pentru cercetarea în domeniul chimiei, fizicii, mineralogiei și tehnologiei”.
- Elementele 112, 114, 116, 118 au fost obținute la Institutul Comun de Cercetare Nucleară (Dubna, Rusia). Elementele 113 și 115 au fost obținute în comun de fizicienii ruși și americani. Materialul a fost oferit cu amabilitate de Yu. Ts. Oganesyan, academician al Academiei Ruse de Științe.
legea periodică a atomului Mendeleev
Legea periodică a făcut posibilă aducerea în sistem și generalizarea unei cantități uriașe de informații științifice în chimie. Această funcție a legii se numește integratoare. Se manifestă mai ales clar în structurarea materialului științific și educațional al chimiei. Academicianul A.E. Fersman a spus că sistemul a unit toată chimia în cadrul unei singure conexiuni spațiale, cronologice, genetice, energetice.
Rolul integrator al Legii periodice s-a manifestat și prin faptul că unele date despre elemente, pretins ieșite din tipare generale, au fost verificate și rafinate atât de autor însuși, cât și de adepții săi.
Acest lucru s-a întâmplat cu caracteristicile beriliului. Înainte de lucrările lui Mendeleev, era considerat un analog trivalent al aluminiului datorită așa-numitei lor similitudini diagonale. Astfel, în a doua perioadă au existat două elemente trivalente și nu un singur element divalent. În această etapă, mai întâi la nivelul construcțiilor de modele mentale, Mendeleev a bănuit o eroare în studiul proprietăților beriliului. Apoi a găsit lucrarea chimistului rus Avdeev, care susținea că beriliul este divalent și are o greutate atomică de 9. Lucrarea lui Avdeev a rămas neobservată de lumea științifică, autorul a murit devreme, aparent fiind otrăvit de compuși de beriliu extrem de otrăvitori. Rezultatele cercetării lui Avdeev au fost stabilite în știință datorită Legii periodice.
Astfel de modificări și perfecționări ale valorilor atât ale greutăților atomice, cât și ale valențelor au fost făcute de Mendeleev pentru încă nouă elemente (In, V, Th, U, La, Ce și alte trei lantanide). Încă zece elemente aveau corectate doar greutățile atomice. Și toate aceste perfecționări au fost ulterior confirmate experimental.
În același mod, opera lui Karl Karlovich Klaus l-a ajutat pe Mendeleev să formeze un fel de grup VIII de elemente, explicând asemănările orizontale și verticale în triadele de elemente:
fier cobalt nichel
Ruteniu Rodiu Paladiu
octium iridium platină
Funcția de prognostic (predictivă) a Legii periodice a primit cea mai izbitoare confirmare în descoperirea elementelor necunoscute cu numerele de serie 21, 31 și 32. Existența lor a fost prezisă mai întâi la nivel intuitiv, dar odată cu formarea sistemului, Mendeleev a fost capabile să-și calculeze proprietățile cu un grad ridicat de acuratețe. Povestea binecunoscută a descoperirii scandiului, galiului și germaniului a fost triumful descoperirii lui Mendeleev. F. Engels a scris: „Aplicând inconștient legea hegeliană privind tranziția cantității în calitate, Mendeleev a realizat o ispravă științifică care poate fi pusă în siguranță alături de descoperirea lui Laverrier, care a calculat orbita planetei necunoscute Neptun”. Cu toate acestea, există dorința de a argumenta cu clasicul. În primul rând, toate cercetările lui Mendeleev, începând din anii studenției, s-au bazat destul de conștient pe legea hegeliană. În al doilea rând, Laverrier a calculat orbita lui Neptun conform legilor cunoscute și dovedite ale lui Newton, iar D. I. Mendeleev a făcut toate predicțiile pe baza legii universale a naturii descoperite de el.
La sfârșitul vieții sale, Mendeleev nota cu satisfacție: „În timp ce scriam în 1871 un articol despre aplicarea legii periodice la determinarea proprietăților elementelor încă nedescoperite, nu credeam că voi trăi pentru a justifica această consecință. a legii periodice, dar realitatea a răspuns diferit. Trei elemente au fost descrise de mine: ecabor, ecaaluminiu și ecasiliciu, iar la mai puțin de 20 de ani am avut cea mai mare bucurie să-i văd pe toți trei descoperiți... L. de Boisbaudran, Nilsson și Winkler, la rândul meu, îi consider adevărați întăritori ai legea periodică. Fără ei, nu ar fi fost recunoscut în aceeași măsură ca acum.” În total, Mendeleev a prezis douăsprezece elemente.
De la bun început, Mendeleev a subliniat că legea descrie proprietățile nu numai ale elementelor chimice în sine, ci și ale multor compuși ai acestora, inclusiv ale celor necunoscuti până acum. Este suficient să dai un exemplu pentru a confirma acest lucru. Din 1929, când academicianul P. L. Kapitsa a descoperit pentru prima dată conductivitatea nemetalică a germaniului, dezvoltarea teoriei semiconductorilor a început în toate țările lumii. A devenit imediat clar că elementele cu astfel de proprietăți ocupă subgrupul principal al grupului IV. De-a lungul timpului, s-a înțeles că compușii elementelor situate în perioade echidistante de acest grup (de exemplu, cu o formulă generală precum AzB;) ar trebui să aibă proprietăți semiconductoare într-o măsură mai mare sau mai mică. Acest lucru a făcut imediat căutarea de noi semiconductori, practic importanți, intenționată și previzibilă. Aproape toate electronicele moderne se bazează pe astfel de conexiuni.
Este important de menționat că predicțiile în cadrul Sistemului Periodic au fost făcute chiar și după recunoașterea sa universală. În 1913 Mose-lee a descoperit că lungimea de undă a razelor X, care sunt obținute din anticatozi din diferite elemente, se modifică în mod regulat în funcție de numărul de serie atribuit în mod convențional elementelor din sistemul Periodic. Experimentul a confirmat că numărul atomic al unui element are o semnificație fizică directă. Abia mai târziu numerele de serie au fost asociate cu valoarea sarcinii pozitive a nucleului. Pe de altă parte, legea lui Moseley a făcut posibilă confirmarea imediată experimentală a numărului de elemente în perioade și, în același timp, prezicerea locurilor de hafniu (nr. 72) și reniu (nr. 75) care nu fuseseră încă descoperit până atunci.
Aceleași studii ale lui Moseley au făcut posibilă înlăturarea „durerii de cap” serioase pe care Mendeleev i-a dat-o anumite abateri de la seria corectă de elemente crescânde în tabelul maselor atomice. Mendeleev le-a făcut sub presiunea analogiilor chimice, parțial la nivel de expert și parțial la nivel intuitiv. De exemplu, cobaltul a fost înaintea nichelului în tabel, iar iodul cu o greutate atomică mai mică a urmat telurul mai greu. În științele naturii se știe de mult că un fapt „urât”, care nu se încadrează în cadrul celei mai frumoase teorii, îl poate strica. În mod similar, abaterile inexplicabile au amenințat Legea periodică. Dar Moseley a demonstrat experimental că numerele de serie ale cobaltului (nr. 27) și nichelului (nr. 28) corespund exact cu poziția lor în sistem. S-a dovedit că aceste excepții nu fac decât să confirme regula generală.
O predicție importantă a fost făcută în 1883 de Nikolai Aleksandrovici Morozov. Pentru participarea la mișcarea Narodnaya Volya, studentul la chimie Morozov a fost condamnat la moarte, ulterior comutat în închisoare pe viață în izolare. A petrecut aproximativ treizeci de ani în închisorile regale. Un prizonier al cetății Shlisselburg a avut ocazia să primească ceva literatură științifică despre chimie. Pe baza analizei intervalelor de greutăți atomice dintre grupurile vecine de elemente din tabelul periodic, Morozov a ajuns la o concluzie intuitivă cu privire la posibilitatea existenței unui alt grup de elemente necunoscute cu „proprietăți zero” între grupurile de halogeni și alcaline. metale. El a sugerat să le cauți în compoziția aerului. Mai mult, el a prezentat o ipoteză despre structura atomilor și, pe baza acesteia, a încercat să dezvăluie cauzele periodicității în proprietățile elementelor.
Cu toate acestea, ipotezele lui Morozov au devenit disponibile pentru discuție mult mai târziu, când a fost eliberat după evenimentele din 1905. Dar până atunci, gazele inerte fuseseră deja descoperite și studiate.
Multă vreme, faptul existenței gazelor inerte și poziția lor în tabelul periodic a stârnit serioase controverse în lumea chimică. Mendeleev însuși a crezut de ceva timp că o substanță simplă necunoscută de tipul Nj ar putea fi ascunsă sub numele de argon descoperit. Prima presupunere rațională despre locul gazelor inerte a fost făcută de autorul descoperirii lor, William Ramsay. Și în 1906, Mendeleev scria: „Când a fost stabilit Tabelul Periodic (18b9), nu numai că argonul nu era cunoscut, dar nu exista niciun motiv să bănuiască posibilitatea existenței unor astfel de elemente. Astăzi... aceste elemente, în ceea ce privește greutățile lor atomice, au ocupat locul exact între halogeni și metalele alcaline.
Multă vreme a existat o dispută: să se separe gazele inerte într-un grup zero independent de elemente sau să le considere subgrupul principal al grupului VIII. Fiecare punct de vedere are argumentele sale pro și contra.
Pe baza poziției elementelor în Tabelul Periodic, chimiștii teoreticieni conduși de Linus Pauling s-au îndoit de multă vreme de pasivitatea chimică completă a gazelor inerte, indicând direct posibila stabilitate a fluorurilor și oxizilor acestora. Dar abia în 1962, chimistul american Neil Bartlett a efectuat pentru prima dată reacția hexafluorurei de platină cu oxigenul în cele mai obișnuite condiții, obținând XePtF ^ hexafluoroplatinat de xenon, iar după el alți compuși gazoși, care acum sunt mai corect numiți mai degrabă nobili. decât inert.
Legea periodică își păstrează funcția predictivă până astăzi.
Trebuie remarcat faptul că predicțiile membrilor necunoscuți ai oricărui set pot fi de două tipuri. Dacă sunt prezise proprietățile unui element care se află în interiorul unei serii cunoscute de altele similare, atunci o astfel de predicție se numește interpolare. Este firesc să presupunem că aceste proprietăți vor fi supuse acelorași legi ca și proprietățile elementelor învecinate. Așa au fost prezise proprietățile elementelor lipsă din tabelul periodic. Este mult mai dificil de prevăzut caracteristicile noilor membri ai setului dacă aceștia sunt în afara părții descrise. Extrapolarea - predicția valorilor funcției care se află în afara unui set de modele cunoscute - este întotdeauna mai puțin sigură.
Această problemă s-a confruntat pe oamenii de știință atunci când a început căutarea elementelor dincolo de granițele cunoscute ale sistemului. La începutul secolului XX. tabelul periodic se termina cu uraniu (nr. 92). Primele încercări de a obține elemente transuraniu au fost făcute în 1934, când Enrico Fermi și Emilio Segre au bombardat uraniu cu neutroni. Astfel a început drumul către actinoizi și transactinoizi.
Reacțiile nucleare sunt, de asemenea, folosite pentru a sintetiza alte elemente necunoscute anterior.
Elementul nr. 101, sintetizat artificial de Yeyenne Theodor Seaborg și colaboratorii săi, a fost numit Mendelevium. Seaborg însuși a spus asta despre asta: „Este deosebit de semnificativ să remarcăm că elementul 101 este numit după marele chimist rus D. I. Mendeleev de către oamenii de știință americani, care l-au considerat întotdeauna un pionier în chimie.”
Numărul de elemente nou descoperite, sau mai degrabă, create artificial este în continuă creștere. Sinteza celor mai grele nuclee de elemente cu numere atomice 113 și 115 a fost efectuată la Institutul Comun Rus de Cercetări Nucleare din Dubna prin bombardarea nucleelor de americiu obținut artificial cu nuclee ale izotopului greu de calciu-48. În acest caz, apare nucleul elementului nr. 115, care se descompune imediat odată cu formarea nucleului elementului nr. 113. Astfel de elemente supergrele nu există în natură, dar apar în timpul exploziilor supernovei și ar putea exista și în timpul Big bang. Studiul lor ajută la înțelegerea modului în care universul nostru a luat ființă.
În total, în natură se găsesc 39 de izotopi radioactivi naturali. Diferiți izotopi se descompun cu viteze diferite, care se caracterizează prin timpul de înjumătățire. Timpul de înjumătățire al uraniului-238 este de 4,5 miliarde de ani, iar pentru alte elemente poate fi egal cu milioanemii de secundă.
Elementele radioactive, care se descompun secvențial, transformându-se unele în altele, formează rânduri întregi. Sunt cunoscute trei astfel de serii: conform elementului inițial, toți membrii seriei sunt combinați în familii de uraniu, actinouraniu și toriu. O altă familie este formată din izotopi radioactivi obținuți artificial. În toate familiile, transformările culminează cu formarea atomilor de plumb neradioactivi.
Deoarece în scoarța terestră pot fi găsiți numai izotopi, al căror timp de înjumătățire este proporțional cu vârsta Pământului, se poate presupune că, de-a lungul a miliarde de ani din istoria sa, au existat și astfel de izotopi de scurtă durată. care acum s-au stins în sensul literal al cuvântului. Acestea au inclus probabil izotopul greu de potasiu-40. Ca urmare a dezintegrarii sale complete, valoarea de masă a masei atomice a potasiului de astăzi este de 39,102, deci este inferioară ca masă elementului nr. 18 argon (39,948). Astfel se explică excepțiile în creșterea succesivă a maselor atomice ale elementelor din tabelul periodic.
Academicianul V. I. Gol'danskii într-un discurs dedicat memoriei lui Mendeleev a remarcat „rolul fundamental pe care îl joacă lucrările lui Mendeleev chiar și în domenii complet noi ale chimiei care au apărut la zeci de ani după moartea strălucitului creator al Sistemului Periodic”.
Știința este istoria și depozitarul înțelepciunii și experienței veacurilor, contemplarea lor rațională și judecata încercată.
D. I. Mendeleev
Rareori se întâmplă ca o descoperire științifică să se dovedească a fi ceva complet neașteptat, aproape întotdeauna este anticipat:
cu toate acestea, este adesea dificil pentru generațiile ulterioare, care folosesc răspunsuri testate și testate la toate întrebările, să aprecieze cât de greu a fost pentru predecesorii lor.
C. Darwin
Fiecare dintre științele despre lumea din jurul nostru are obiectul de studiu al formelor specifice de mișcare a materiei. Ideile predominante iau în considerare aceste forme de mișcare în ordinea creșterii complexității lor:
mecanic - fizic - chimic - biologic - social. Fiecare dintre formele ulterioare nu le respinge pe cele anterioare, ci le include.
Nu întâmplător, la celebrarea centenarului descoperirii Legii Periodice, G. T. Seaborg și-a dedicat raportul celor mai recente realizări din chimie. În ea, el a lăudat meritele uimitoare ale omului de știință rus: „Când luăm în considerare evoluția Sistemului Periodic de pe vremea lui Mendeleev, cea mai impresionantă impresie este că a fost capabil să creeze Sistemul Periodic al Elementelor, deși Mendeleev nu a făcut-o. cunoașteți astfel de concepte general acceptate acum, cum ar fi structura nucleară și izotopi, relația numerelor de serie cu valența, natura electronică a atomilor, periodicitatea proprietăților chimice explicate de structura electronică și, în sfârșit, radioactivitatea.
Putem cita cuvintele academicianului A.E. Fersman, care a acordat atenție viitorului: „Vor apărea și vor muri noi teorii, generalizări strălucitoare. Noile idei vor înlocui conceptele noastre deja învechite despre atom și electron. Cele mai mari descoperiri și experimente vor anula trecutul și vor deschide orizonturi de noutate și amploare incredibile pentru astăzi - toate acestea vor veni și vor dispărea, dar Legea periodică a lui Mendeleev va trăi mereu și va ghida căutările.