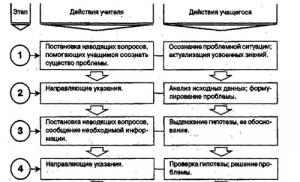
Значения рн растворов гидролизующихся солей. Игровой автомат Sharky (игра Рыбак) играть онлайн бесплатно без регистрации Ph кислых солей
Гидро́лиз (от др.-греч. ὕδωρ - вода и λύσις - разложение) - один из видов химических реакций сольволиза, где при взаимодействии веществ с водой происходит разложение исходного вещества с образованием новых соединений. Механизм гидролиза соединений различных классов: соли, углеводы, белки, сложные эфиры, жиры и др. имеет существенные различия.
Гидролиз солей - разновидность реакций гидролиза, обусловленного протеканием реакций ионного обмена в растворах (преимущественно, водных) растворимых солей-электролитов. Движущей силой процесса является взаимодействие ионов с водой, приводящее к образованию слабого электролита в ионном или (реже) молекулярном виде («связывание ионов »).
Различают обратимый и необратимый гидролиз солей
· 1. Гидролиз соли слабой кислоты и сильного основания (гидролиз по аниону):
(раствор имеет слабощелочную среду, реакция протекает обратимо
· 2. Гидролиз соли сильной кислоты и слабого основания (гидролиз по катиону):
(раствор имеет слабокислую среду, реакция протекает обратимо , гидролиз по второй ступени протекает в ничтожной степени)
· 3. Гидролиз соли слабой кислоты и слабого основания:
(равновесие смещено в сторону продуктов, гидролиз протекает практически полностью , так как оба продукта реакции уходят из зоны реакции в виде осадка или газа).
Соль сильной кислоты и сильного основания не подвергается гидролизу, и раствор нейтрален. См. также Электролитическая диссоциация.
Степень гидролиза
Под степенью гидролиза
подразумевается отношение части соли, подвергающейся гидролизу, к общей концентрации её ионов в растворе. Обозначается α
(или h гидр
);
α
= (c
гидр /c
общ)·100 %
где c
гидр - число молей гидролизованной соли, c
общ - общее число молей растворённой соли.
Степень гидролиза соли тем выше, чем слабее кислота или основание, её образующие.
Является количественной характеристикой гидролиза.
Константа гидролиза - константа равновесия гидролитической реакции. Так константа гидролиза соли равна отношению произведения равновесных концентраций продуктов реакции гидролиза к равновесной концентрации соли с учетом стехиометрических коэффициентов.
В общем случае для соли, образованной слабой кислотой и сильным основанием:
![]() , где - константа диссоциации слабой кислоты, образующейся при гидролизе
, где - константа диссоциации слабой кислоты, образующейся при гидролизе
для соли, образованной сильной кислотой и слабым основанием:
![]() , где - константа диссоциации слабого основания, образующегося при гидролизе
, где - константа диссоциации слабого основания, образующегося при гидролизе
для соли, образованной слабой кислотой и слабым основанием:
![]()
Расчет pH:
Водоро́дный показа́тель , pH (произносится «пэ аш», английское произношение англ. pH - piː"eɪtʃ «Пи эйч») - мера активности (в очень разбавленных растворах она эквивалентна концентрации)ионов водорода в растворе, и количественно выражающая его кислотность, вычисляется как отрицательный (взятый с обратным знаком) десятичный логарифм активности водородных ионов, выраженной в молях на литр:
![]()
Вывод значения pH
В чистой воде при 25 °C концентрации ионов водорода () и гидроксид-ионов () одинаковы и составляют 10 −7 моль/л, это напрямую следует из определения ионного произведения воды, которое равно · и составляет 10 −14 моль²/л² (при 25 °C).
Когда концентрации обоих видов ионов в растворе одинаковы, говорят, что раствор имеет нейтральную реакцию. При добавлении к воде кислоты концентрация ионов водорода увеличивается, а концентрация гидроксид-ионов соответственно уменьшается, при добавлении основания - наоборот, повышается содержание гидроксид-ионов, а концентрация ионов водорода падает. Когда > говорят, что раствор является кислым , а при > - щелочным .
Для удобства представления, чтобы избавиться от отрицательного показателя степени, вместо концентраций ионов водорода пользуются их десятичным логарифмом, взятым с обратным знаком, который собственно и является водородным показателем - pH.
![]()
Несколько меньшее распространение получила обратная pH величина - показатель основности раствора, pOH, равная отрицательному десятичному логарифму концентрации в растворе ионов OH − :
как в любом водном растворе при 22 °C , очевидно, что при этой температуре.
Растворы гидролизующихся солей находят применение в медицинской практике. Так, при попадании на кожу растворов кислот пораженные участки обрабатывают сначала водой, а затем раствором карбоната натрия Na 2 CO 3 . Такой способ позволяет нейтрализовать остатки кислоты, так как водный раствор Na 2 CO 3 имеет щелочную реакцию. Однако растворы Na 2 CO 3 вряд ли следует применять для снижения повышенной кислотности желудочного сока ввиду достаточно высокой щелочности. Для этих целей применяют растворы гидрокарбоната натрия NaHCO 3 , которые характеризуются более низким значением pH. В этой связи, для точного использования препарата, действие которого основано на гидролизе, врачу необходимо уметь оценивать величины pH растворов гидролизующихся солей.
1. В растворах солей типаNH 4 Cl:
где , pC, - отрицательные десятичные логарифмы соответствующих величин.
Так как при t 0 = 20-25 0 C = 14, то , следовательно:
2. В растворах солей типаCH 3 COONa:
3. В растворах солей типаNH 4 CN:
В случае равенства = дробная часть формулы обратится в ноль и рН = 7.
Если соль гидролизуется в несколько ступеней, то можно считать, что значение рН раствора этой соли будет определяться только первой ступенью гидролиза.
Эталоны решения задач
1. Вычислить константу и степень гидролиза соли NH 4 Cl в растворе с С(NH 4 Cl) = 0,1 моль/л, если (NH 3 ×Н 2 О) = 1,8×10 - 5 .
NH 4 Cl + H-OH ⇄ NH 3 ∙H 2 O + HCl2. Вычислить константу и степень гидролиза Na 2 CO 3 по первой ступени в растворе с С(Na 2 CO 3) = 0,01 моль/л, если для H 2 CO 3 = 4×10 - 7 ; = 5×10 - 11 .
Гидролиз Na 2 CO 3 протекает ступенчато:
Na 2 CO 3 + H-OH ⇄ NaHCO 3 + NaОН (1 ступень)
В сокращенном виде уравнение выглядит так:
CO 3 2 - + H-OH ⇄ HCO 3 - + ОН -NaHCO 3 + H-OH ⇄ H 2 CO 3 + NaОН (2 ступень)
HCO 3 - + H-OH ⇄ H 2 CO 3 + ОН -Гидролиз Na 2 CO 3 по первой ступени приводит к образованию гидрокарбонат-иона HCO 3 - , который является слабым электролитом:
HCO 3 - ⇄ H + + СО 3 2 -
Данное уравнение соответствует диссоциации H 2 CO 3 по второй ступени и характеризуется константой (H 2 CO 3) = 5×10 - 11 .
3. Сравнить степень гидролиза NaNO 2 в растворах соли с концентрациями 0,1 и 0,001 моль/л, если (HNO 2) = 4×10 - 4 .
Введем обозначения: С 1 = 0,1 моль/л; С 2 = 0,001 моль/л.
Тогда:  ;
;  .
.
Разделим одно выражение на другое и получим:
NaCN + H-OH ⇄ HCN + NaOH



pH > 7 среда слабощелочная.
6. Найти разность значений рН растворов Na 2 S и NaHS с одинако-выми концентрациями солей, если (Н 2 S) = 7, (Н 2 S) = 13.
Вычтем из первого уравнения второе и получим:
Вопросы для самоконтроля
1. Какой процесс называется гидролизом соли?
2. Какова причина изменения рН раствора за счет гидролиза?
2. Какие типы солей подвергаются гидролизу в растворе? Приведите примеры.
3. Почему соли типа NaCl, KI, СаС1 2 не подвергаются гидролизу?
4. В каких случаях при гидролизе солей образуются кислые (основные) соли? Приведите примеры.
5. В каких случаях происходит необратимый гидролиз соли? Приведите примеры.
6. Какие продукты образуются при взаимодействии хлорида хрома (III) и сульфида аммония (NH 4) 2 S в водном растворе?
7. Что называется константой гидролиза? От каких факторов зависит и от каких не зависит константа гидролиза?
8. Что называется степенью гидролиза? Как она связана с константой гидролиза различных типов солей?
9. Какие факторы влияют на величину степени гидролиза соли?
10. Почему степень гидролиза увеличивается при повышении температуры?
11. Для, каких солей разбавление раствора практически не влияет на степень гидролиза?
12. Каким способом можно гидролизовать FeCl 3 до образования Fe(OH) 3 ?
13. При гидролизе каких солей рН раствора близок к 7?
14. Почему раствор NaHCO 3 имеет слабощелочную реакцию, а раствор NaHSO 3 - слабокислую? (H 2 CO 3) = 4×10 - 7 , (H 2 SO 3) = 1,7×10 - 2 .
15. Необходимо приготовить раствор соли FeSO 4 , при гидролизе которой образуется малорастворимое соединение (раствор мутнеет). В какой среде (кислой или щелочной) следует готовить раствор, чтобы избежать его помутнения? Почему?
Варианты задач для самостоятельного решения
Вариант №1
1. Написать уравнения гидролиза (в молекулярном и ионном виде) и определить реакцию среды водных растворов перечисленных солей: Na 2 SO 4 , FeCl 2 , Na 2 S.
3. Вычислить значение pH раствора СН 3 СООК с C(СН 3 СООК) = 0,005 моль/л, если (СН 3 СООН) = 1,8×10 - 5 .
Вариант №2
1. Написать уравнения гидролиза (в молекулярном и ионном виде) и определить реакцию среды водных растворов перечисленных солей: MnSO 4 , KI, Na 2 SiO 3 .
3. Вычислить значение рН раствора NaNO 2 с C(NaNO 2) = 0,01 моль/л, если (HNO 2) = 4×10 - 4 .
4. Сравнить величины констант гидролиза Pb(NO 3) 2 по первой и по второй ступени, если для Pb(OH) 2 = 9,6×10 - 4 ; = 3×10 - 8 .
Вариант №3
1. Написать уравнения гидролиза (в молекулярном и ионном виде) и определить реакцию среды водных растворов перечисленных солей: Ca(NO 3) 2 , Na 2 SO 3 , Cu(NO 3) 2 .
2. Вычислить константу и степень гидролиза КClO в растворе с C(КClO) = 0,1 моль/л, если (НClO) = 5,6×10 - 8 .
3. Вычислить значение рН раствора соли KCN с C(KCN) = 0,05 моль/л, если (HCN) = 8×10 - 10 .
Вариант №4
1. Написать уравнения гидролиза (в молекулярном и ионном виде) и определить реакцию среды водных растворов перечисленных солей: K 3 PO 4 , CaCl 2 , ZnCl 2 .
2. Сравнить степень гидролиза NaCN в растворах с молярной концентрацией эквивалента соли 0,1 и 0,001 моль/л если (HCN) = 8×10 - 10 .
3. Вычислить значение рН раствора NH 4 NO 3 с C(NH 4 NO 3) = 0,1 моль/л, если (NH 3 ×Н 2 О) = 1,8×10 - 5 .
Вариант №5
1. Написать уравнения гидролиза (в молекулярном и ионном виде) и определить реакцию среды водных растворов перечисленных солей: CuSO 4 , Li 2 S, NaBr.
3. Вычислить значение рН раствора NH 4 I с концентрацией соли 0,02 моль/л, если (NH 3 ×Н 2 О) = 1,8×10 - 5 .
4. Сравнить величины констант гидролиза Na 2 SiO 3 по первой и по второй ступени, если для H 2 SiO 3 = 1,3×10 - 10 ; = 2×10 - 12 .
Вариант №6
1. Написать уравнения гидролиза (в молекулярном и ионном виде) и определить реакцию среды водных растворов перечисленных солей: SrCl 2 , Fe(NO 3) 3 , K 2 S.
2. Сравнить величины степени гидролиза NaF в растворах с молярной концентрацией эквивалента соли 0,2 и 0,002 моль/л. (HF) = 6,6×10 - 4 .
3. Вычислить значение pH раствора НСООNa с молярной концентрацией соли 0,05 моль/л, если (НСООН) = 2,2×10 - 4 .
Вариант №7
1. Написать уравнения гидролиза (в молекулярном и ионном виде) и определить реакцию среды водных растворов перечисленных солей: NaNO 3 , ZnSO 4 , Ca(OCl) 2 .
3. Вычислить значение рН раствора C 6 H 5 COONa с концентрацией соли 0,01 моль/л, если (C 6 H 5 COOH) = 6,3×10 - 5 .
Вариант №8
1. Написать уравнения гидролиза (в молекулярном и ионном виде) и определить реакцию среды водных растворов перечисленных солей: Pb(NO 3) 2 , CaS, KC1.
2. Сравнить величины констант и степеней гидролиза солей NaF и NaCN в растворах с одинаковыми концентрациями, если (HF) = 6,6×10 - 4 ; (HCN) = 8×10 - 10 .
3. Вычислить значение рН раствора CH 3 COONH 4 с молярной концентрацией соли 0,05 моль/л, если (CH 3 COOH) = 1,8×10 - 5 ; (NH 3 ×H 2 O) = 1,8×10 - 5 .
Вариант №9
1. Написать уравнения гидролиза (в молекулярном и ионном виде) и определить реакцию среды водных растворов перечисленных солей: Ba(NO 3) 2 , NiCl 2 , K 2 SO 3 .
3. Вычислить значение рН раствора соли KF с концентрацией 0,001 моль/л, если (HF) = 6,6×10 - 4 .
Вариант №10
1. Написать уравнения гидролиза (в молекулярном и ионном виде) и определить реакцию среды водных растворов перечисленных солей: CoSO 4 , Na 2 C 2 O 4 , Sr(NO 3) 2 .
2. Сравнить величины констант и степеней гидролиза NH 4 F в растворах с концентрациями 0,02 моль/л и 0,002 моль/л, если (HF) = 6,6×10 - 4 , (NH 3 ×H 2 O) = 1,8×10 - 5 .
3. Вычислить значение рН раствора NH 4 CN с концентрацией 0,01 моль/л, если (HCN) = 8×10 - 10 , (NH 3 ×Н 2 О) = 1,8×10 - 5 .
4. Сравнить величины констант гидролиза Na 2 S по первой и по второй ступени, если (H 2 S) = 1×10 - 7 ; (H 2 S) = 1×10 - 13 .
Вариант №11
1. Написать уравнения гидролиза (в молекулярном и ионном виде) и определить реакцию среды водных растворов перечисленных солей: BaS, K 2 SO 4 , CrCl 3 .
2. Вычислить константу и степень гидролиза HCOONa в растворе с молярной концентрацией соли 0,001 моль/л, если (HCOOH) = 2,2×10 - 4 .
3. Вычислить значение рН раствора NH 4 F с концентрацией 0,02 моль/л, если (NH 3 ×Н 2 О) = 1,8×10 - 5 , (HF) = 6,6×10 - 4 .
Вариант №12
1. Написать уравнения гидролиза (в молекулярном и ионном виде) и определить реакцию среды водных растворов перечисленных солей: Ni(NO 3) 2 , K 2 CO 3 , ВаС1 2 .
2. Сравнить величины констант и степеней гидролиза NH 4 NO 3 в растворах с концентрациями соли 0,02 и 0,002 моль/л, если (NH 3 ×H 2 O) = 1,8×10 - 5 .
3. Вычислить значение рН раствора KClO с концентрацией соли 0,04 моль/л, если (HClO) = 5,6×10 - 8 .
Вариант №13
1. Написать уравнения гидролиза (в молекулярном и ионном виде) и определить реакцию среды водных растворов перечисленных солей: NaI, K 2 SiO 3 , Fe 2 (SO 4) 3 .
2. Вычислить константу и степень гидролиза C 2 H 5 COONa в растворе с С(C 2 H 5 COONa) = 0,l моль/л, если (C 2 H 5 COOH) = 1,3×10 - 5 .
3. Вычислить значение рН раствора NaHCO 3 с концентрацией 0,1 моль/л, если (Н 2 СО 3) = 4×10 - 7 , (H 2 CO 3) = 5×10 - 11 .
Вариант №14
1. Написать уравнения гидролиза (в молекулярном и ионном виде) и определить реакцию среды водных растворов перечисленных солей: Na 2 HPO 4 , KNO 3 , Bi(NO 3) 3 .
2. Вычислить степень гидролиза NH 4 F в растворе с С(NH 4 F) = 0,02 моль/л, если (HF) = 6,6×10 - 4 , (NH 3 ×H 2 O) = 1,8×10 - 5 .
1)NaCl pH = 7
2)NH 4 Cl pH <7
3)CH 3 COONa pH > 7
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 |
| 4 | 4 | 5 | 1 | 2 | 3 | 1 | 3 | 4 | 4 | 2 | 2 | 1 | 2 |
| 15 | 16 | 17 | 18 | 19 | 20 | 21 | 22 | 23 | 24 | 25 | 26 | 27 | 28 |
| 4 | 2 | 4 | 4 | 1 | 2 | 3 | 2 | 4 | 4 | 1 | 2 | 4 | 3 |
| 29 | 30 | 31 | 32 | 33 | 34 | 35 | 36 | 37 | 38 | 39 | 40 | 41 | 42 |
| 2 | 1 | 2 | 2 | 3 | 4 | 1 | 1 | 1 | 1 | 1 | - | 4 | 4 |
| 43 | 44 | 45 | 46 | 47 | 48 | 49 | 50 | 51 | 52 | 53 | 54 | 55 | 56 |
| 1 | 4 | 1 | 3 | 4 | 3 | 4 | 4 | 3 | 4 | 3 | 4 | 2 | 2 |
| 57 | 58 | 59 | 60 | ||||||||||
| 1 | 2 | 2 | - |
БУФЕРНЫЕ РАСТВОРЫ, БУФЕРНЫЕ СИСТЕМЫ ОРГАНИЗМА
1.Значение pH буферных растворов при добавлении небольших количеств кислот и оснований:
1) сохраняются постоянными, т.к. добавляемые катионы водорода и анионы гидроксида связываются соответственно акцепторами и донорами протонов буферной системы;
2)Сохраняются примерно постоянными до тех пор, пока концентрации компонентов буферных систем будут превышать концентрации добавляемых ионов;
3)Изменяются, т.к. изменяются концентрации кислот и оснований в системе;
2. Значения pH буферных растворов при разбавлении…
1)сохранятся постоянными, т. к. соотношение концентраций компонентов буферных систем не изменяется;
2)сохраняются примерно постоянными до определенных значений концентраций;
Изменяются, т.к. концентрация компонентов системы уменьшается.
3. Какие из перечисленных сопряженных кислотно-основных пар обладаются буферными свойствами: а) HCOO - /HCOOH; б)CH 3 COO - /CH 3 COOH; в)Cl - /HCl; г)HCO - 3 /CO 2 ; д)H 2 PO - 4 ;
1)все;
2)а,б,г,д;
3)б,г,д;
4.Из перечисленных сопряенных кислотно-основых пар выберите системы, обладающие буферными свойствами:а)H 3 PO 4 /H 2 PO - 4 ; б) H 2 PO 4 /H 2 PO 2- 4 ; в)HPO 2- 4 /PO 3- 4 ; г) HNO 3 /NO - 3 ; д)HCOOH/HCOO - .
1)все;
2)б,д;
3)а,б,в,д;
Б,в,д.
5.Какие из кислотно-основных пар обладают буферными свойствами; а)Hb-/HHb; б)HbO 2 /HhbO 2 ;; в)HSO - 4 /H 2 SO 4 ; г)NH + 4 /NH 4 OH; д)NO - 3 /HNO 3 ?
1)все;
2)а,б,в,г;
3)а,б,в;
6.Какие из кислотно-основых пар обладают буферными свойствами: а)Cl - /HCl; б)NO - 3 /HNO 3 ; в)HSO - 4 /H 2 SO 4 ; г)CH 3 COO - /CH 3 COOH; д)NH + 4 /NH 4 OH?
1)все;
2)а,б,в;
3)г,д;
В,г,д.
7. Какие из сопряженных кислотно-основных пар облажают буферными свойствами: а) HCOO - /HCOOH;б) HPO 2- 4 /H 2 PO 4 ;в)H 3 PO - 4 ;г) HCO - 4 /CO 2 ?
1)все;
2)а,б;
3)б,в,г;
8.Какие из буферных систем содержат в своем составе только соли: а)CO 2- 3 /HCO - 3 ; б)HCO - 3 /CO 2 ; в)HPO 2- 4 /H 2 PO - 4 ; г)H 2 PO - 4 /H 3 PO 4 ; д)HCOO - /HCOOH; е)PO 3- 4 /HPO 2- 4 .
1)а,в,г;
2)а,в,е;
3)а,б,в,г,е;
А,б,в.е.
9.К Буферным растворам относятся смеси: а)NaH 2 PO 2 +Na 2 HPO 4 ; б)H 3 PO 4 +NaH 2 PO 4 ; в)Ns 2 CO 3 +NaHCO 3 ; г)Na 2 HPO 4 +Na 3 PO 4 .
1)Все;
2)а,б;
3)в,г;
А,б,в.
10.При добавлении HCl в буферной системе HPO 2- 4 /H 2 PO - 4:
11.При добавлении NaOH к буферноц системе HPO 2- 4 / H 2 PO - 4:
1)активная концентрация(HPO 2- 4) увеличивается, (H 2 PO - 4) – уменьшается.
2) активная концентрация(HPO 2- 4) уменьшается, (H 2 PO - 4)) увеличивается.
Активность компонентов не изменяются.
12. .При добавлении NaOH к буферноц системе NH + 4 /NH 3 H 2 O:
Активность компонентов не изменяются.
13. При добавлении HCl в буферной системе NH + 4 /NH 3 H 2 O:
1)активная концентрация(NH + 4) увеличивается, (NH 3 H 2 O) – уменьшается.
2) активная концентрация(NH + 4) уменьшается, (NH 3 H 2 O)) увеличивается.
Активность компонентов не изменяются.
14. При добавлении NaOH к буферноц системе CH 3 COO - /CH 3 COOH:
Активность компонентов не изменяются.
15. При добавлении HCl в буферной системе CH 3 COO - /CH 3 COOH:
1)активная концентрация(CH 3 COOH) увеличивается, (CH 3 COO -) – уменьшается.
2) активная концентрация(CH 3 COOH) уменьшается, (CH 3 COO -)) увеличивается.
Активность компонентов не изменяются.
16. Максимальную буферную емкость системы имеют при:
1) pH=p K а;
2) pH>p K а;
3) pH<p K а;
Эти параметры не взаимосвязаны друг с другом.
17.Максимальной буферной емкостью при физиологическом значении pH обладает кислотно-основная сопряженная пара:
1) H 3 PO 4 /H 2 PO - 4 (pK a (H 3 PO 4) = 2.1;
2) H 3 PO - 4 /H 2 PO 2- 4 (pK a (H 2 PO - 4) = 6.8;
3) HPO 2- 4 /PO 3- 4 (pK a (HPO - 4) = 12.3;
18. При одинаковых концентрациях компонентов буферная емкость:
1)максимальная, т. к. pH=p K а;
2)максимальная, т. к. pH>p K а;
3)минимальная, т. к. pH=p K а;
19.Буферная емкость при разбавлении растворов:
1) уменьшается, вследствие уменьшения концентрации всех компонентов системы;
2)увеличивается, т. к. возрастает степень диссоциации электролитов;
3)не изменяется, т.к. соотношение концентраций компонентов остается постоянным;
Практически не изменяется, т.к. количество компонентов системы остается неизменным.
20.Буферные системы поддерживают в организме равновесия:
1)кислотно-основные;
2)окислительно-восстаовительные;
3)гетерогенные;
Лигандообеменные.
21.Ацидоз – это:
В общем случае, гидролиз солей
– это процесс обменного разложения воды и растворенной в ней соли – электролита, приводящий к образованию малодиссоциирующего вещества.
Гидролиз является частным случаем сольволиза – обменного разложения растворенного вещества и растворителя.
Характеризовать гидролиз количественно позволяют такие величины, как Степень гидролиза и константа гидролиза .
Степень гидролиза
— это соотношение количества подвергающейся гидролизу соли n гидр и общего количества растворенной соли n общ. Обычно, ее обозначают через h гидр (или α ):
h гидр = (n г идр /n общ)·100 %
Величина h гидр увеличивается с уменьшением силы образующих соль кислоты или основания.
Константа гидролиза
Представим в общем виде процесс гидролиза соли, в котором в роли соли выступает – МА, а НА и МОН - соответственно, кислота и основание, которые образуют данную соль:
K г = ·/
Концентрация образовавшейся кислоты равна концентрации гидроксид ионов, тогда
K г = 2 /
Используя это выражение можно вычислить pH раствора
= (K г ·) 1/2 моль/л
10 -14 / моль/л
Гидролиз солей можно представить, как поляризационное взаимодействие ионов и их гидратной оболочки. Гидролиз протекает тем полнее, сильнее поляризующее действие ионов. Возможны 4 случая протекания гидролиза:
Соли, образованные сильным основанием и сильной кислотой
Соли, образованные сильным основанием и сильной кислотой не подвергаются гидролизу. В этом случае, гидролиз практически не происходит, т.к. катионы и анионы, образующиеся в растворе при , слабо поляризуют гидратную оболочку. pH среды не изменяется (рН ≈ 7 ):
NaCl ↔ Na + + Cl —
Na + + HOH ↔ реакция практически не протекает
Cl — + HOH ↔ реакция практически не протекает
Соли, образованные слабым основанием и сильной кислотой
Такое соединение, при ионизации, образует катионы, способные к поляризации гидратной оболочки и анионы, которые их поляризуют слабо. Тогда гидроли з проходит по катиону, при этом среда носит кислый характер, т.е. рН ˂ 7 :
NH 4 Cl ↔ NH 4 + + Cl —
NH 4 + + HOH ↔ NH 4 OH + H +
Cl — + HOH ↔ реакция практически не идет
NH 4 Cl+ HOH ↔ NH 4 OH + HCl
Для солей, образованных слабым основанием и сильной кислотой, константа гидролиза и константа диссоциации основания связаны соотношением:
K г = K H 2 O /K осн
Понятно, что чем меньше сила основания, тем в большей степени протекает гидролиз.
Если соль образованна слабым основанием многовалентного металла и сильной кислотой , то ее гидролиз будет протекать ступенчато:
FeCl 2 ↔ Fe 2+ + 2Cl —
| I ступень | Fe 2+ + HOH ↔ (FeOH) + + H + FeCl 2 + HOH ↔ (FeOH)Cl + HCl |
| II ступень | (FeOH) + + HOH ↔ Fe(OH) 2 + H + (FeOH)Cl + HOH↔ Fe(OH) 2 + HCl |
Константа гидролиза по первой ступени связана с константой диссоциации основания по второй ступени, а константа гидролиза по второй ступени - с константой диссоциации основания по первой ступени:
K г1 = K H 2 O /K осн2
K г2 = K H 2 O /K осн1
Поскольку первая константа диссоциации кислоты всегда больше второй, то первая константа гидролиза всегда больше, чем константа вторая гидролиза, так как первая константа диссоциации основания всегда больше второй
K г1 > K г2
Отсюда следует, что по первой ступени, гидролиз всегда будет протекать в большей степени, чем по второй. Этому также способствуют ионы, которые образуются при гидролизе по первой ступени, они приводят подавлению гидролиза по второй ступени, смещая равновесие влево.
Сравнивая величины K г и K осн можно качественно определить pH среды . Так, если K г намного больше K осн, то среда сильнокислая , при K г намного меньшей K осн — среда слабокислая среднекислая.
Соль, образованная сильным основанием и слабой кислотой
Такое соединение в растворе образует слабополяризующие катионы и среднеполяризующие анионы. Гидролиз протекает по аниону , и в его результате создается щелочная среда, pH > 7 :
NaCN ↔ Na + + CN —
CN — + HOH ↔ HCN + OH —
Na + + HOH ↔ реакция практически не идет
NaCN + HOH ↔ HCN + NaOH
Константа гидролиза и константа диссоциации кислоты связаны зависимостью:
K г = K H 2 O /K к-ты
Т.е. гидролиз соли протекает тем полнее, чем слабее образующая эту соль, кислота.
Возможен гидролиз соли , образованной слабой многоосновной кислотой и сильным основанием. В этом случае гидролиз протекает по ступеням:
Na 2 SO 3 ↔ 2Na + + SO 3 2-
| I ступень | SO 3 2- + HOH ↔ HSO 3 — + OH — Na 2 SO 3 + HOH ↔ NaHSO 3 + NaOH |
| II ступень | HSO 3 — + HOH ↔ H 2 SO 3 + OH — NaHSO 3 + HOH ↔ H 2 SO 3 + NaOH |
В этом случае, константа гидролиза по первой и второй ступеням определяется соотношениями:
K г1 = K H 2 O /K к-ты2
K г2 = K H 2 O /K к-ты1
Следует помнить, что гидролиз по второй ступени протекает в ничтожно малой степени.
Сравнивая величины K г и K к-ты, можно качественно определить pH среды . Так, если K г намного больше K к-ты, то среда сильнощелочная , при K г намного меньшей K к-ты — среда слабощелочная , а если K г и K осн сопоставимы, то — среднещелочная.
Соли, образованные слабым основанием и слабой кислотой
Такие соли, при ионизации образуют среднеполяризующие катионы и анионы, поэтому гидролиз возможен как по катиону, так и по аниону . При этом относительная сила образовавшихся кислоты и основания, будут влиять на характер среды (слабокислая или слабощелочная, pH ≈ 7). Такого типа гидролиз протекает особо полно, обычно с образованием малорастворимого вещества:
Al 2 S 3 + 6HOH ↔ 2Al(OH) 3 ↓+ 3H 2 S
K г = K H 2 O /(K к-ты ·K осн)
Влияние различных факторов на протекание гидролиза
- Природа соли . Это видно из выражения для константы гидролиза.
- Концентрация соли и продуктов реакции . В соответствии с , равновесие должно смещаться вправо, при этом увеличивается концентрация ионов водорода (или гидроксид-ионов), что приводит к уменьшению степени гидролиза.
- Температура . Известно, что гидролиз притекает с поглощением теплоты (), поэтому согласно принципу Ле Шателье, при увеличении температуры сдвигается вправо, что ведет к росту степени гидролиза .
Несмотря на то, что вода считается неэлектролитом, она частично диссоциирует с образованием катиона гидроксония и гидроксид-аниона:
H 2 O + H 2 O H 3 O + + OH -
Часто используют упрощенную форму записи данного процесса:
H 2 O H + + OH -
Это равновесие характеризуется соответствующей константой:
Поскольку в чистой воде и разбавленных водных растворах = const, данное выражение можно преобразовать к следующему виду:
K W =
Полученная константа называется ионным произведением воды. При 25 °С K W = 10 -14 . Отсюда следует, что в чистой воде и нейтральных растворах = = Ö10 -14 = 10 -7 . Очевидно, что в кислых растворах > 10 -7 , а в щелочных < 10 -7 . На практике часто пользуются показателем концентрации катионов водорода - отрицательным десятичным логарифмом (pH = -lg). В кислых растворах рН < 7, в щелочных pH > 7, в нейтральной среде pH = 7. Аналогично можно ввести гидроксильный показатель pOH = -lg. Водородный и гидроксильный показатели связаны простым соотношением: pH + pOH = 14.
Рассмотрим примеры расчета рН водных растворов сильных и слабых кислот.
Пример № 1. Сантимолярный раствор (0,01 моль/л) соляной кислоты (сильная одноосновная кислота).
HCl = H + + Cl -
C HCl = 0,01; pH = -lg 0,01 = 2
Пример № 2. Сантимолярный раствор (0,01 моль/л) гидроксида натрия (сильное однокислотное основание).
NaOH = Na + + OH -
C NaOH = 0,01; pOH = -lg 0,01 = 2;
pH = 14 - pOH = 12
Пример № 3. Сантимолярный раствор (0,01 моль/л) уксусной кислоты (слабая одноосновная кислота).
CH 3 COO - + H + CH 3 COOH
Из уравнения реакции следует, что = . Для слабого электролита » C. Подставим эти формулы в константу кислотной диссоциации уксусной кислоты и преобразуем полученное выражение:
![]() =
1,75×10 -5 ; ; »
=
1,75×10 -5 ; ; »
рН = - lg = -1/2(lgK a + lgC) = 1/2(pK a - lgC) = 1/2(4,75 + 2) = 3,38
Пример № 4. Сантимолярный раствор (0,01 моль/л) аммиака (гидроксид аммония, слабое однокислотное основание).
NH 3 + H 2 O NH 4 + + OH -
Из уравнения реакции следует, что = . Так как гидроксид аммония слабый электролит, то » C. Подставив эти формулы в константу ионизации аммиака как основания, получим:
![]() =
1,8×10 -5 ; ; =
=
1,8×10 -5 ; ; =
рOН = -lg = 1/2(pK b - lgC);
pH = 14 - pOH = 14 + 1/2(lgC - pK b) = 14 + 1/2(-2 - 4,76) = 10,62
Гидролиз солей . Отличие кислотности водных растворов солей от кислотности чистой воды определяется их гидролизом. Гидролиз - это обменное взаимодействие растворенного вещества с водой . По склонности к гидролизу соли делятся на четыре типа:
1. Соли, образованные сильной кислотой и сильным основанием (например, NaCl, Na 2 SO 4), гидролизу не подвергаются. Водные растворы таких солей имеют нейтральную реакцию (рН = 7).
2. Соли, образованные слабым основанием и слабой кислотой, гидролизуются в значительной степени и часто необратимо, например,
Al 2 S 3 + 6H 2 O = 2Al(OH) 3 ¯ + 3H 2 S
Кислотность их растворов определяется более растворимым веществом, и обычно близка к нейтральной (рН » 7).
3. Соли, образованные слабым основанием и сильной кислотой, гидролизуются обратимо, связывая гидроксид-анионы, и обуславливая кислую реакцию растворов (рН < 7). Например, гидролиз хлорида аммония можно описать следующими уравнениями:
NH 4 Cl + H 2 O NH 3 ×H 2 O + HCl
Из приведенных уравнений видно, что гидролизу подвергается не вся соль, а только ее катион. Катионы солей, образованных многокислотными слабыми основаниями, гидролизуются ступенчато, последовательно отщепляя от воды гидроксид-анионы:
Al 3+ + H 2 O Al(OH) 2+ + H +
Al(OH) 2+ + H 2 O Al(OH) 2 + + H +
Al(OH) 2 + + H 2 O Al(OH) 3 + H +
Суммарное уравнение гидролиза катиона алюминия имеет следующий вид:
Al 3+ + 3H 2 O Al(OH) 3 + 3H +
4. Соли, образованные сильным основанием и слабой кислотой, гидролизуются по аниону, который отрывает от воды катион водорода. Освобождающиеся гидроксид-анионы придают раствору щелочную реакцию (pH > 7). Например, гидролиз ацетата натрия протекает следующим образом:
CH 3 COONa + H 2 O CH 3 COOH + NaOH
Очевидно, что гидролиз анионов солей слабых многоосновных кислот протекает ступенчато, например,
PO 4 3- + H 2 O HPO 4 2- + OH -
HPO 4 2- + H 2 O H 2 PO 4 - + OH -
H 2 PO 4 - + H 2 O H 3 PO 4 + OH -
Суммарное уравнение гидролиза фосфат-аниона имеет следующий вид
PO 4 3- + 3H 2 O H 3 PO 4 + 3OH -
Гидролизу подвергаются не только соли, но и ковалентные неорганические и органические соединения. Например:
PCl 3 + 3H 2 O = H 3 PO 3 + 3HCl

Важную роль в жизнедеятельности живых организмов играет гидролиз некоторых биомолекул - белков и полипептидов, жиров, а также полисахаридов.
Глубина протекания гидролиза характеризуется степенью гидролиза (h) - отношением количества вещества, подвергшегося гидролизу, к общему количеству вещества в растворе . Обратимый гидролиз может быть охарактеризован также константой. Например, для процесса гидролиза ацетат-аниона константа гидролиза записывается следующим образом:
![]()
Равновесная концентрация воды в выражение константы гидролиза не входит, поскольку она постоянна и автоматически переносится в левую часть равенства.
Расчет константы и степени гидролиза, а также рНводных растворов солей рассмотрим на конкретных примерах.
Пример № 5. Сантимолярный раствор (0,01 моль/л) хлорида аммония (соль, образованная слабым основанием и сильной кислотой). Запишем уравнение гидролиза в ионной форме и составим выражение для константы гидролиза.
NH 4 + + H 2 O NH 3 ×H 2 O + H +
![]()
Умножив числитель и знаменатель правой части равенства на концентрацию гидроксид-ионов, константу гидролиза можно преобразовать следующим образом:
![]() = 5,56×10 -10
= 5,56×10 -10
Из уравнения гидролиза следует, что = = Ch, а = C - Ch = C(1-h). Соответственно,
![]()
Так как h << 1, а (1-h) ® 1, полученное выражение можно упростить:
; отсюда h »
![]() » 2,36×10 -4 или 0,0236%
» 2,36×10 -4 или 0,0236%
Из полученных уравнений видно, что константа и степень гидролиза соли увеличиваются с уменьшением константы диссоциации основания, т.е. с уменьшением его силы. Кроме этого, степень гидролиза и глубина его протекания увеличивается с уменьшением концентрации (увеличением разбавления) соли. Константа гидролиза, как и константа любого равновесия, от концентрации не зависит. Увеличение температуры приводит к увеличению степени и константы гидролиза, поскольку гидролиз - процесс эндотермический.
При расчете величины рН раствора соли учтем, что = , а в первом приближении » C.
; отсюда »
pH = - lg = -1/2(lgK w + lgC + pK b) = 7 - 1/2(pK b + lgC) = 7 - 1/2(4,76 - 2) = 5,62
Пример № 6. Сантимолярный раствор (0,01 моль/л) ацетата натрия (соль, образованная сильным основанием и слабой кислотой). Запишем уравнение гидролиза в ионной форме и составим выражение для константы гидролиза.
CH 3 COO - + H 2 O CH 3 COOH + OH -
![]()
Умножив числитель и знаменатель правой части равенства на концентрацию катиона водорода, его можно преобразовать к следующему виду:
![]() = 1×10 -14 /1,75×10 -5 = 5,71×10 -10
= 1×10 -14 /1,75×10 -5 = 5,71×10 -10
Из уравнения гидролиза следует, что = = Ch, а = C - Ch = C(1-h).
Соответственно,
![]() ; ; отсюда h =
; ; отсюда h =