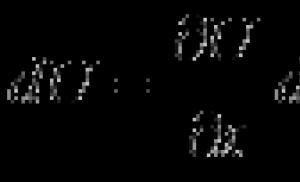Конспект на тему алканы. Урок «Природный газ. Алканы. Нахождение в природе и получение
Строение алканов
Алканы - углеводороды, в молекулах которых атомы связаны одинарными связями и которые соответствуют общей формуле C n H 2n+2 . В молекулах алканов все атомы углерода находятся в состоянии sр 3 -гибридизации .
Это означает, что все четыре гибридные орбитали атома углерода одинаковы по форме, энергии и направлены в углы равносторонней треугольной пирамиды - тетраэдра . Углы между орбиталями равны 109° 28′. Вокруг одинарной углерод-углеродной связи возможно практически свободное вращение, и молекулы алканов могут приобретать самую разнообразную форму с углами при атомах углерода, близкими к тетраэдрическому (109° 28′), например, в молекуле н-пентан.

Особо стоит напомнить о связях в молекулах алканов. Все связи в молекулах предельных углеводородов одинарные. Перекрывание происходит по оси, соединяющей ядра атомов, т. е. это σ-связи . Связи углерод - углерод являются неполярными и плохо поляризуемыми. Длина С-С связи в алканах равна 0,154 нм (1,54 10 10 м). Связи С-Н несколько короче. Электронная плотность немного смещена в сторону более электроотрицательного атома углерода, т. е. связь С-Н является слабополярной .
Гомологический ряд метана
Гомологи - вещества, сходные по строению и свойствам и отличающиеся на одну или более групп СН 2 .


Предельные углеводороды составляют гомологический ряд метана.
Изомерия и номенклатура алканов
Для алканов характерна так называемая структурная изомерия . Структурные изомеры отличаются друг от друга строением углеродного скелета. Простейший алкан, для которого характерны структурные изомеры, - это бутан.

Рассмотрим подробнее для алканов основы номенклатуры ИЮПАК .
1. Выбор главной цепи . Формирование названия углеводорода начинается с определения главной цепи - самой длинной цепочки атомов углерода в молекуле, которая является как бы ее основой.
2. Нумерация атомов главной цепи . Атомам главной цепи присваивают номера. Нумерация атомов главной цепи начинается с того конца, к которому ближе стоит заместитель (структуры А, Б). Если заместители находятся на равном удалении от конца цепи, то нумерация начинается от того конца, при котором их больше (структура В). Если различные заместители находятся на равном удалении от концов цепи, то нумерация начинается с того конца, к которому ближе старший (структура Г). Старшинство углеводородных заместителей определяется по тому, в каком порядке следует в алфавите буква, с которой начинается их название: метил (-СН 3), затем пропил (-СН 2 -СН 2 -СН 3), этил (-СН 2 -СН 3) и т. д.
Обратите внимание на то, что название заместителя формируется заменой суффикса -ан на суффикс -ил в названии соответствующего алкана.
3. Формирование названия . В начале названия указывают цифры - номера атомов углерода, при которых находятся заместители. Если при данном атоме находятся несколько заместителей, то соответствующий номер в названии повторяется дважды через запятую (2,2-). После номера через дефис указывают количество заместителей (ди - два, три - три, тетра - четыре, пента - пять) и название заместителя (метил, этил, пропил). Затем без пробелов и дефисов - название главной цепи. Главная цепь называется как углеводород - член гомологического ряда метана (метан, этан, пропан и т. д.).




Названия веществ, структурные формулы которых приведены выше, следующие:
Структура А: 2-метилпропан;
Структура Б: 3-этилгексан;
Структура В: 2,2,4-триметилпентан;
Структура Г: 2-метил 4-этилгексан.
Отсутствие в молекулах предельных углеводородов полярных связей приводит к тому, что они плохо растворяются в воде , не вступают во взаимодействие с заряженными частицами (ионами) . Наиболее характерными для алканов являются реакции, протекающие с участием свободных радикалов .
Физические свойства алканов
Первые четыре представителя гомологического ряда метана - газы . Простейший из них - метан - газ без цвета, вкуса и запаха (запах «газа», почувствовав который, надо звонить 04, определяется запахом меркаптанов - серосодержащих соединений, специально добавляемых к метану, используемому в бытовых и промышленных газовых приборах для того, чтобы люди, находящиеся рядом с ними, могли по запаху определить утечку).
Углеводороды состава от С 5 Н 12 до С 15 Н 32 - жидкости; более тяжелые углеводороды - твердые вещества. Температуры кипения и плавления алканов постепенно увеличиваются с возрастанием длины углеродной цепи. Все углеводороды плохо растворяются в воде, жидкие углеводороды являются распространенными органическими растворителями.


Химические свойства алканов
Реакции замещения.
Наиболее характерными для алканов являются реакции свободнорадикального замещения , в ходе которого атом водорода замещается на атом галогена или какую-либо группу.
Приведем уравнения характерных реакций галогенирования :
В случае избытка галогена хлорирование может пойти дальше, вплоть до полного замещения всех атомов водорода на хлор :

Полученные вещества широко используются как растворители и исходные вещества в органических синтезах.
Реакция дегидрирования (отщепления водорода).
В ходе пропускания алканов над катализатором (Pt, Ni, Al 2 O 3 , Cr 2 O 3) при высокой температуре (400-600 °C) происходит отщепление молекулы водорода и образование алкена :
Реакции, сопровождающиеся разрушением углеродной цепи. Все предельные углеводороды горят с образованием углекислого газа и воды. Газообразные углеводороды, смешанные с воздухом в определенных соотношениях, могут взрываться.
1. Горение предельных углеводородов - это свободнорадикальная экзотермическая реакция, которая имеет очень большое значение при использовании алканов в качестве топлива:
В общем виде реакцию горения алканов можно записать следующим образом:
2. Термическое расщепление углеводородов .
Процесс протекает по свободнорадикальному механизму . Повышение температуры приводит к гомолитическому разрыву углерод-углеродной связи и образованию свободных радикалов.
Эти радикалы взаимодействуют между собой, обмениваясь атомом водорода, с образованием молекулы алкана и молекулы алкена :
Реакции термического расщепления лежат в основе промышленного процесса - крекинга углеводородов . Этот процесс является важнейшей стадией переработки нефти.
3. Пиролиз . При нагревании метана до температуры 1000 °С начинается пиролиз метана - разложение на простые вещества:
При нагревании до температуры 1500 °С возможно образование ацетилена :
4. Изомеризация . При нагревании линейных углеводородов с катализатором изомеризации (хлоридом алюминия) происходит образование веществ с разветвленным углеродным скелетом :

5. Ароматизация . Алканы с шестью или более углеродными атомами в цепи в присутствии катализатора циклизуются с образованием бензола и его производных:

Алканы вступают в реакции, протекающие по свободнорадикальному механизму, т. к. все атомы углерода в молекулах алканов находятся в состоянии sp 3 -гибридизации. Молекулы этих веществ построены при помощи ковалентных неполярных С-С (углерод - углерод) связей и слабополярных С-Н (углерод - водород) связей. В них нет участков с повышенной и с пониженной электронной плотностью, легко поляризуемых связей, т. е. таких связей, электронная плотность в которых может смещаться под действием внешних факторов (электростатических полей ионов). Следовательно, алканы не будут реагировать с заряженными частицами, т. к. связи в молекулах алканов не разрываются по гетеролитическому механизму.
План учебного занятия № 19
Дата Предмет Химия группа
Ф.И.О. преподавателя: Кайырбекова И.А.
Тема : Алканы. Гомологический ряд, изомеры, номенклатура, свойства и получение алканов Цели : Изучить алканы, как один из классов ациклических соединений.
Задачи:
Образовательные:
Продолжить формирование понятия об основных классах углеводородов; начать формировать понятие о карбоциклических соединениях; изучить строение, номенклатуру и изомерию алканов; рассмотреть основные способы получения и применения алканов; изучить химические свойства алканов и генетическую связь с другими классами углеводородов.
Развивающие:
Развивать когнитивную сферу учащихся; общеучебные умения и навыки учащихся; развивать умения анализировать и делать самостоятельные выводы;
Воспитательные:
Прививать культуру умственного труда и сотрудничества; воспитывать дисциплинированность; коллективизм и чувство ответственности; способствовать созданию благоприятного психо-эмоционального климата на уроке;
Тип урока: урок усвоения новых знаний.
ІІ. Ожидаемые результаты:
А) Учащиеся должны знать : строение, свойства алканов
Ә) Учащиеся должны уметь: сравнивать, доказывать
б) учащиеся должны владеть: работы с химическими реактивами соблюдая ТБ
ІІІ. Метод и приемы каждого этапа занятия: словесно- наглядный, объяснительно- илюстративный IV . Средства: интерактивная доска, учебник
Ход урока
1.Организационный момент: Проверить посещаемость учащихся. Ознакомить целями урока.
2. Подготовка к восприятию нового материала: Теоретический диктант:
А) Основные положения теории химического строения А. М. Бутлерова. Привести примеры.
Б) что называется изомерами?
В) Основные механизмы разрыва связей?
3. Объяснения нового материала (усвоение новых знании).
План:
Понятие об углеводородах. Предельные углеводороды.
Строение молекулы метана.
Гомологический ряд метана.
Строение предельных углеводородов.
Номенклатура предельных углеводородов.
Изомерия.
4. Закрепление знаний и умении:
Стр 38 №4-8, 13 упражнение
5. Подведение итогов урока: Фронтальный опрос: по лекции.
6. Домашнее задание: Работа по конспекту . §6 стр 38 11-12 упражнение
1.Углеводороды – органические соединения, состоящие из двух элементов – углерода и водорода. С х Ну. Углеводороды делятся: предельные, непредельные и ароматические. Углеводороды, которые не присоединяют водород и другие элементы, называются предельными углеводородами или алканами. Все валентные связи углерода и водорода полностью насыщены. 2.Молекулярная формула метана СН 4 , его структурная формула: Электронная формула метана В молекуле метана атом углерода находится в возбужденном состоянии внешний слой атомаПри этом происходит гибридизация электронных облаков одного электрона и трех р-электронов, то есть происходит гибридизация и образуется четыре одинаковых гибридных электронных облака, направленных к вершинам углов тетраэдра, молекула метана имеет тетраэдрическую форму.
3. В природном газе, кроме метана содержится много других углеводородов, сходных по строению и свойствам с метаном. Их называют предельными углеводородами или парафинами или алканами. Эти углеводороды образуют гомологический ряд предельных углеводородов: СН 4 - метан С 2 Н 6 - этан С 3 Н 8 - пропан С 4 Н 10 – бутан С 5 Н 12 – пентан С 6 Н 14 – гексан С 7 Н 16 - гептан С 8 Н 18 –октан С 9 Н 20 - нонан С 10 Н 22 – декан. Гомологи – это вещества, сходные по строению и химическим свойствам, но отличающиеся друг от друга на группу атомов СН 2 . Общая формула гомологов ряда метана: С п Н 2п+2 где п – число атомов углерода. Атомы углерода, соединяясь друг с другом в цепи в молекуле углеводородов, образуют загзаг, то есть углеродная цепочка имеет зигзагообразное, а причина этому – тетраэдрическое направление валентных связей атомов углерода.
При разрыве связей молекулы углеводородов могут превращаться в свободнее радикалы. При отрыве одного атома водорода образуются одновалентные радикалы: СН 4 - метан- СН 3 метил С 2 Н 6 - этан- С 2 Н 5 - этил С 3 Н 8 - пропан –С 3 Н 7 - пропил С 4 Н 10 – бутан-С 4 Н 9 бутил. 5. Существуют несколько видов номенклатуры: историческая, рациональная, современная или международная. Основной считается международная систематическая номенклатура или Женевская. Основные ее принципы были приняты на международном съезде химиков в Женеве в 1892 году. Основные правила: А) Выделяют в структурной формуле наиболее длинную цепь атомов углерода и номеруют с того конца, где ближе разветвление. Б) название вещества цифрой указывают, при каком атоме углерода находится замещающая группа. В) Когда разветвление начинается при атомах углерода, равноудаленных от главной цепи, нумерацию ведут с того конца, к которому ближе расположен радикал, имеющий более простое строение. 6. для предельных существует только 1 вид структурной изомерии – изомерия цепи или углеродного скелета. Привести пример бутан.
Утверждаю:
Заместитель директора
Г.Г.Исмагулова
Группа: 5 Дата: 23.01.2017 г
Тема : Алканы. Гомологический ряд, изомеры. Номенклатура алканов. Строение алканов. Нахождение в природе и получение алканов. Свойства алканов.
Цели:
- сформировать умение составлять структурные формулы органических соединений, используя алгоритм построения, устанавливать причинно-следственные связи между составом, строением и применением веществ;
Отработать навыки пользования номенклатурой IUPAC применительно к алканам;
Ознакомить учащихся с изомерией предельных УВ, их физическими свойствами и основными способами получения.
Тип урока: урок усвоения новых знаний.
Оборудование и реактивы : шаростержневые и объёмные модели молекул алканов, образцы парафина, жидкие алканы (пентан, гексан) бензин,
Ход урока
І. Организационный момент.
ІІ. Актуализация знаний и умений. Проверка домашнего задания.
Фронтальный опрос класса по теории строения органического вещества А.М.Бутлерова
Вещества делятся на две большие группы. Какие? (органические и неорганические)
В состав органических соединений входит атом? (углерода)
Органическая химия – это …………..? (химия углеводородов и их производных)
Источники органических веществ? (делятся на две большие группы – природные и синтетические)
Что относятся к природным органическим соединениям и к синтетическим органическим веществам? (природный газ, нефть, уголь, торф, сланец, озокерит, продукты лесного хозяйства, хлопок, продукты сельского хозяйства и т.д.), (получают искуственно, путем органического синтеза)
Основные положения теории химического строения А. М. Бутлерова.
Что называется изомерами?
Родоначальником всех органических соединений являются? (углеводороды)
Какие соединения называются углеводородами и какие их виды вам известны?
Алифатические углеводороды бывают насыщенные и ненасыщенные. Что относятся к насыщенным и ненасыщенным углеводородам?
III . Изучение нового материала.
Алка́ны – насыщенные углеводороды, в молекулах которых атомы углерода соединены между собой только одинарной сигма – связью и которые имеют общую формулу: CnH2n+2.
Алканы называются парафинами, или углеводородами ряда метана. Первым членом алканов является метан, поэтому их называют углеводородами ряда метана.
Алканы являются насыщенными углеводородами и содержат максимально возможное число атомов водорода. Каждый атом углерода в молекулах алканов находится в состоянии sp3-гибридизации - все 4 гибридные орбитали атома С равны по форме и энергии, 4 электронных облака направлены в вершины тетраэдра под углами 109°28". За счёт одинарных связей между атомами С возможно свободное вращение вокруг углеродной связи. Тип углеродной связи - σ-связи, связи малополярны и плохо поляризуемы. Длина углеродной связи - 0,154 нм.
Простейшим представителем класса является метан (CH4).


По номенклатуре ИЮПАК названия алканов образуются при помощи суффикса -ан путём добавления к соответствующему корню от названия углеводорода. Выбирается наиболее длинная неразветвлённая углеводородная цепь так, чтобы у наибольшего числа заместителей был минимальный номер в цепи. В названии соединения цифрой указывают номер углеродного атома, при котором находится замещающая группа или гетероатом, затем название группы или гетероатома и название главной цепи. Если группы повторяются, то перечисляют цифры, указывающие их положение, а число одинаковых групп указывают приставками ди-, три-, тетра-. Если группы неодинаковые, то их названия перечисляются в алфавитном порядке.
Названия алканов.
Слово «алкан» того же происхождения, что и «алкоголь». Устаревший термин «парафин» произошел от латинских parum – мало, незначительно и affinis – родственный; парафины обладают малой реакционной способностью по отношению к большинству химических реагентов. Многие парафины являются гомологами; в гомологическом ряду алканов каждый последующий член отличается от предыдущего на одну метиленовую группу СН 2 . Термин происходит от греческого homologos – соответственный, подобный.
Гомологи – вещества, имеющие одинаковую общую формулу, сходные по химическим свойствам, но отличающиеся друг от друга по составу молекул на одну или несколько групп атомов СН 2 , которые называются гомологической разностью.
Изомерия алканов.
Изомерия – вещества, имеющие одинаковый состав молекул (т.е. одну и ту же молекулярную формулу), но различное химическое строение и обладающие поэтому разными свойствами. Такие соединения называются изомерами.
Характерна структурная изомерия.
В формуле молекулы алкана выбирают главную цепь - самую длинную.
H3C-CH2-CH2-CH-CH2-CH3
2) Затем эту цепь нумеруют с того конца, к которому ближе расположен заместитель (радикал). Если заместителей несколько, то поступают так, чтобы цифры, указывающие их положение, были наименьшими. Заместители перечисляют по алфавиту.
H3C-CH-CH2-CH-CH2-CH3
Углеводород называют в таком порядке: вначале указывают (цифрой) место расположения заместителя, затем называют этот заместитель (радикал), а в конце добавляют название главной (самой длинной) цепи. Таким образом, углеводород может быть назван: 2-метил-4-этилгептан (но не 6-метил-4-этилгептан).
Названия радикалов образуются от названия соответстующих углеводородов путем замены суффикса – ан на – ил.

Получение
Способы выделения их из природного сырья.
| Природные источники алканов | Способы получения |
| 2. Нефтяной газ Природный газ Каменный уголь | Фракционная перегонка. 1) ректификационные газы (С 3 Н 8 , С 4 Н 10) 2) газолиновая фракция (С 5 Н 12 до С 11 Н 24) 3) лигроиновая фракция (С 8 Н 18 до С 14 Н 30) 4) керосиновая фракция (С 12 Н 26 до С 18 Н 38) 5) дизельное топливо (С 13 Н 28 до С 19 Н 36) 6) мазут(С 18 Н 38 - С 25 Н 52 , С 28 Н 58 - С 38 Н 78) Термический; Каталитический Фракционное разделение газовый бензин пропан-бутановая смесь сухой газ Коксование коксовый газ каменноугольная смола надсмольная вода |
«Синтетические способы получения алканов»
| получения | Химизм реакции |
| Изомеризация |
|
| Гидрирование | |
| Синтез Вюрца | |
| Декарбоксилирование | |
| Гидролиз карбидов |

Первые четыре члена алканов – газы, начиная от пентана до пентадекана (С 15 Н 32) – жидкости, высокомолекулярные алканы, в составе которых имеются 16 и больше атомов углерода, - твердые вещества. При нормальной температуре и при повышении давления пропан и бутан могут находиться и в жидком состоянии. Температуры кипения и плавления нормальных алканов выше температур кипения и плавления соответствующих им разветвленных алканов. Алканы – неполярные соединения. Они легче воды, не смешиваются с водой (не растворяются в воде) и не растворяются в других полярных растворителях. Жидкие алканы являются хорошими растворителями и используюся в качестве растворителей многих органических веществ. Метан и этан, а также высокомолекулярные алканы не имеют запах, но некоторые средние представители отличаются своеобразным запахом. Алканы – горючие соединения.
Реакция замещения: Галогенирование: СН 4 + Сl 2 →СН 3 Cl + НCl (хлорметан)
CH 3 Cl + Cl 2 → CH 2 Cl 2 + HCl (дихлорметан)
CH 2 Cl 2 + Cl 2 → CHCl 3 + HCl (трихлорметан)
CHCl 3 + Cl 2 → CCl 4 + HCl (тетрахлорметан).
Реакция нитрования: С 2 Н 6 + НNO 3 →C 2 H 5 NO 2 + H 2 O
Реакции разложения: СН 4 →С+2Н 2 , 2СН 4 →С 2 Н 2 + 3Н 2
Реакции окисления: СН 4 + 2О 2 →СО 2 +2Н 2 О
2СН 4 + О 2 →2СО+4Н 2
Каталитическое окисление метана приводит к образованию важных кислородсодержащих органических соединений.
2CH 4 +O 2 =2CH 3 OH
Применение

IV . Закрепление темы
Выпишите формулы алканов из формул приведенных ниже углеводородов: С 2 Н 4 , С 3 Н 8 , С 4 Н 6 , С 5 Н 12 , С 6 Н 6 , С 7 Н 16 . Назовите их. (Стр.57 зад.3)
Напишите, дополнив атомами водорода углеродный скелет, полные структурные формулы нижеприведенных углеводородов. Назовите их. (стр.57 зад. 6)
Напишите структурные формулы следующих алканов: а) н – пентан; б) 2 – метилбутан; в) 2,4 – диметилпентан; г) 3 – метил – 4 – этилгексан; д) триметилметан (стр. 57 зад.9)
Напишите структурные формулы следующих веществ:
а) 2,3 – диметилбутана,
б) 2,4 – диметил - 3 – этилпентана
в) н – пентана
V . Подведение итогов урока
Что нового на уроке узнали?
Что было интересным?
V І . Домашнее задание
Параграф 2.1, 2.2, 2.3, 2.4 написать минидоклад про метан и этан
Гомологический ряд алканов
Алканы
(предельные или насыщенные углеводороды, парафины) – углеводороды, атомы углерода в которых соединены простыми связями. Общая формула: .
Соотношение числа атомов водорода и углерода в молекулах алканов максимально по сравнению с молекулами углеводородов других классов.
Поскольку, все валентности углерода заняты либо углеродами, либо водородами, как правило, химические свойства алканов не очень ярко выражены, поэтому их еще называют предельными или насыщенными
углеводородами. И существует еще более древнее название, лучше отражающее их относительную, конечно, химическую инертность – парафины
, что переводится как «лишенные сродства».
Строение молекул
Атомы углерода в алканах находятся в состоянии – гибридизации , и молекулу алканов можно представить как набор тетраэдрических структур углерода, связанных между собой и с водородам.

Тетраэдрическое строение метана
Связи между атомами и прочные, практически неполярные (очень мало полярные).
Атомы вокруг простых связей постоянно вращаются. Поэтому молекулы алканов могут принимать разные формы. При этом длина связи и угол между связями остаются постоянными. Формы, переходящие друг в друга за счет вращения молекулы вокруг -связей, называют конформациями
молекулы.

Номенклатура алканов
Первые четыре члена ряда алканов имеют исторически сложившиеся названия. Названия неразветвленных алканов с пятью и более атомами углерода в молекуле, образованы от греческих числительных, отражающих это число атомов углерода.
Суффикс -ан
показывает принадлежность вещества к насыщенным соединениям.
Составляя названия разветвленных алканов по номенклатуре ИЮПАК, в качестве основной цепи выбирают цепь, содержащую максимальное число атомов углерода.
Основную цепь нумеруют таким образом, чтобы заместители получили наименьшие номера
. Если цепей одинаковой длины несколько, то главной выбирают цепь, содержащую наибольшее число заместителей.

Физические свойства алканов
Температуры плавления и кипения в целом увеличиваются с увеличением числа атомов в молекуле. Первые представители ряда алканов – газы при н.у., алканы, содержащие от 5 до 15 атомов – обычно жидкости, свыше 15 атомов – твердые вещества.
Неразветвленные изомеры имеют более высокую температуру кипения, чем разветвленные (причина – разные силы межмолекулярного взаимодействия). Температуры плавления зависят, кроме того, от плотности упаковки молекул в кристалле.
Газообразные и твердые алканы не пахнут, жидкие алканы обладают характерным “бензиновым” запахом.
Все алканы бесцветны, легче воды и нерастворимы в ней. Алканы хорошо растворяются в органических растворителях, жидкие алканы (пентан, гексан) сами широко используются как растворители.
Химические свойства алканов
Алканы относятся к углеводородам, в которых отсутствуют кратные связи. Одно из названий углеводородов этого ряда – парафины, обозначает их химическую пассивность. Поэтому химические свойства алканов определяются таким образом:
1.
Из-за предельности алканов реакции присоединения для них нехарактерны.
2.
Из-за прочных связей и (короткие и практически неполярные) следует малая реакционная способность (не реагируют с кислотами, щелочами, и т.п.)
3.
Неполярность связей свидетельствует о том, что реакции могут проходить по свободнорадикальному механизму.
Основной тип реакций – радикальное замещение (radical substitution) .
Разорвать связь можно при помощи нагревания или УФ-излучения. Обычно реакции алканов идут при повышенных температурах или на солнечном свету.
Реакция галогенирования.
При хлорировании атом в молекуле метана замещается на атом . В избытке хлора происходит дальнейшее замещение:
;
;
;
.
Реакция нитрования.
По механизму радикального замещения протекает реакция нитрования алканов в газовой фазе (реакция Коновалова). Условия – повышенные температура и давление.
В парообразном состоянии азотная кислота разлагается:
.
Оксид азота (IV) является радикалом . Он атакует молекулу алкана.
Итоговая реакция:
.
Горение алканов
Смесь метана с кислородом (в объёмном соотношении 1:2) или с воздухом (1:10) при поджигании сгорает со взрывом. Поэтому смеси метана, пропана, этана, бутана с воздухом очень опасны. Они иногда могут образоваться в шахтах, в мастерских, в жилых помещениях. С этими газами нужно проявлять осторожность при применении.

Урок по химии с применением ИКТ по теме "Алканы"
Цель урока: познакомить учащихся с алканами и выявить важную их роль в промышленности.
Задачи урока:
Образовательная: рассмотреть гомологический ряд предельных углеводородов, строение, физические и химические свойства, способы их получения при переработке природного газа, возможности их получения из природных источников: природного и попутного нефтяного газов, нефти и каменного угля.
Развивающая: развить понятие о пространственном строении алканов; развитие познавательных интересов, творческих и интеллектуальных способностей, развитие самостоятельности в приобретении новых знаний с использованием новых технологий.
Воспитательная: показать единство материального мира на примере генетической связи углеводородов разных гомологических рядов, получаемых при переработки природного и попутного нефтяного газов, нефти и каменного угля.
Оборудование: компьютер, мультимедиа проектор, экран, презентация.
Ход урока
I. Организационный момент. (Сообщить цель и тему урока).
II. Изученного нового материала.
Тема урока: "Алканы". Слайд № 1
План изучения алканов. Слайд № 2
Определение. Общая формула класса углеводородов.
Гомологический ряд.
Виды изомерии.
Строение алканов.
Физические свойства.
Способы получения.
Химические свойства.
Применение.
Алканы. (Предельные углеводороды. Парафины. Насыщенные углеводороды.)
Алканы - углеводороды в молекулах которых все атомы углерода связаны одинарными связями и имеют общую формулу: C n H 2n+2 Слайд № 3
Что такое гомологи?
Гомологический ряд метана
СН 4 метан
С 2 H 6 этан
C 3 H 8 пропан
C 4 H 10 бутан
C 5 H 12 пентан
C 6 H 14 гексан
C 7 H 16 гептан
C 9 H 20 нонан
Гомологи - это вещества, сходные по строению и свойствам и отличающиеся на одну или более групп СH 2 .
Структурная изомерия:
Алгоритм.
1. Выбор главной цепи: Слайд № 5
2. Нумерация атомов главной цепи: Слайд № 6
3. Формирование названия: Слайд № 7
2 - метилбутан
Строение алканов.
Атом углерода во всех органических веществах находится в "возбуждённом" состоянии, имеет на внешнем уровне четыре неспаренных электрона.
Каждое электронное облако обладает запасом энергии: s- облако имеет меньший запас энергии, чем р-облако, в атоме углерода они находятся в разных энергетических состояниях. Поэтому при образовании химической связи происходит гибридизация, т. е. выравнивание электронных облаков по запасу энергии. Это отображается на форме и направленности облаков, происходит перестройка (пространственная) электронных облаков.
В результате sp3 - гибридизации все четыре валентных электронных облака гибридизованы: валентный угол между этими осями гибридизованных облаков 109° 28", поэтому молекулы имеют пространственную тетраэдрическую форму, форма углеродных цепей зигзагообразна; атомы углерода не находятся на одной прямой, т. к. при вращении атомов валентные углы остаются прежними.
Все органические вещества построены в основном за счёт ковалентных связей. Углерод - углеродные и углерод - водородные связи относятся к сигма - связям - это связь, образующаяся при перекрывании атомных орбиталей по линии, проходящей через ядра атомов. Возможно вращение вокруг сигма - связей, поскольку эта связь имеет осевую симметрию. Слайд № 13
Физические свойства.
СН 4:C 4 Н 10 - газы
T кипения: -161,6:-0,5 °C
T плавления: -182,5:-138,3 °C
С 5 Н 12:C 15 Н 32 - жидкости
T кипения: 36,1:270,5 °C
T плавления: -129,8:10 °C
T кипения: 287,5 °C
T плавления: 20 °C
С увеличением относительных молекулярных масс предельных углеводородов закономерно повышаются их температуры кипения и плавления. Слайд № 14
Получение.
В промышленности
1) крекинг нефтепродуктов:
C 16 H 34 - C 8 H 18 + C 8 H 16
2) В лаборатории:
а) Гидролиз карбидов:
A l 4 C 3 +12 H 2 O = 3 CH 4 + 4 Al(OH) 3
б) Реакция Вюрца:
C 2 H 5 Cl + 2Na - C 4 H 10 + 2NaCl
в) Декарбоксилирование натриевых солей карбоновых солей:
СН 3 СООNa + 2NaОН - СН 4 + Nа 2 СО 3 Слайд № 15
Химические свойства
Для алканов характерны следующие типы химических реакций:
Замещение атомов водорода;
Дегидрирование;
Окисление.
1) Замещение атомов водорода:
А) Реакция галогенирования:
CH 4 +Cl 2 - CH 3 Cl + HCl
Б) Реакция нитрования (Коновалова):
CH 4 + HNO 3 - CH 3 -NO 2 + H 2 O + Q
В) Реакция сульфирования:
CH 4 + H 2 SO 4 - CH 3 -SO 3 H + H 2 O + Q
2) Реакция изомеризации:
CH 3 -CH 2 -CH 2 -CH 2 -CH 3 - СН 3 -СН-СН 2 -СН 3
3) Реакция с водяным паром:
CH 4 + H 2 O = CO + 3H 2
4) Реакция дегидрирования:
2СН 4 - НС=СН + 3Н 2 + Q
5) Реакция окисления:
CH 4 + O 2 - Н 2 C=О + H 2 O
6) Горение метана:
CH 4 + 2O 2 CO 2 + 2H 2 O + Q Слайд № 20
Применение.
(Возможно, заранее подготовленные выступления учащихся.)
Широко используются в качестве топлива, в том числе для
двигателей внутреннего сгорания, а также при производстве сажи
(1 - картриджи; 2 - резина; 3 - типографическая краска), при получение органических веществ (4 - растворителей; 5 - хладогентов, используемых в холодильных установках; 6 - метанол; 7 - ацетилен) Слайд № 21
III. Закрепление.
Составьте все возможные изомеры для гептана и назовите их.
Составьте 2 ближайших гомолога для пентана и назовите их.
Определить предельный углеводород, плотность паров которого по воздуху равна 2. (C 4 H 10).
Учебник: №12 (стр. 33).
IV. Домашнее задание: Учебник О.С. Габриелян (10 класс базовый уровень): 3, упр. 4, 7, 8 (стр. 32).
Литература.
Горковенко М. Ю. Поурочные разработки по химии к учебным комплектам О. С. Габриеляна и др., 10 (11) класс. М.: "ВЕКО", 2008 г.