Polimerizare radicală. Inițierea polimerizării radicalice Monomeri capabili să sufere reacții de polimerizare radicalică
5.1.1. Polimerizare radicală
Mecanismul de polimerizare
Cea mai simplă diagramă a lanțului cinetic pentru inițierea chimică poate fi reprezentată ca următoarea secvență de reacții:
1. Inițiere (chimică):
a) formarea radicalilor liberi primari
b) originea unui lanţ material
2. Creșterea lanțului material:
3. Rupere în lanțul material:
a) recombinare
b) disproportionare
c) transfer de lanț (creșterea lanțului cinetic);
pe moleculă de polimer
pe moleculă de monomer
pe moleculă de solvent
Când descriem procesul de polimerizare, se fac următoarele ipoteze:
- activitatea (reactivitatea) unui radical liber depinde numai de natura atomului pe care este localizat electronul nepereche și de mediul său imediat;
- lungimea medie a lanțului cinetic este mare;
- în mediul de reacţie se stabileşte o stare staţionară, adică. rata inițierii este egală cu rata morții radicalilor liberi.
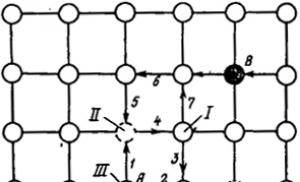
Interacțiunea particulelor de radicali liberi se referă la reacții chimice rapide. Cu toate acestea, apropierea particulelor care reacţionează se desfăşoară mult mai lent. În fig. Figura 5.1 prezintă o diagramă unidimensională care ilustrează rolul decisiv al proceselor de difuzie în toate etapele reacției de polimerizare.
Particulele active sunt înconjurate de molecule de solvent (medii), formându-se

Orez. 5.1. Schema de implementare a „efectului cușcă”:
eu- solvent; II- „gaura”; III-particulă care reacţionează
o „cușcă”, în interiorul căreia mișcarea lor este posibilă ca o serie de „sărituri” în goluri libere – „găuri”. Adunarea particulelor care reacţionează şi eliberarea produşilor de reacţie din această „cuşcă” este un proces controlat prin difuzie. Această caracteristică a procesului este definită ca „efectul de captivitate” sau „efectul de cușcă” (efectul Frank-Rabinovich).
Întrebare. 2,2"-azo- bis-izobutironitrilul (dinitrilul acidului azodiizobutiric - AIBN, porofor ChKZ) este utilizat pe scară largă în practica experimentală și industrială ca substanță care generează cu ușurință radicali liberi activi ca urmare a descompunerii termice conform schemei

Acest proces începe în soluție deja la 40°C. În același timp, s-a constatat că o creștere a vâscozității mediului de reacție duce la o scădere K d. Care este posibilul motiv pentru acest efect?
Răspuns. O scădere a vitezei de descompunere a inițiatorului cu creșterea vâscozității mediului de reacție se poate datora naturii în două etape a acestei reacții: în primul rând, se formează radicali.

Odată cu creșterea vâscozității mediului, „efectul de cușcă” inhibă separarea perechii de radicali formate inițial, prevenind astfel eliberarea particulelor active din „cușcă”. În acest sens, a doua etapă a procesului de descompunere completă a acestui compus în radicali liberi se desfășoară într-un ritm mai lent.
Lanț de inițiere (inițiere). Procesul de formare a centrilor activi este relativ lent și necesită cheltuirea unei anumite cantități de energie. Această etapă inițială a polimerizării radicalice se numește nucleare în lanț și duce la formarea de radicali liberi (secundari) din molecule de monomeri saturate cu valență. Radicalii liberi într-un sistem de polimerizare se pot forma în diferite moduri: sub influența căldurii, luminii, ultrasunetelor, radiațiilor dure (razele X, razele α-, β- și γ - inițiere fizică),
precum și cu introducerea inițiatorilor chimici de polimerizare, i.e. substanțe care se descompun ușor în radicali liberi. Excitarea reacției de polimerizare cu introducerea inițiatorilor este utilizată pe scară largă în producția de polimeri care formează fibre, deoarece acest lucru facilitează controlul procesului de sinteză. Descompunerea inițiatorului necesită furnizarea de energie externă și are loc într-un anumit ritm. De exemplu, inițiatorii polimerizării radicalilor liberi sunt compuși care se pot descompune: prin legătura ~O~O~ (I) sau prin  (II).
(II).
I. Energia de disociere a acestei legături este de 150-160 kJ/mol. Conexiunile de acest tip includ:

II. Energia de disociere a acestei legături este de 295 kJ/mol. Utilizarea compușilor azo ca inițiatori este predeterminată
2,2"-azo- bis-izobutironitril
NC-C(CH3)2-N=N-C(CH3)2-CN.
Viteza de formare a radicalilor liberi primari este descrisă de ecuația vitezei de reacție de ordinul întâi:
Ca rezultat al integrării și transformării ulterioare avem
unde [eu] tși [I] 0 - concentrațiile curente și inițiale ale inițiatorului; t- timp; Kd- constanta de viteză pentru reacția de descompunere a inițiatorului în radicali liberi.
Sarcină. Determinați constanta de viteză pentru descompunerea peroxidului de benzoil în dioxan la 80°C dacă concentrația sa inițială a fost de 1,1% și, după 10 minute, 1,07% peroxid de benzoil a fost detectat iodometric în sistem.
Soluţie. Conform ecuației (5.2),
ln = exp/ Kd) = 151,9 kJ/mol.Estimarea valorilor Δ E d vă permite să selectați cel mai potrivit interval de temperatură pentru sinteza polimerilor care formează fibre. În tabel 5.1 arată valorile energiei aparente de activare Δ E dși constante de viteză Kd pentru unii initiatori. Când se efectuează sinteza sub 85°C, se recomandă utilizarea AIBN. La temperaturi mai ridicate se obțin rezultate mai bune prin folosirea peroxidului de benzoil etc.
Tabelul 5.1. Caracteristicile cinetice ale unor inițiatori de polimerizare

Este recomandabil să se efectueze reacția de polimerizare la temperaturi sub 70°C folosind peroxizi anorganici.
Durata etapei de inițiere scade pe măsură ce crește cantitatea de radicali liberi.
Pentru a crește viteza de descompunere a inițiatorilor, de exemplu peroxizii, în amestecul de reacție se introduc „promotori” - agenți reducători. Sistemele de inițiere redox sunt utilizate pe scară largă pentru sinteza diferiților polimeri cu lanțuri de carbon. Inițierea procesului de polimerizare prin utilizarea sistemelor redox se caracterizează printr-un coeficient de temperatură mic (energie aparentă de activare relativ scăzută).
Astfel, sub influența factorilor fizici sau chimici, radicalii liberi apar în sistem, având, de exemplu, nepereche. p-electronii si, ca urmare, au activitate chimica mare. Ciocnirile radicalilor liberi duc la formarea unei legături covalente între ei cu formarea unei molecule inactive. Când un radical liber interacționează cu o moleculă inactivă, se formează un produs de reacție, care are, de asemenea, un electron nepereche și are aproape aceeași activitate ca radicalul liber original. Aceste procese pot fi ilustrate printr-o diagramă
R* + R* → R: R; R* + M → R: M*.
Tendința de a suferi reacții de adiție limitează durata de viață a radicalilor liberi. De exemplu, timpul de înjumătățire al radicalului H3C* este de 10 -4 s. Cu toate acestea, împerecherea celor nepereche p-electron [de exemplu, în trifenilmetil (C 6 H 5) 3 C * ] sau screening cu substituenții săi incluși în radicalul liber, de exemplu în difenilpicrilhidrazil

crește dramatic stabilitatea radicalilor liberi.
Ca rezultat al inițierii chimice, radicalul liber devine grupul terminal al lanțului polimeric în creștere.
Timpul necesar pentru inițierea unui lanț se numește perioadă de inducție. Substanțele care măresc perioada de inducție se numesc inhibitori. Nu toți radicalii liberi interacționează cu monomerii și inițiază o reacție. Unele dintre ele sunt dezactivate după o coliziune reciprocă. Raportul dintre numărul de radicali atașați la monomer și inițierea reacției la numărul total al tuturor radicalilor formați se numește eficiența inițiatorului f e. Eficacitatea inițiatorului poate fi evaluată prin una dintre cele trei metode:
- prin compararea vitezei de descompunere a inițiatorului și a vitezei de formare a moleculelor de polimer (această tehnică necesită măsurarea precisă a greutății moleculare medii a polimerului);
- compararea cantităţii de iniţiator combinată cu polimerul cu cantitatea de iniţiator descompus;
- folosind un inhibitor care rupe lanțurile cinetice.
De exemplu, utilizarea difenilpicrilhidrazil face posibilă terminarea lanțului conform schemei

Sarcină. Calculați eficiența 2,2"-azo- bis-izobutironitril, dacă în timpul polimerizării stirenului concentrația inițială a inițiatorului a fost de 1,1%, iar în 20 de minute de reacție s-au eliberat 80 cm3 de azot la 100 g de monomer (în condiții normale). Gradul de conversie a monomerului a ajuns la 5%. Greutatea moleculară a polimerului rezultat este 2500 (determinată prin metoda osmometrică).
Soluţie. Când molecula inițiatoare se descompune, se formează doi radicali liberi și se eliberează o moleculă de azot. Se calculează numărul de moli de inițiator la începutul reacției la 100 g de monomer:
[I] 0 = 1,1/164 = 0,007 = 7 10 -3.
Cantitatea de azot eliberată va fi
80/(22,4 1000) = 3,5 10 -3.
Astfel, în 20 de minute de reacție s-au descompus 3,5 × 10 -3 moli de inițiator și, în consecință, s-au format 7 × 10 -3 moli de radicali. La o rată de conversie de 5% și o greutate moleculară medie de 2500, numărul de moli de polimer formați este
5/2500 = 2 · 10 -3.
Să presupunem că toate lanțurile cinetice s-au încheiat în recombinarea radicalilor și, prin urmare, 1 mol de inițiator a fost consumat la 1 mol de polimer. De aici găsim eficiența inițiatorului f e:
f e = 2,0 · 10 -3 /(3,5 · 10 -3) = 0,6.
În general, rata de dezintegrare a inițiatorului V 0 = Kd[Eu].
Pentru cei mai folosiți inițiatori f e este în intervalul 0,3-0,8, adică aproape intotdeauna f e f e variază în funcție de mediu: natura și cantitatea de inițiator, monomer, solvent etc.
De exemplu, la inițierea polimerizării acrilonitrilului cu acid dinitril azodiizobutiric în dimetilformamidă și o soluție apoasă 51,5% de NaCNS, valoarea K d f e în al doilea caz se dovedește a fi semnificativ mai puțin datorită manifestării mari a „efectului de cușcă” (vâscozitatea mediului crește și apar și efecte specifice de solvație).
Numeroase date experimentale au stabilit că la o concentrație constantă de monomer, viteza de polimerizare este proporțională cu rădăcina pătrată a concentrației inițiatorului („regula rădăcinii pătrate”):
Unde LA- constanta vitezei de polimerizare totala; [M] - concentrația de monomer; [I] - concentrația inițiatorului;
Unde Kd este constanta vitezei de dezintegrare a inițiatorului; LA p este constanta vitezei de creștere a lanțului polimeric; LA 0 - constanta vitezei de întrerupere a circuitului.
Întrebare. Polimerizarea în heterofază a clorurii de vinil în prezența peroxidului de benzoil are loc în condiții izoterme de 6-8 ori mai lent decât în prezența acidului azodiizobutiric dinitril. Explicați posibilul motiv pentru acest fenomen.
Răspuns. Peroxidul de benzoil este foarte puțin solubil în apă. Prin urmare, rata de inițiere atinge o valoare vizibilă numai după ce concentrația particulelor inițiatoare în dispersie este suficient de mare [vezi. ecuația (5.3)]. Dinitrilul acidului azodiizobutiric este mai bine solubil în apă și, prin urmare, perioada de inducție a procesului de polimerizare, care determină durata totală a procesului, va fi mai scurtă în acest caz.
Continuarea (creșterea) lanțului. Reacțiile de continuare (creștere) a unui lanț cinetic se numesc elementare
etape ale unei reacții în lanț care apar cu păstrarea valenței libere și conduc la consumul de substanțe inițiale și formarea produselor de reacție. În timpul polimerizării, această secvență de reacții determină creșterea lanțului polimeric:

Creșterea lanțului este o etapă rapidă a procesului de polimerizare, descrisă de ecuația (5.3). Viteza de polimerizare crește, de asemenea, odată cu creșterea concentrației de monomer în mediul de reacție.
Întreruperea circuitului. Terminarea lanțului cinetic este etapa procesului de lanț care duce la dispariția valenței libere. Lanțul cinetic poate fi rupt:
ca urmare a recombinării, adică interacțiunea a doi radicali liberi identici sau diferiți,

sau disproporționare, adică transferul unui proton de la un radical la altul, cu pierderea activității produșilor de reacție, adică

Energia de activare a primei reacții - recombinare - este aproape de zero și, în orice caz, nu depășește 0,5-1,5 kJ/mol, în timp ce energia de activare a disproporționării atinge valori de 16-18 kJ/mol.
Oprirea creșterii unei macromolecule poate apărea ca urmare a recombinării și disproporționării macroradicalilor.
În același timp, același efect se observă atunci când un radical polimer (macroradical) întâlnește o moleculă inactivă. Oprirea creșterii unei macromolecule ca urmare a transferului unui electron nepereche la o moleculă inertă se numește transfer de lanț cinetic („otropie radicală”). Acest proces poate duce la adăugarea unui atom de hidrogen la lanțul polimeric în creștere:

Moleculele unui inițiator, solvent, monomer, polimer inactiv sau macroradical etc. pot acționa ca RH. Constantele de viteză ale acestor reacții vor fi în mod corespunzător LA P i , K P s , K p m, K p p.
Întrebare.În procesul de polimerizare a radicalilor liberi, se formează macromolecule ramificate împreună cu macromolecule liniare. Scrieți o schemă probabilă pentru formarea unor astfel de ramuri în timpul polimerizării acetatului de vinil în prezența peroxidului de benzoil.
Răspuns. La grade ridicate de conversie, macromoleculele (și macroradicalele) rezultate pot fi expuse radicalilor liberi mobili. Cea mai vulnerabilă parte a macromoleculei sunt atomii de hidrogen de la atomii de carbon terțiari:

Ruperea lanțului cinetic duce la o scădere a gradului de polimerizare a compusului cu molecul înalt rezultat. Uneori, pentru a regla viteza procesului și greutatea moleculară a polimerilor, la amestecul de reacție se adaugă substanțe speciale (hidrochinonă, nitrobenzen etc.), numite inhibitori de polimerizare. Acțiunea lor se bazează pe legare
centrii activi ai lanțului cinetic. Lungimea lanțului cinetic v este
Unde V r și Vt- rata de creștere și respectiv ruperea lanțului.
Folosind inhibitori de polimerizare, randamentul și proprietățile polimerului rezultat (greutatea moleculară medie, gradul de polidispersitate) pot fi variate într-un interval relativ larg.
Întrebare.În perioadele inițiale de polimerizare cu radicali liberi se formează polimeri cu greutate moleculară maximă. Pe măsură ce gradul de conversie a monomerului (randamentul polimerului) crește, greutatea sa moleculară scade de obicei. Explicați cauza probabilă a acestui fenomen.
Răspuns. Pe măsură ce gradul de conversie crește, crește numărul de lanțuri cinetice în creștere în mediul de reacție, ceea ce determină o creștere a probabilității proceselor de recombinare.
Polimerizarea este un proces complex și adesea nu poate fi descris printr-o singură ecuație stoechiometrică, deoarece în unele cazuri terminarea lanțului duce la apariția anumitor produse secundare. Cu toate acestea, dacă lungimea lanțului cinetic este suficient de lungă, polimerizarea poate fi descrisă cu o aproximare suficientă printr-o singură ecuație stoechiometrică. Viteza de reacție în lanț v egal cu produsul ratei de inițiere a lanțului v iși lungimea lanțului cinetic v:
în care v= (1 - β)/β, unde β este probabilitatea de rupere a lanțului în fiecare etapă de creștere. Lungimea lanțului cinetic v poate fi calculată pe baza relației
Sarcină. Definiți valoarea LA R/ LA
poate fi determinată din ecuația pentru viteza de polimerizare în regim de echilibru, care descrie bine procesul în stadiul inițial [ecuația (5.3)]. După transformarea ecuațiilor (5.3) și (5.4), obținemln([M] 0 /[M] t) = (K p/ K
)V i t. În prezența captatorilor de radicali liberi, procesul încetinește (inhibă). Dacă CU este concentrația inhibitorului, atunci viteza reacției de inițiere poate fi calculată din dependențăV i= C ing t i.
Conform acestei dependențe empirice, pentru orice concentrație de inhibitor aleasă în mod arbitrar (de exemplu, 0,2 mol/dm 3 ), valoarea corespunzătoare poate fi calculată t, și, prin urmare, rata de inițiere:
- t= 2 · 10 -5 + 2857 · 0,2 = 571 min;
- V i= 1 · 10 -1 /571 = 5,83 · 10 -6 mol/(dm 3 s).
Pentru două momente de timp ≥ t i puteți calcula valoarea LA R/ LA
= = 0,25.În conformitate cu ecuațiile (5.3) și (5.4) avem
Unde f e - eficienta initiatorului; Kd- constanta de viteză de descompunere a inițiatorului; [M] - concentrația de monomer; [I] este concentrația inițiatorului.
S-a remarcat mai devreme că valorile f e și Kd poate fi măsurat separat. De asemenea, determinat experimental V p , [I], [M]. Avand astfel gasit K
= 2,34 · 10 -7 .La grade scăzute de conversie, rata totală de polimerizare V este descrisă satisfăcător de ecuația (5.8). Dependență de temperatură V, caracterizată prin energia aparentă de activare a procesului de sinteză, este descrisă prin egalitate
Δ E turație = 1/2Δ E i - Δ E p + 1/2A E o,
unde Δ E i, Δ E p și Δ E o sunt energiile aparente de activare ale etapelor de inițiere, creștere și, respectiv, de terminare a lanțului.
Pentru majoritatea monomerilor vinilici
- Δ E i= 130 ± 10 kJ/mol; Δ E p = 25 + 5 kJ/mol;
- Δ E o = 6 ± 2 kJ/mol.
Aceasta înseamnă că odată cu creșterea temperaturii în toate cazurile, viteza reacției de polimerizare crește.
Lungimea lanțului cinetic v în condiții de sinteză izotermă este determinată numai de natura monomerului.
Reacția de polimerizare implică compuși care conțin cel puțin o legătură sau inele multiple. Reactivitatea unui monomer depinde de structura sa, de conjugarea dublei legături în molecula de monomer, de numărul și aranjamentul relativ al substituenților și de efectul de polarizare a acestora asupra dublei legături.
Polimerizarea radicală are loc printr-un mecanism în lanț și este descrisă de cinetica unei reacții în lanț neramificate.
Principalele etape ale reacției în lanț:
- Iniţiere- formarea de centre active;
- Creșterea lanțului- adăugarea secvenţială de monomeri la centrul activ;
- Circuit deschis- decesul centrului activ;
- Transmisie cu lanț- transferul centrului activ la o altă moleculă.
I. Inițierea lanțului (nuclearea)
Această etapă este cea mai consumatoare de energie. Distinge fizicȘi chimic iniţiere.
Initierea fizica:
Initierea chimica
Această metodă de inițiere este folosită cel mai des. Principiul este de a folosi substanțe inițiatoare(peroxizi, compuși azoici, sisteme red-ox), în care energia de rupere a unei legături chimice este semnificativ mai mică decât cea a monomerilor. În acest caz, procesul are loc în două etape: în primul rând, sunt generați radicalii inițiatori, care apoi se unesc cu molecula de monomer, formând un radical monomer primar.


Inițiatorul este foarte asemănător ca proprietăți cu catalizatorul, dar diferența sa este asta inițiatorul este cheltuitîn timpul unei reacții chimice, dar un catalizator nu.
Exemple de inițiatori:

II. Creșterea Lanțului
Monomerii se atașează alternativ la centrul activ al radicalului monomer primar.

III. Circuit deschis
Terminarea lanțului apare ca urmare a morții centrilor activi (terminarea lanțului cinetic).
- Rupere în lanțul cinetic- dispar centrele active;
- Rupere în lanțul material- când un anumit lanț încetează să crească, dar centrul activ este transferat la o altă macromoleculă sau monomer (reacție de transfer în lanț).
Reacții care duc la moartea lanțului cinetic și material - reacții recombinareȘi disproporționare. 
Tipul de reacție de terminare a lanțului (recombinare sau disproporționare) depinde de o serie de factori, în special de structura moleculei de monomer. Dacă monomerul conține un substituent care este voluminos ca dimensiune sau electronegativ ca natură chimică, atunci astfel de radicali în creștere nu se ciocnesc între ei și terminarea lanțului are loc prin disproporționare. De exemplu, în cazul metacrilatului de metil:

Pe măsură ce radicalii cresc, vâscozitatea sistemului crește, iar datorită mobilității macroradicalilor, rata de terminare a lanțului prin recombinare scade. O creștere a duratei de viață a macroradicalilor cu o creștere a vâscozității sistemului duce la un fenomen interesant - accelerarea polimerizării în etapele ulterioare ( efect de gel) datorită creșterii concentrației de macroradicali.
IV. Transmisie cu lanț
Transferul în lanț are loc prin desprinderea unui atom sau a unui grup de atomi dintr-o moleculă de către un radical în creștere. Reacția de transfer în lanț duce la ruperea lanțului material, iar creșterea lanțului cinetic continuă.
Transmisiile în lanț se disting:

Caracteristici ale polimerizării radicalice:
- Rată ridicată de polimerizare;
- Ramificare;
- Sunt posibile conexiuni g-g, g-xv, xv-xv;
- Polimeri polimoleculari.
Cinetica polimerizării radicalice
Cinetica chimică este o ramură a chimiei care studiază mecanismul și modelele unei reacții chimice în timp și dependența acestor modele de condițiile externe.
Pentru a studia cinetica polimerizării radicalice, este necesar să se ia în considerare dependența vitezei de reacție și a gradului de polimerizare de concentrația substanțelor de pornire, presiune și temperatură.
Denumiri:

I. Influența concentrației substanțelor inițiale asupra vitezei de reacție.
Viteza totală de reacție depinde de viteza de formare a radicalilor V in (viteza de inițiere), de viteza de creștere a lanțului V r și de terminarea acestuia V o.

Vom lua în considerare reacția de polimerizare a radicalilor liberi, atunci când inițierea este efectuată folosind inițiatori chimici.
Să ne uităm la fiecare etapă:

Luarea în considerare a cineticii este mult facilitată dacă reacția are loc în condiții apropiate de modul staționar, la care ratele de apariție și de dispariție a radicalilor liberi pot fi considerate egale. În acest caz, concentrația de centri activi va fi constantă.

După cum se poate vedea din graficul curbei, cinci secțiuni pot fi distinse în funcție de vitezele reacției principale de conversie a unui monomer într-un polimer ca urmare a polimerizării:
1 - situs de inhibiție, unde concentrația de radicali liberi este scăzută. Și nu pot începe procesul de polimerizare în lanț;
2 - secțiunea de accelerare a polimerizării, unde începe reacția principală de transformare a monomerului în polimer, iar viteza crește;
3 - zonă staționară, unde polimerizarea cantității principale de monomer are loc la o viteză constantă (dependența în linie dreaptă a conversiei în timp);
4 - secțiunea de încetinire a reacției, unde viteza de reacție scade din cauza scăderii conținutului de monomer liber;
5 - încetarea reacției principale după epuizarea întregii cantități de monomer.Modul staționar este de obicei observat în stadiul inițial al reacției, când vâscozitatea masei de reacție este scăzută și cazurile de nucleare a lanțului și terminarea lanțului sunt la fel de probabile .

Astfel, rata reacției de creștere în lanț este:

II. Influența concentrației de substanțe inițiale asupra gradului de polimerizare.
Gradul de polimerizare depinde de raportul dintre ratele de creștere și de terminare a lanțului:

Să luăm în considerare expresiile corespunzătoare pentru viteze

Gradul de polimerizare este:

III. Efectul temperaturii asupra vitezei reacției de propagare în lanț.


Să înlocuim ecuația lui Arrhenius în ecuația ratei de creștere a lanțului:
Să luăm logaritmul expresiei rezultate:
Numătorul (6+15-4 = 17) este mai mare decât zero, ceea ce înseamnă că cu cât temperatura este mai mare, cu atât este mai mare viteza de reacție de polimerizare radicalică. Cu toate acestea, pe măsură ce temperatura crește, crește și probabilitatea ca radicalii să se ciocnească între ei (terminarea lanțului prin disproporționare sau recombinare) sau cu impurități cu greutate moleculară mică. Ca rezultat, greutatea moleculară a polimerului în ansamblu scade, iar proporția fracțiilor cu greutate moleculară mică din polimer crește. Numărul de reacții secundare care duc la formarea de molecule ramificate crește. Neregularitatea în construcția lanțului polimeric crește din cauza creșterii proporției de tipuri de conexiune monomer „cap la cap” și „coadă la coadă”.

Energia de activare a creșterii ~ 6 kcal/mol;
Energia de activare de inițiere ~30 kcal/mol;
Energia de activare de terminare este de ~8 kcal/mol.
Numătorul (6-15-4 = -13) este mai mic decât zero, ceea ce înseamnă că odată cu creșterea temperaturii gradul de polimerizare scade. Ca rezultat, greutatea moleculară a polimerului în ansamblu scade, iar proporția fracțiilor cu greutate moleculară mică din polimer crește.
V. Efectul presiunii asupra vitezei de polimerizare
Principiul lui Le Chatelier: Dacă un sistem este expus unei influențe externe, atunci procesele sunt activate în sistem care slăbesc această influență.

Cu cât presiunea este mai mare, cu atât este mai mare rata de polimerizare radicalică. Cu toate acestea, pentru a influența proprietățile sistemelor condensate, trebuie aplicată o presiune de câteva mii de atmosfere.
O caracteristică a polimerizării sub presiune este că creșterea vitezei nu este însoțită de o scădere a greutății moleculare a polimerului rezultat.
Inhibitori și retardanți de polimerizare.
Fenomenele de circuit deschis și transmisie sunt utilizate pe scară largă în practică pentru:
- prevenirea polimerizării premature în timpul depozitării monomerilor;
- pentru a regla procesul de polimerizare
În primul caz, se adaugă la monomeri inhibitori sau stabilizatori, care provoacă terminarea lanțului și se transformă ei înșiși în compuși care nu sunt capabili să inițieze polimerizarea. De asemenea, distrug peroxizii formați atunci când monomerul reacţionează cu oxigenul atmosferic.
Inhibitori: chinone, amine aromatice, compuși nitro, fenoli.
Regulatoare polimerizarea determină terminarea prematură a lanțului material, reducând greutatea moleculară a polimerului proporțional cu cantitatea de regulator introdusă. Un exemplu al acestora sunt mercaptanii.
Termodinamica polimerizării radicalice
Reacția de creștere în lanț este reversibilă; odată cu adăugarea monomerului la centrul activ, poate avea loc și eliminarea-depolimerizarea acestuia.
Posibilitatea termodinamică de polimerizare, ca orice alt proces chimic de echilibru, poate fi descrisă folosind funcțiile Gibbs și Helmholtz:

Cu toate acestea, funcția Gibbs este cea mai apropiată de condițiile reale, așa că o vom folosi:
De asemenea, modificarea funcției Gibbs este legată de constanta de echilibru a reacției prin ecuația:

Constanta echilibrului polimerizare-depolimerizare la o greutate moleculară suficient de mare a polimerului rezultat (p>>1) depinde numai de concentrația de echilibru a monomerului:


De unde rezultă că

Din ecuația (a) puteți afla temperatura la care nu va avea loc reacția de polimerizare, iar din ecuația (b) puteți găsi concentrația de echilibru a monomerului, peste care va avea loc polimerizarea.
Efectul temperaturii
Pentru a determina efectul temperaturii asupra concentrației de echilibru, prezentăm ecuația (b) după cum urmează:

În cazul în care ΔH°<0 и ΔS°<0 с ростом температуры увеличивается равновесная концентрация мономера. Верхний предел ограничен концентрацией мономера в массе. Это значит, что есть некоторая верхняя предельная температура - Т в.пр. , выше которой полимеризация невозможна.

În cazul în care ΔH°>0 și ΔS°>0 se observă o relație inversă: odată cu scăderea temperaturii, concentrația de echilibru a monomerului crește. În consecință, pentru monomerii cu efect termic negativ există o temperatură limită mai mică T n.a.

Sunt cunoscute și cazuri când aceste dependențe nu se intersectează, dar nu prezintă interes practic.

Probabilitatea termodinamică
Acum luați în considerare posibilitatea termodinamică a unei reacții, a cărei condiție este egalitatea ΔG<0. Оно определяется как изменением энтальпии так и энтропии, причем вклад энтропийного члена будет изменяться с температурой реакции.

În timpul polimerizării de-a lungul mai multor legături, entropia sistemului scade întotdeauna, adică. procesul este neprofitabil din motive entropice. Dependența slabă a ∆S° de natura monomerului se datorează faptului că principala contribuție la ∆S° provine din pierderea gradelor de libertate translaționale ale moleculelor de monomer.

Dar sunt cunoscuți și monomerii pentru care are loc o creștere a entropiei în timpul polimerizării. Această modificare a ∆S° este tipică pentru unele cicluri nesolicitate. Mai mult, deoarece polimerizarea se dovedește a fi benefică din punct de vedere entropic, poate apărea chiar și cu efecte termice negative (polimerizarea ciclurilor S 8 și Se 8 cu formarea de polimeri liniari)
Calculele și măsurătorile entropiei pentru polimerizarea majorității monomerilor vinilici arată că ∆S° este de aproximativ 120 J/K mol.
Dimpotrivă, ∆Н° variază în funcție de structura chimică a monomerului într-un interval destul de larg (∆Q° = −∆Н° variază de la câțiva kJ/mol la 100 kJ/mol), ceea ce se datorează diferenței de natura legăturii multiple și a substituenților săi. Valorile negative ale ∆Н° indică faptul că polimerizarea este benefică din punctul de vedere al factorului entalpie. La temperaturi obișnuite de ordinul a 25°C, polimerizarea este solubilă termodinamic pentru monomerii al căror efect termic depășește 40 kJ/mol. Această condiție este îndeplinită pentru majoritatea monomerilor vinilici. Totuși, în timpul polimerizării la legătura C=O, efectele termice sunt sub 40 kJ/mol. Prin urmare, condiția ∆G<0 соблюдается только при достаточно низких температурах, когда |TΔS°|<|ΔH°|.
Să luăm în considerare fenomenul de discrepanță între entalpia teoretică și practică a polimerizării



Se eliberează mai puțină energie, unde se duce?
- Efectul de cuplare este distrus;
- Repulsie sterică (în timpul sintezei polistirenului se formează o moleculă elicoidală din cauza repulsiei sterice).

Motivul creșterii Q în timpul polimerizării inelelor este unghiul de legătură nefavorabil termodinamic dintre orbitalii hibridizați și respingerea perechilor de electroni singuri ale substituentului.
- Deschiderea ciclului (ΔS 1° > 0)
- Creșterea lanțului (ΔS 2°< 0)
ΔS° = ΔS 1° + ΔS 2°, ΔS° poate fi mai mare sau mai mic decât zero.
Polimerizarea radicală este de obicei un tip de reacție în lanț. Astfel de reacții apar sub influența radicalilor liberi care se formează la începutul procesului și apoi reacţionează cu molecule neutre pentru a forma noi radicali reactivi.
Polimerizarea în lanț poate fi inițiată prin metode cunoscute pentru reacțiile în lanț în fază gazoasă, inclusiv radiația ultravioletă. Un act de inițiere a polimerizării în lanț duce la conectarea a mii de molecule de monomeri unele cu altele. Alte semne ale naturii în lanț radical al reacției de polimerizare sunt influența impurităților și a formei vasului de reacție asupra vitezei sale, aspectul specific în formă de S al curbei cinetice (dependența gradului de conversie a monomerului în polimer în timp). , Fig. 5).
|
|
Orez. 5. Curba tipică de polimerizare cinetică în formă de S
Polimerizarea radicală are trei etape caracteristice reacțiilor în lanț: inițierea, creșterea și terminarea lanțului.
Pentru iniţiere
reacția necesită ca sistemul să producă (genereze) radicali liberi ca urmare a expunerii termice (inițiere termică), ușoară (fotoinițiere), expunerea la radiații (inițierea radiațiilor), introducerea de iniţiatori chimici (inițierea radicalilor chimici) etc. Inițierea termică este rar utilizată, deoarece este asociată cu costuri mari de energie și, în același timp, atât procesul de reacție în sine, cât și proprietățile polimerului finit sunt greu de controlat. Fotoinițiarea este utilizată în principal pentru a studia mecanismul reacțiilor de polimerizare. Constă în excitarea moleculei de monomer ca urmare a absorbției unui cuantum de lumină și apoi a generării de radicali liberi. Spre deosebire de polimerizarea termică, viteza fotopolimerizării nu depinde de temperatură, deoarece energia sa de activare este mult mai mică. Viteza crește odată cu creșterea intensității iradierii. În acest caz, confirmarea naturii în lanț a reacției este apariția polimerizării după îndepărtarea sursei de lumină (Fig. 6).

Orez. 6. Viteza de polimerizare a butadienei: 1 - în timpul iluminării, 2 - după încetarea iluminării
Polimerizarea prin radiații este similară în principiu cu fotopolimerizarea. Viteza sa crește, de asemenea, odată cu creșterea intensității iradierii și nu depinde de temperatură. Viteza de radiație și fotopolimerizare poate fi crescută prin adăugarea de substanțe care se descompun ușor sub influența radiațiilor sau a luminii (așa-numiții sensibilizatori de polimerizare), de exemplu polihalogenuri - CCl4, C2Cl6 etc.
Metodele termice, foto și radiații de inițiere a unei reacții de polimerizare în lanț sunt fie ineficiente, fie sunt însoțite de diferite efecte secundare (ramificare, distrugerea lanțurilor etc.). Prin urmare, în practică, cel mai des este utilizată inițierea chimică, care se realizează prin introducerea specială în sistem de substanțe care se descompun ușor în radicali - iniţiatori. Cele mai frecvente dintre ele sunt peroxizii, compușii azoici și diazoici. Descompunerea acestor compuși în radicali poate fi efectuată în diferite moduri, inclusiv încălzire, descompunere fotochimică etc. De exemplu, la o încălzire ușoară, peroxidul de benzoil se descompune conform următoarei scheme:
și hidroperoxid de izopropilenbenzen ca acesta:

Dinitrilul acidului azoizobutiric (azo-bis-izobutironitril) se descompune pentru a elibera azot:
Radicalii liberi (R·) reacționează ușor cu molecula de monomer:
|
|
care devine un radical liber și reacționează cu următoarea moleculă de monomer și astfel are loc reacția de creștere în lanț. Deoarece stabilitatea radicalilor formați în timpul descompunerii peroxizilor, compușilor azoici și a altor inițiatori este diferită, viteza reacției lor cu moleculele de monomer și, prin urmare, viteza de polimerizare este diferită. Pentru a facilita descompunerea inițiatorilor și a reduce energia de activare a etapei de inițiere, în reacție se introduc agenți reducători (amine și alți compuși, săruri metalice cu valență variabilă).
Etapă creșterea lanțului necesită o energie de activare semnificativ mai mică - 25,1-33,5 kJ/mol (6-8 kcal/mol) decât stadiul de inițiere - 84-126 kJ/mol (20-30 kcal/mol), și reprezintă interacțiunea radicalilor liberi în creștere cu molecule de monomer, care în cele din urmă duce la formarea unei macromolecule polimerice:
Macromolecula neutră se formează în stadiu întreruperea circuitului, din care energia de activare este de 8-17 kJ/mol (2-4 kcal/mol):

Această terminare a lanțului are loc ca urmare a ciocnirii a doi macroradicali în creștere (recombinare). De asemenea, este posibil ca astfel de radicali să se disproporționeze pentru a forma două molecule neutre:

Motivul pentru terminarea lanțului poate fi și adăugarea de substanțe cu greutate moleculară mică prezente în sistem (inițiatori, inhibitori etc.) la macroradical. Durata de viață a radicalilor în creștere este scurtă (de obicei câteva secunde). Pe măsură ce radicalii cresc, vâscozitatea sistemului crește, iar datorită scăderii mobilității macroradicalilor, rata de terminare a lanțului prin recombinare scade. Durata de viață a radicalilor crește, de asemenea, odată cu scăderea temperaturii. O creștere a duratei de viață a macroradicalilor cu creșterea vâscozității sistemului duce la un fenomen interesant - accelerarea polimerizării în etapele ulterioare (efect de gel) datorită creșterii concentrației de macroradicali.
După cum se poate observa din schemele de reacție date pentru creștere și terminarea lanțului, se formează macromolecule polimerice de diferite greutăți moleculare. O gamă largă de valori ale greutății moleculare pentru o probă de polimer duce de obicei la o deteriorare a proprietăților sale mecanice. Prin urmare, atunci când produc un polimer, ei se străduiesc să-i regleze greutatea moleculară, ceea ce se poate realiza prin modificarea intenționată a ratei de creștere a lanțului.
În acest scop, utilizați reacția lanț de transmisie, care constă în faptul că substanța introdusă în sistem - regulatorul - rupe lanțul în creștere, dar în același timp ea însăși devine un radical liber și începe un nou lanț cinetic al reacției de polimerizare. Astfel, în acest caz, lanțul material se rupe, iar lanțul cinetic continuă, în timp ce în reacția de terminare obișnuită, atât lanțul cinetic, cât și cel material se rupe. Rolul agenților de transfer de lanț poate fi îndeplinit de un solvent (compușii care conțin halogen, precum CC14, sunt deosebit de activi), un monomer sau substanțe special introduse (regulatori), precum mercaptanii.
(circuit deschis)
(începutul unui nou lanț)
 sau
sau
În toate cazurile, o nouă macromoleculă de polimer crește pentru fiecare eveniment de transfer de lanț. Transferul de lanț poate avea loc și la o moleculă de polimer. În acest caz, se formează o macromoleculă ramificată. Creșterea temperaturii și creșterea cantității de agent de transfer în lanț (de exemplu, hidrocarburi halogenate) conduc la o creștere bruscă a vitezei reacției de transfer în lanț, iar această reacție inhibă alte etape de polimerizare, astfel încât se formează substanțe individuale cu greutate moleculară mică. care pot fi separate (reacție de telomerizare). Acestea conțin grupări terminale din produsele de scindare ai agentului de transfer de lanț și sunt active în diferite reacții chimice, în special în producerea de noi polimeri.
Substanțele cu greutate moleculară mică care, ca urmare a reacției cu radicalii monomeri, împiedică sau încetinesc creșterea macromoleculelor se numesc inhibitori
sau moderatori. Sunt utilizate pe scară largă pentru a preveni polimerizarea prematură sau pentru a reduce viteza acesteia, pentru a obține polimeri cu greutatea moleculară dorită și cu o structură mai regulată. Astfel de substanțe sunt benzochinona, nitrobenzenul etc. (Fig. 7).

Orez. 7. Polimerizarea termică a stirenului la 100°C în prezența inhibitorilor și moderatorilor:
1 - fără aditivi; 2-0,1% benzochinonă (inhibitor); 3 - 0,2% nitrobenzen (inhibitor); 4- 0,5% nitrobenzen (moderator)
Moderatorul îndeplinește un dublu rol: reduce concentrația de radicali și durata de viață a acestora, ceea ce duce la scăderea lungimii lanțului polimeric. Inhibitorul nu afectează viteza de polimerizare, dar previne debutul inițierii lanțului, mărind perioada de inducție pe curba cinetică de polimerizare. Mărimea perioadei de inducție este de obicei proporțională cu cantitatea de inhibitor administrată. Aceeași substanță poate acționa ca un inhibitor, ca un retardator și ca un regulator de polimerizare, în funcție de natura monomerului polimerizat. Deosebit de interesant în acest sens este oxigenul, care, de exemplu, încetinește polimerizarea acetatului de vinil și accelerează polimerizarea stirenului. La presiuni mari și temperaturi ridicate, oxigenul favorizează polimerizarea etilenei, care este utilizată în producția industrială a polietilenei de înaltă densitate. Oxigenul formează peroxizi sau hidroperoxizi atunci când reacționează cu monomerii sau lanțurile în creștere. În funcție de stabilitate, acești peroxizi sau hidroperoxizi intermediari pot fie să crească concentrația de radicali și să accelereze polimerizarea, fie să dezactiveze radicalii existenți și să încetinească sau chiar să inhibe polimerizarea.
Luarea în considerare a legilor cinetice ale polimerizării radicale a făcut posibilă tragerea unui număr de concluzii importante, practic și teoretic, despre influența diferiților factori asupra acestui proces. S-a stabilit că viteza de inițiere este proporțională cu concentrația inițiatorului și viteza totală de polimerizare în perioada staționară (când rata de inițiere este egală cu viteza de terminare a lanțului și, prin urmare, rata totală este egală cu rata de creștere a lanțului) este proporțională cu rădăcina pătrată a concentrației de inițiator și prima putere a concentrației de monomer u = K[ M]1/2. În ceea ce privește gradul de polimerizare, adică greutatea moleculară, acesta este invers proporțional cu rădăcina pătrată a concentrației inițiatorului n = K`[M]/1/2. Sensul fizic al acestei propoziții este că, pe măsură ce crește concentrația inițiatorului, crește și numărul de radicali formați în sistem. Acești radicali reacționează cu un număr mare de molecule de monomeri și, prin urmare, cresc rata de conversie a lor în macroradicali în creștere. Cu toate acestea, odată cu creșterea generală a concentrației de radicali, crește și probabilitatea de coliziune între ei, adică terminarea lanțului de polimerizare. Aceasta duce la o scădere a greutății moleculare medii a polimerului.
Într-un mod similar, putem lua în considerare efectul temperaturii asupra cineticii polimerizării radicalice. De obicei, viteza de polimerizare crește de 2-3 ori cu o creștere a temperaturii cu 10°. O creștere a temperaturii crește viteza de inițiere a polimerizării, deoarece facilitează descompunerea inițiatorilor în radicali și reacția acestora cu moleculele de monomeri. Datorită mobilității mai mari a radicalilor mici, odată cu creșterea temperaturii, crește probabilitatea ciocnirii acestora între ei (terminarea lanțului prin disproporționare sau recombinare) sau cu impurități cu greutate moleculară mică (inhibitori). În toate cazurile, greutatea moleculară a polimerului scade, adică gradul mediu de polimerizare scade odată cu creșterea temperaturii. Astfel, numărul de fracții cu molecule scăzute ale polimerului crește în echilibrul general al distribuției macromoleculelor după greutățile lor moleculare, crește proporția reacțiilor secundare care conduc la formarea de molecule ramificate și neregularitatea chimică în construcția polimerului. lanțul apare din cauza unei creșteri a proporției de compuși monomeri de tip „cap-la-cap” și „coadă-coadă”.
Polimerizare
Polimerizare este un proces de producere a compușilor cu molecule înalte în care creșterea unui lanț molecular are loc ca urmare a adăugării secvențiale a moleculelor unei substanțe cu molecule scăzute (monomer) la centrul activ localizat la capătul său:
M i M* + M M i+1 M* etc.
unde M i este un lanț de i legături lungi; M* - centru activ; M - moleculă de monomer
Pe baza numărului de monomeri implicați în polimerizare, aceștia se disting homopolimerizare(un monomer) și copolimerizare(doi sau mai mulți monomeri).
În funcție de natura chimică a centrilor activi implicați în formarea lanțurilor moleculare (radicale sau ionice), există radicalȘi ionic polimerizare.
Polimerizare radicală
Polimerizarea radicală are loc întotdeauna printr-un mecanism în lanț. Funcțiile intermediarilor activi în polimerizarea radicalică sunt îndeplinite de radicalii liberi. Monomerii obișnuiți care suferă polimerizare radicalică includ: etilena, clorură de vinil, acetat de vinil, clorură de viniliden, tetrafluoretilenă, acrilonitril, metacrilonitril, acrilat de metil, metacrilat de metil, stiren, butadienă, cloropren și alți monomeri. Polimerizarea radicală implică de obicei mai multe etape chimice elementare: inițierea, propagarea în lanț, terminarea lanțului și transferul în lanț. Etapele obligatorii sunt inițierea și creșterea în lanț.
Iniţiere. Inițierea constă în crearea de radicali liberi în sistemul de reacție care sunt capabili să declanșeze lanțuri de reacție. Cea mai comună metodă de inițiere a polimerizării se bazează pe descompunerea termică homolitică a substanțelor instabile în mediul monomer - iniţiatori. Diferite tipuri de peroxizi sunt utilizate pe scară largă ca inițiatori: peroxizi de dialchil (di- freacă-butil), hidroperoxizi (hidroperoxid de cumil), peresteri ( freacă-perbenzoat de butil), peroxid de acil (peroxid de benzoil), etc. Peroxizii, de exemplu, se descompun atunci când sunt încălziți conform schemei de polimerizare monomer copolimer stiren
În plus față de peroxizi, compușii azoici sunt utilizați pe scară largă ca inițiatori, dintre care 2,2"-azobisizobutironitril (AIBN) este cel mai utilizat:

Inițiatorii polimerizării radicalice nu sunt de obicei selectivi în raport cu diverși monomeri, astfel încât alegerea inițiatorului este cel mai adesea determinată de temperatura la care rata dorită de generare a radicalilor liberi poate fi atinsă în fiecare caz particular. Astfel, AIBN este utilizat la 50--70 ° C, peroxidul de benzoil la 80--95 ° C și peroxidul freacă-butil la 120--140°C. Energia de activare a inițierii este de obicei apropiată de energia de legătură care se rupe în timpul decăderii inițiatorilor. și variază de la 105 la 175 kJ/mol. Radicalul format în timpul descompunerii moleculei inițiatoare se unește cu dubla legătură a monomerului și începe lanțul de reacție:
R* + CH2 =CHX R--CH2 -CHX*
Sistemele redox pot fi utilizate pentru a iniția polimerizarea radicalică la temperatura camerei sau la temperatură redusă. Reacția de oxidare-reducere se realizează într-un mediu care conține un monomer. Polimerizarea este cauzată de radicalii liberi formați ca intermediari de reacție. Puteți selecta perechi oxidant-reducătoare solubile în apă (peroxid de hidrogen - sulfat feros; persulfat de sodiu - tiosulfat de sodiu etc.) sau în solvenți organici (peroxizi organici - amine; peroxizi organici - săruri organice de fier feros etc.). ). Prin urmare, polimerizarea radicalică poate fi inițiată atât în medii apoase, cât și organice.
Un exemplu tipic de reacție redox într-un mediu apos este interacțiunea peroxidului de hidrogen cu ionii de fier feros:
Fe +2 + H 2 O 2 Fe +3 + OH - + HO*
Radicalul HO, alăturându-se moleculei de monomer, inițiază polimerizarea radicalică.
Un exemplu de reacție redox care inițiază polimerizarea radicalică în medii organice este interacțiunea peroxidului de benzoil cu metilanilina:
Inițiere fotochimică Polimerizarea radicală se bazează pe formarea de radicali liberi ca urmare a clivajului omolitic a legăturilor chimice la absorbția unui cuantum de radiație inițială de către monomer sau fotoinițiatori sau fotosensibilizatori special introduși.
La iniţiere radiaţie-chimică polimerizarea radicalică folosește radiații de înaltă energie (raze, electroni rapizi, particule, neutroni etc.). Energia de activare a inițierii fotochimice și radiații-chimice este aproape de zero. O caracteristică a ultimelor două metode de inițiere este capacitatea de a porni și opri instantaneu radiația de iradiere, ceea ce este important pentru unele lucrări de cercetare.
Creșterea lanțului. Lanțul crește prin adăugarea secvențială de molecule de monomer la radicalii care rezultă din inițiere, de exemplu:
C6H5-C(O)-O-CH2-CHX* + CH2=CHX
C6H5-C(O)-O-CH2-CHX-CH2-CHX*
C6H5-C(O)-O-CH2-CHX-CH2-CHX + CH2=CHX*
C6H5-C(O)-O-CH2-CHX-CH2-CHX-CH2-CH*
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .. .
C6H5-C(O)-O-(CH2-CHX) n-CH2-CHX* + CH2=CHX
C6H5-C(O)-O-(CH2-CHX) n+1-CH2-CHX*, etc.
unde k p este constanta vitezei de creștere a lanțului.
Dezvoltarea unui lanț cinetic este însoțită de formarea unui lanț material. Energiile de activare ale reacțiilor de creștere în lanț se află în intervalul 12-40 kJ/mol.
Constantele vitezei și energia de activare pentru creșterea lanțului depind în primul rând de natura monomerului. Solvenții care nu sunt predispuși la interacțiuni specifice cu moleculele de monomeri și radicalii în creștere nu afectează reacția de creștere a polimerizării radicalice.
Calculul chimic cuantic precis al energiilor de activare pentru adăugarea de radicali la legăturile duble ale monomerilor este dificil în majoritatea cazurilor. Cu toate acestea, utilizarea regulii semiempirice Evans - Polyany - Semenov, conform căreia energia de activare E a este legată de efectul termic al reacției elementare Q prin relația E a = A - Q (unde A și sunt constante valori pentru serii similare), permite. În multe cazuri, estimați E a și preziceți schimbarea acestuia într-o serie de monomeri de același tip.
Energia de activare pentru adăugarea unui monomer la un radical este mai mică, adică cu cât monomerul este mai activ, cu atât energia de conjugare a radicalului este mai mare, care se obține ca urmare a adăugării acestui monomer la radicalul original. . Dimpotrivă, energia de activare pentru adăugarea unui radical la o legătură dublă este mai mică, adică cu cât energia sa de conjugare este mai mică, cu atât este mai mare reactivitatea radicalului. Astfel, reactivitatea din seria de monomeri și radicalii corespunzători acestora se modifică antibatalic. De exemplu, reactivitatea în seria de monomeri vinilici cu substituenți
C6H5, -CH=CH2, -COCH3, -CN, -COOR, CR, -OCOCH3, -OR
scade de la stânga la dreapta. Reactivitatea radicalilor corespunzători scade de la dreapta la stânga. Prin urmare, cu cât reactivitatea monomerului este mai mare, cu atât energia de activare a reacției de creștere în lanț este mai mare, adică, cu atât rata de polimerizare radicalică a acestuia este mai mică.
Scurta considerație calitativă de mai sus nu ia în considerare efectele polare și spațiale, care în unele cazuri au un impact semnificativ asupra energiilor de activare a proceselor radicale. O teorie care consideră reactivitatea monomerilor și a radicalilor doar luând în considerare energiile de conjugare și fără a ține cont de efectele polare și spațiale se numește teoria reactivității radicale ideale.
Circuit deschis. Reacțiile care limitează lanțurile cinetice și de activare se numesc reacții de terminare. Terminarea conduce la dispariția radicalilor activi din sistem sau la înlocuirea acestora cu radicali cu activitate scăzută care nu sunt capabili să atașeze moleculele de monomeri. Terminarea lanțului în timpul polimerizării radicalice are loc în principal atunci când doi radicali în creștere interacționează ca urmare a acestora recombinare:
~CH2-CHX* + ~CH2-CHX* ~CH2-CHX-CHX-CH2 ~
sau disproporționare:
~CH2-CHX* + ~CH2-CHX* ~CH2-CH2X + ~CH=CHX
Reacția de terminare a lanțului include difuzia progresivă a macroradicalilor cu formarea unei bobine unite, abordarea reciprocă a unităților terminale active datorită difuziei segmentare în interiorul bobinei unite și interacțiunea chimică directă a centrelor de reacție cu formarea de macromolecule „moarte”. .
Energia de activare a terminației nu depășește 6 kJ/mol și este determinată în principal de energia de activare a difuziei reciproce a radicalilor.
Terminarea lanțului poate avea loc la orice lungime a macroradicalului în creștere. Prin urmare, în timpul polimerizării, macromoleculele de lungimi diferite (diferite gradul de polimerizare). Aceasta explică natura polimoleculară a polimerilor sintetici, descrisă de corespunzătoare distribuțiile maselor moleculare.
Lanțurile se pot rupe și atunci când interacționează cu radicalii inhibitori. Radicalii liberi stabili cu activitate scăzută pot fi utilizați ca inhibitori, de exemplu radicalii difenilpicrilhidrazil, N-oxid, care ei înșiși nu inițiază polimerizarea, ci se recombină sau se recombină disproporționat cu radicalii în creștere. Inhibitorii pot fi, de asemenea, substanțe ale căror molecule, interacționând cu radicalii activi, își saturează valențele libere și se transformă ele însele în radicali slab activi. Acestea din urmă includ chinone (de exemplu, benzochinonă, durochinonă), compuși di- și trinitro aromatici (dinitrobenzen, trinitrobenzen), oxigen molecular, sulf etc. Inhibitorii pot fi și compuși ai metalelor cu valență variabilă (săruri de fier feric, cupru bivalent). , etc.), care termină lanțurile în creștere din cauza reacțiilor redox. Adesea, inhibitorii sunt introduși în monomer pentru a preveni polimerizarea prematură. Prin urmare, înainte de polimerizare, fiecare monomer trebuie să fie complet purificat de impurități și adăugat inhibitor.
Transmisie cu lanț. Limitarea lanțurilor materiale în timpul polimerizării poate apărea nu numai prin reacții de terminare, ci și ca rezultat al reacțiilor de transfer în lanț, care sunt foarte caracteristice polimerizării radicalice. În timpul transferului în lanț, radicalul în creștere detașează un atom sau un grup de atomi din orice moleculă ( circuitul emițătorului). Ca urmare, radicalul este transformat într-o moleculă saturată de valență și se formează un nou radical, capabil să continue lanțul cinetic. Astfel, în timpul reacțiilor de transfer lanțul material se rupe, dar lanțul cinetic nu.
Transferul de lanț poate avea loc prin molecule de monomeri. De exemplu, în cazul acetatului de vinil
~R* + CH2=CH-OCOCH 3 ~RH + CH 2 =CH-OCOCH 2 *
unde k M este constanta vitezei de transfer al lanțului către monomer.
În acest caz, radicalul în creștere, în loc să se unească la dubla legătură a moleculei de acetat de vinil, poate rupe unul dintre atomii de hidrogen ai grupării acetil, saturând valența sa liberă și transformând molecula de monomer într-un radical activ. Acesta din urmă poate reacționa cu o altă moleculă de monomer, declanșând creșterea unei noi macromolecule:
CH2=CH-OSOSN 2 *+ CH 2 =CH-OSOSN 3 CH 2 =CH-OSOSN 2 -CH 2 -CH*-OSOSN 3
Capacitatea moleculelor de monomer de a participa la reacția de transfer în lanț este de obicei caracterizată constanta de autotransfer Cu M, egal cu raportul dintre constanta vitezei de transfer al lanțului și monomerul. (k M) la constanta vitezei de creștere a lanțului (k P), adică C M = k M /k P. Pentru majoritatea monomerilor vinilici care nu conțin grupări sau atomi mobili, k M< În prezența unui solvent, moleculele de solvent pot juca rolul de transmițător de lanț, de exemplu în cazul toluenului ~CH2-CHX* + C6H5CH3~CH2-CH2X + C6H5CH2* unde k S este constanta vitezei de transmisie în lanț. Interacțiunea unui radical în creștere cu o moleculă transmițătoare de lanț duce la încetarea creșterii acestui lanț material, adică reduce greutatea moleculară a polimerului rezultat. Capacitatea solvenților de a participa la transferul de lanț în timpul polimerizării radicalice a unui monomer dat este caracterizată prin constanta de transfer C S = k S / k P (Tabelul 1). Reacțiile de transfer în lanț sunt utilizate pe scară largă în sinteza polimerilor pentru a controla greutățile moleculare ale acestora. Pentru a reduce greutatea moleculară a polimerului sintetizat, se folosesc de obicei transmițători cu valori C S > 10 -3, care se numesc regulatorii, De exemplu ~CH 2 --CHX + CC1 4 ~CH 2 --CHXCI + CC1 3 * Tabelul 1. Constante de transfer în lanț pentru polimerizarea radicalică a stirenului la 60 °C. Cinetica polimerizării radicalice. Viteza de inițiere în prezența inițiatorilor care se descompun la încălzire în condițiile în care descompunerea are loc printr-un mecanism fără lanț poate fi exprimată prin ecuație V în = k în [I] (1.1) unde [I] este concentrația inițiatorului; k in -- constanta vitezei de inițiere. Rata de creștere a lanțului este exprimată prin ecuație unde k ip este constanta de viteză pentru adăugarea monomerului la radicalul cu gradul de polimerizare n = i; -- concentrarea radicalilor cu grad de polimerizare i; [M] -- concentrația de monomer. La formarea polimerilor cu greutate moleculară mare se poate presupune cu o bună aproximare că k p nu depinde de gradul de polimerizare a radicalului (practic, pornind de la gradul de polimerizare n = 3-4). Atunci expresia pentru v p este simplificată: unde este concentrația tuturor radicalilor în creștere. Rata de dispariție a radicalilor ca rezultat al recombinării și disproporționării este descrisă de ecuație D[R]/dt = k 0 [R] 2 unde k 0 este constanta vitezei de terminare (presupunând că reactivitatea radicalilor în reacțiile de terminare nu depinde de gradul lor de polimerizare). Viteza totală de polimerizare, egală cu rata de dispariție a monomerului în sistem, cu condiția ca gradul de polimerizare a polimerului rezultat să fie suficient de mare și monomerul să fie consumat numai pentru polimerizare, este identică cu rata de creștere a lanțului, adică D[M]/dt v p = k p [R][M] (1,2) Dacă nu există niciun inhibitor în sistem, atunci radicalii activi dispar ca urmare a recombinării sau disproporționării lor. În acest caz, modificarea concentrației de radicali este descrisă de ecuație D[R]/dt = v in - k 0 [R] 2 Concentrația radicalilor [R], care este greu de măsurat prin experimente directe, poate fi eliminată din ecuația (1.2) presupunând că rata de formare a radicalilor este egală cu rata dispariției lor ( stare cvasi-staționară), adică d[R]/dt = 0. În timpul polimerizării radicalice, această condiție este de obicei îndeplinită practic în câteva secunde după începerea reacției. De aceea v în = k 0 [R] 2 [R] = (v în/k 0) 1/2 Și -d[M]/dt = k p (v în / k 0) 1/2 [M] (1,3) Astfel, viteza de polimerizare radicalică este de ordinul întâi în ceea ce privește concentrația monomerului și de ordinul 0,5 în ceea ce privește concentrația de inițiator, care este, de regulă, observată experimental. Gradul de polimerizare. Din datele cinetice se poate calcula gradul de polimerizare P n al polimerului rezultat. Este egal cu raportul dintre numărul de molecule de monomer incluse în lanțurile polimerice în timpul polimerizării și numărul de lanțuri de material formate. Dacă polimerizarea se desfășoară în condiții cvasi-staționare în absența unui inhibitor, atunci la o adâncime de conversie suficient de mică, când există încă puțin polimer în sistem și, prin urmare, rata de transfer al lanțului la polimer și consumul de monomer poate fi neglijat P n = v p / v 0 + v banda (1.4) unde v 0 este viteza de terminare a lanțului bimolecular; v per = (k M [M] + k S [S] x [R] - suma ratelor de transfer al lanțului la monomer și solvent. Când doi radicali se recombină, se formează un lanț material, adică are loc o dublare statistică medie a lui P n, prin urmare, în numitorul ecuației (1.4), înaintea termenului corespunzător terminației prin recombinare, este necesar să se plaseze factorul S . În plus, în ipoteza că fracția de radicali polimeri terminați prin mecanismul de disproporționare este egală, iar fracția de radicali care mor în timpul recombinării este egală cu 1-, ecuația pentru P n ia forma Atunci pentru reciproca lui Р n obținem: Exprimând concentrația radicalului în termeni de viteză de polimerizare v p = k P [R] [M] și folosind constantele C M și C S, se obține în final: Ecuația rezultată leagă gradul mediu numeric de polimerizare de viteza de reacție, constantele de transfer în lanț și concentrațiile de monomer și agent de transfer. Din ecuația (1.5) rezultă că gradul mediu numeric maxim de polimerizare a polimerului rezultat, realizabil la o temperatură dată, în absența altor agenți de transfer, este determinat de reacția de transfer în lanț la monomer, adică P n max C M -1. Ecuațiile derivate mai sus sunt valabile pentru polimerizarea radicalică la grade scăzute de conversie a monomerului în polimer (care nu depășește 10%). La adâncimi mari de conversie, se observă abateri asociate cu o creștere a vâscozității mediului de reacție cu creșterea concentrației de polimer dizolvat în acesta, ceea ce duce la o încetinire a difuziei macroradicalilor și reduce brusc probabilitatea recombinării sau disproporționării acestora. În acest sens, constanta efectivă a vitezei de rupere este redusă semnificativ. Concentrația de radicali în sistem crește, iar rata de polimerizare crește. Acest fenomen se numește efect de gel. Dacă polimerizarea radicalică produce un polimer insolubil sau are o umflare limitată în mediul de reacție, atunci efectele asociate cu inhibarea difuziei a reacției de terminare bimoleculară apar deja începând de la adâncimi foarte mici de transformare. Polimerizare radicală- una dintre cele mai comune metode de sintetizare a polimerilor. Centrul activ al unei astfel de polimerizări a fost un radical liber. Ca orice proces în lanț, polimerizarea radicalică trece prin trei etape principale. 1. Inițierea (formarea centrului activ). În această etapă, molecula de monomer este inițiată cu formarea unui radical liber primar (R"*), care interacționează ușor cu diverși compuși nesaturați (monomeri): În funcție de metoda de formare a radicalilor liberi care încep lanțul de reacție, se disting mai multe tipuri de polimerizare: termice, fotochimice, radiații și inițiate. La polimerizare termică radicalii liberi se formează din monomeri sub influența temperaturilor ridicate (700--1000 ° C). Scindarea rezultată a dublei legături din moleculă duce la apariția unui diradical: care, interacționând cu molecula de monomer formează un diradical mai complex. Acesta, la rândul său, se transformă apoi într-un monomacroradical. Trebuie remarcat, totuși, că polimerizarea termică nu are încă o semnificație practică largă, deoarece viteza sa este relativ scăzută. Polimerizare fotochimică iniţiat de iluminarea moleculelor de monomer. O moleculă de monomer excitată în acest fel interacționează ca urmare a unei coliziuni cu o a doua moleculă pentru a forma un diradical, care apoi se disproporționează în doi monoradicali: Polimerizarea prin radiații apare atunci când monomerii sunt expuși la radiații b-, c-, g- și R. Radicalii liberi rezultați inițiază apoi o reacție de polimerizare. Cu toate acestea, cea mai comună și frecvent utilizată metodă de polimerizare în practică este a iniţiat polimerizarea. Este activat de compuși care se descompun ușor în radicali liberi în condiții de polimerizare. Se numesc astfel de conexiuni iniţiatori polimerizare. Ele conțin în moleculele lor legături chimice instabile (O--O, N--N, S--S, O--N etc.), care sunt rupte la o energie mult mai mică decât este necesară pentru formarea unui radical liber. dintr-o moleculă de monomer (când este activată). Inițiatorii pot fi peroxizii și hidroperoxizii organici, unii compuși azoici și diazoici și alte substanțe: peroxid de benzen hidroperoxid de izopropilbenzen (hiperez) diazohidrat Viteza de descompunere a inițiatorului în radicali liberi poate fi crescută nu numai prin creșterea temperaturii, ci și prin adăugarea de agenți reducători speciali la mediul de reacție - promotoriȘi activatori. Promotorii excită o reacție chimică, acționând doar la începutul procesului, iar activatorii mențin activitatea catalizatorului (inițiatorul) pe tot parcursul procesului. Aceste substanțe favorizează formarea de radicali liberi din inițiatori la temperaturi mai scăzute (inițiere redox). Rolul unor astfel de aditivi poate fi îndeplinit de sărurile altor metale, precum și de pirogalol, amine terțiare, acid ascorbic etc.: Cantitatea de inițiator introdusă este de obicei mică (0,1 - 1%). Viteza totală de polimerizare radicalică crește proporțional cu rădăcina pătrată a concentrației inițiatorului: , unde este concentrația inițiatorului. În același timp, gradul mediu de polimerizare (P) este invers proporțional cu rădăcina pătrată a acestei valori: Astfel, cu o creștere a concentrației inițiatorului, procesul de polimerizare radicalică (inițiat) este accelerat cu o scădere simultană a gradului mediu de polimerizare. 2. Creșterea lanțului. Reacția de creștere în lanț constă în adăugarea repetată a moleculelor de monomer la un radical care devine mai complex de fiecare dată, păstrând în același timp un electron liber la legătura terminală a macromoleculei în creștere. Cu alte cuvinte, lanțul macromolecular în creștere trebuie să rămână un macroradical liber în timpul creșterii sale: Ca rezultat al unor astfel de reacții de adiție secvențială, legătura dublă a monomerului se transformă într-o legătură simplă, care este însoțită de eliberarea de energie datorită diferenței de energii a legăturilor y și p. 3. Întreruperea circuitului. Sfârșitul creșterii lanțului este asociat cu dispariția unui electron liber din ultima verigă a macromoleculei. Cel mai adesea, acest lucru apare ca urmare a combinării a doi radicali unul cu celălalt (reacție de recombinare), ceea ce duce la formarea unui lanț care nu este capabil să crească în continuare: Cu toate acestea, radicalii liberi (macroradicali), fiind exclusiv particule reactive, interacționează nu numai cu monomerii, ci și cu solventul, diverse impurități și cu macromoleculele rezultate. În acest caz, electronul singur (centrul activ) poate merge la orice altă moleculă, de exemplu o moleculă de solvent, care, transformându-se într-un radical, dă naștere unei noi macromolecule: Astfel de reacții se numesc reacții de transfer în lanț. În acest caz, transferul de lanț are loc printr-un solvent - tetraclorura de carbon. Probabilitatea unui astfel de transfer crește odată cu creșterea temperaturii de polimerizare. În acest caz, viteza reacției de polimerizare nu scade, dar deoarece lanțul de reacție aici se descompune în mai multe lanțuri moleculare, gradul de polimerizare a polimerului rezultat este redus considerabil. Prin modificarea raportului dintre monomer și solvent în acest fel, este posibil să se obțină polimeri cu greutăți moleculare diferite. Se numesc substanțele prin care se transferă lanțul și se reglează greutatea moleculară medie a polimerului regulatorii. Ca regulatori se folosesc tetraclorura de carbon, tiolii, acidul tioglicolic etc. Reacțiile de terminare a lanțului și de transfer de lanț sunt adesea folosite în scopuri practice pentru a stabiliza monomerii în timpul depozitării. Acest lucru este necesar pentru a preveni polimerizarea prematură a monomerilor și pentru a controla procesul de polimerizare în ansamblu. Pentru aceasta folosesc adesea inhibitori(stabilizatori), care, atunci când interacționează cu radicalii liberi, formează particule slab active care nu sunt capabile să inițieze în continuare procesul de polimerizare. Dacă este necesar doar reducerea vitezei de polimerizare și nu oprirea completă a procesului, se folosesc substanțe speciale - retardante. Natura acțiunii inhibitorilor și moderatorilor este aproape aceeași, iar diferența dintre ei este mai mult cantitativă decât calitativă. Prin polimerizare radicalică s-au obținut polimeri cunoscuți precum clorură de polivinil, polistiren, cauciucuri stiren-butadienă, metacrilat de polimetil etc.. În funcție de reactivitatea în timpul polimerizării radicalice, unii monomeri pot fi aranjați pe rând: butadienă > stiren > metacrilat de metil > acrilonitril > clorură de vinil![]()
![]()