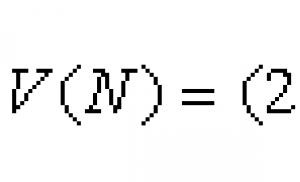Semnul de carbon în chimie. Ce este carbonul? Descrierea, proprietățile și formula carbonului. Greutatea atomică și moleculară a carbonului
Conținutul articolului
CARBON, C (carboneum), un element chimic nemetalic din grupa IVA (C, Si, Ge, Sn, Pb) din Tabelul Periodic al Elementelor. Se găsește în natură sub formă de cristale de diamant (Fig. 1), grafit sau fullerenă și alte forme și face parte din substanțe organice (cărbune, ulei, organisme animale și vegetale etc.) și anorganice (calcar, bicarbonat de sodiu etc.). .).
Carbonul este larg răspândit, dar conținutul său în scoarța terestră este de doar 0,19%.
Carbonul este utilizat pe scară largă sub formă de substanțe simple. Pe lângă diamantele prețioase, care fac obiectul bijuteriilor, diamantele industriale sunt de mare importanță - pentru fabricarea sculelor de șlefuit și tăiere.
Cărbunele și alte forme amorfe de carbon sunt utilizate pentru decolorare, purificare, adsorbție de gaze, în domeniile de tehnologie în care sunt necesari adsorbanți cu suprafață dezvoltată. Carburele, compușii de carbon cu metale, precum și cu bor și siliciu (de exemplu, Al 4 C 3 , SiC, B 4 C) se caracterizează prin duritate ridicată și sunt utilizați la fabricarea sculelor abrazive și tăietoare. Carbonul este prezent în oțeluri și aliaje în stare elementară și sub formă de carburi. Saturarea suprafeței pieselor turnate de oțel cu carbon la temperatură ridicată (cimentare) crește semnificativ duritatea suprafeței și rezistența la uzură. Vezi si ALIAJE.
Există multe forme diferite de grafit în natură; unele sunt obținute artificial; sunt disponibile forme amorfe (ex. cocs și cărbune). Funingine, cărbune de os, negru de lampă, negru de acetilenă se formează atunci când hidrocarburile sunt arse în absența oxigenului. Așa-zisul carbon alb obținute prin sublimarea grafitului pirolitic sub presiune redusă - acestea sunt cele mai mici cristale transparente de frunze de grafit cu margini ascuțite.
Referință istorică.
Grafitul, diamantul și carbonul amorf sunt cunoscute încă din antichitate. Se știe de mult timp că alte materiale pot fi marcate cu grafit, iar chiar numele „grafit”, care provine din cuvântul grecesc care înseamnă „a scrie”, a fost propus de A. Werner în 1789. Cu toate acestea, istoria grafitului este confuz, adesea substanțe cu proprietăți fizice externe similare au fost confundate cu acesta, cum ar fi molibdenitul (sulfura de molibden), considerat la un moment dat grafit. Alte denumiri pentru grafit includ „plumb negru”, „carbură de fier”, „plumb argintiu”. În 1779, K. Scheele a descoperit că grafitul poate fi oxidat cu aer pentru a forma dioxid de carbon.
Pentru prima dată, diamantele și-au găsit utilizare în India, iar în Brazilia, pietrele prețioase au căpătat importanță comercială în 1725; zăcăminte din Africa de Sud au fost descoperite în 1867. În secolul al XX-lea. Principalii producători de diamante sunt Africa de Sud, Zair, Botswana, Namibia, Angola, Sierra Leone, Tanzania și Rusia. Diamantele artificiale, a căror tehnologie a fost creată în 1970, sunt produse în scopuri industriale.
alotropie.
Dacă unitățile structurale ale unei substanțe (atomi pentru elemente monoatomice sau molecule pentru elemente și compuși poliatomici) sunt capabile să se combine între ele în mai multe forme cristaline, acest fenomen se numește alotropie. Carbonul are trei modificări alotrope - diamant, grafit și fullerene. În diamant, fiecare atom de carbon are 4 vecini situati tetraedric, formând o structură cubică (Fig. 1, A). Această structură corespunde covalenței maxime a legăturii și toți cei 4 electroni ai fiecărui atom de carbon formează legături C-C de înaltă rezistență, adică. nu există electroni de conducere în structură. Prin urmare, diamantul se distinge prin lipsa de conductivitate, conductivitate termică scăzută, duritate ridicată; este cea mai dură substanță cunoscută (fig. 2). Ruperea legăturii C–C (lungimea legăturii 1,54 Å, de unde raza covalentă 1,54/2 = 0,77 Å) în structura tetraedrică necesită multă energie, astfel încât diamantul, împreună cu o duritate excepțională, se caracterizează printr-un punct de topire ridicat (3550). °C).
O altă formă alotropică de carbon este grafitul, care este foarte diferit de diamant în proprietăți. Grafitul este o substanță neagră moale din cristale care se exfoliază ușor, caracterizată printr-o bună conductivitate electrică (rezistență electrică 0,0014 Ohm cm). Prin urmare, grafitul este utilizat în lămpi cu arc și cuptoare (Fig. 3), în care este necesar să se creeze temperaturi ridicate. Grafitul de înaltă puritate este utilizat în reactoarele nucleare ca moderator de neutroni. Punctul său de topire la presiune ridicată este de 3527 ° C. La presiune normală, grafitul se sublimează (se transferă de la o stare solidă la un gaz) la 3780 ° C.
Structura din grafit (Fig. 1, b) este un sistem de inele hexagonale topite cu o lungime a legăturii de 1,42 Å (semnificativ mai scurtă decât în diamant), dar fiecare atom de carbon are trei (în loc de patru, ca în diamant) legături covalente cu trei vecini și a patra legătură (3,4). Å) este prea lungă pentru o legătură covalentă și leagă slab straturile paralele stivuite de grafit între ele. Este al patrulea electron de carbon care determină conductivitatea termică și electrică a grafitului - această legătură mai lungă și mai puțin puternică formează grafit mai puțin compact, ceea ce se reflectă în duritatea sa mai mică în comparație cu diamantul (densitatea grafitului este de 2,26 g/cm 3, diamant - 3,51). g/cm3). Din același motiv, grafitul este alunecos la atingere și separă cu ușurință fulgii substanței, care este folosită pentru a face lubrifianți și mine de creion. Lustrul plumbului se datorează în principal prezenței grafitului.
Fibrele de carbon au o rezistență ridicată și pot fi folosite pentru a face fire de raion sau alte fire cu conținut ridicat de carbon.
La presiune și temperatură ridicată, în prezența unui catalizator precum fierul, grafitul poate fi transformat în diamant. Acest proces a fost implementat pentru producția industrială de diamante artificiale. Cristalele de diamant cresc pe suprafața catalizatorului. Echilibrul grafit-diamant există la 15.000 atm și 300 K sau la 4.000 atm și 1.500 K. Diamantele artificiale pot fi obținute și din hidrocarburi.
Formele amorfe de carbon care nu formează cristale includ cărbunele obținut prin încălzirea unui copac fără acces la aer, funinginea de lampă și gaz formată în timpul arderii la temperatură scăzută a hidrocarburilor cu lipsă de aer și condensată pe o suprafață rece, cărbunele de os este un amestec pentru fosfat de calciu în procesul de distrugere a țesăturilor osoase, precum și cărbunele (o substanță naturală cu impurități) și cocs, un reziduu uscat obținut din cocsificarea combustibililor prin distilarea uscată a reziduurilor de cărbune sau petrol (cărbuni bituminoși), adică. incalzire fara aer. Cocsul este folosit pentru topirea fierului, în metalurgia feroasă și neferoasă. În timpul cocsării se formează și produse gazoase - gaz de cocs (H 2 , CH 4 , CO etc.) și produse chimice care sunt materii prime pentru producerea benzinei, vopselelor, îngrășămintelor, medicamentelor, materialelor plastice etc. Schema aparatului principal pentru producerea de cocs - un cuptor de cocs - este prezentată în fig. 3.
Diferite tipuri de cărbune și funingine sunt caracterizate de o suprafață dezvoltată și, prin urmare, sunt utilizate ca adsorbanți pentru purificarea gazelor și lichidelor, precum și ca catalizatori. Pentru a obține diferite forme de carbon, se folosesc metode speciale de tehnologie chimică. Grafitul artificial este obținut prin calcinarea antracitului sau a cocsului de petrol între electrozii de carbon la 2260°C (procesul Acheson) și este utilizat în producția de lubrifianți și electrozi, în special pentru producerea electrolitică a metalelor.
Structura atomului de carbon.
Nucleul celui mai stabil izotop de carbon de masă 12 (abundență de 98,9%) are 6 protoni și 6 neutroni (12 nucleoni) dispuși în trei cvartete, fiecare conținând 2 protoni și doi neutroni, similar unui nucleu de heliu. Un alt izotop stabil de carbon este 13 C (cca. 1,1%), iar un izotop instabil 14 C există în natură în urme, cu un timp de înjumătățire de 5730 de ani, care are b-radiații. Toți cei trei izotopi sub formă de CO 2 participă la ciclul normal al carbonului al materiei vii. După moartea unui organism viu, consumul de carbon se oprește și obiectele care conțin C pot fi datate prin măsurarea nivelului de radioactivitate 14 C. Scăderea b-radiaţia de 14 CO 2 este proporţională cu timpul scurs de la moarte. În 1960, W. Libby a primit Premiul Nobel pentru cercetarea carbonului radioactiv.
În starea fundamentală, 6 electroni de carbon formează o configurație electronică de 1 s 2 2s 2 2px 1 2py 1 2pz 0 . Patru electroni de al doilea nivel sunt valența, care corespunde poziției carbonului în grupul IVA al sistemului periodic ( cm. TABEL PERIODIC AL ELEMENTELOR). Întrucât desprinderea unui electron de un atom în faza gazoasă necesită o energie mare (aproximativ 1070 kJ/mol), carbonul nu formează legături ionice cu alte elemente, deoarece aceasta ar necesita desprinderea unui electron cu formarea unui element pozitiv. ion. Cu o electronegativitate de 2,5, carbonul nu prezintă o afinitate puternică pentru electroni și, prin urmare, nu este un acceptor de electroni activ. Prin urmare, nu este predispus să formeze o particulă cu sarcină negativă. Dar cu o natură parțial ionică a legăturii, există unii compuși de carbon, de exemplu, carburi. În compuși, carbonul prezintă o stare de oxidare de 4. Pentru ca patru electroni să poată participa la formarea legăturilor, este necesară depărtarea lui 2. s-electroni și saltul unuia dintre acești electroni cu 2 pz-orbital; în acest caz, se formează 4 legături tetraedrice cu un unghi între ele de 109°. În compuși, electronii de valență ai carbonului sunt îndepărtați doar parțial de acesta, astfel încât carbonul formează legături covalente puternice între atomii vecini de tip C-C folosind o pereche de electroni comună. Energia de rupere a unei astfel de legături este de 335 kJ/mol, în timp ce pentru legătura Si–Si este de doar 210 kJ/mol; prin urmare, lanțurile lungi –Si–Si– sunt instabile. Natura covalentă a legăturii este păstrată chiar și în compușii de halogeni foarte reactivi cu carbon, CF4 și CCl4. Atomii de carbon sunt capabili să furnizeze mai mult de un electron din fiecare atom de carbon pentru formarea legăturilor; astfel se formează legături duble C=C și triple CºC. Alte elemente formează, de asemenea, legături între atomii lor, dar numai carbonul este capabil să formeze lanțuri lungi. Prin urmare, mii de compuși sunt cunoscuți pentru carbon, numiți hidrocarburi, în care carbonul este legat de hidrogen și alți atomi de carbon, formând catene lungi sau structuri inelare. Cm. CHIMIE ORGANICE.
În acești compuși, este posibilă înlocuirea hidrogenului cu alți atomi, cel mai adesea cu oxigen, azot și halogeni, cu formarea multor compuși organici. Fluorocarburile, hidrocarburi în care hidrogenul este înlocuit cu fluor, ocupă un loc important printre ele. Astfel de compuși sunt extrem de inerți și sunt utilizați ca plastic și lubrifianți (fluorocarburi, adică hidrocarburi în care toți atomii de hidrogen sunt înlocuiți cu atomi de fluor) și ca agenți frigorifici la temperatură joasă (freoni, sau freoni, - fluoroclorhidrocarburi).
În anii 1980, fizicienii americani au descoperit compuși de carbon foarte interesanți în care atomii de carbon sunt legați în 5 sau 6 gooane, formând o moleculă C 60 sub forma unei mingi goale, cu o simetrie perfectă a mingii de fotbal. Întrucât un astfel de design stă la baza „domului geodezic” inventat de arhitectul și inginerul american Buckminster Fuller, noua clasă de compuși a fost numită „buckminsterfullerenes” sau „fullerenes” (și, de asemenea, mai pe scurt, „fasiballs” sau „buckyballs”). Fulerenele - a treia modificare a carbonului pur (cu excepția diamantului și grafitului), constând din 60 sau 70 (și chiar mai mulți) atomi - a fost obținută prin acțiunea radiației laser asupra celor mai mici particule de carbon. Fulerenele de o formă mai complexă constau din câteva sute de atomi de carbon. Diametrul moleculei C60 este de ~ 1 nm. Există suficient spațiu în centrul unei astfel de molecule pentru a găzdui un atom mare de uraniu.
masa atomică standard.
În 1961, Uniunile Internaționale de Chimie Pură și Aplicată (IUPAC) și în fizică au adoptat masa izotopului de carbon 12 C ca unitate de masă atomică, eliminând scara de oxigen existentă anterior a maselor atomice. Masa atomică a carbonului în acest sistem este de 12.011, deoarece este media pentru cei trei izotopi naturali de carbon, ținând cont de abundența lor în natură. Cm. MASĂ ATOMICĂ.
Proprietățile chimice ale carbonului și ale unora dintre compușii săi.
Unele proprietăți fizice și chimice ale carbonului sunt prezentate în articolul ELEMENTE CHIMICE. Reactivitatea carbonului depinde de modificarea, temperatura și dispersia acestuia. La temperaturi scăzute, toate formele de carbon sunt destul de inerte, dar atunci când sunt încălzite, sunt oxidate de oxigenul atmosferic, formând oxizi:
Carbonul fin dispersat în exces de oxigen este capabil să explodeze atunci când este încălzit sau de la o scânteie. Pe lângă oxidarea directă, există metode mai moderne de obținere a oxizilor.
suboxid de carbon
C 3 O 2 se formează în timpul deshidratării acidului malonic peste P 4 O 10:
C 3 O 2 are un miros neplăcut, se hidrolizează ușor, reformând acidul malonic.
Monoxid de carbon (II) CO se formează în timpul oxidării oricărei modificări a carbonului în absența oxigenului. Reacția este exotermă, se eliberează 111,6 kJ/mol. Cocsul la căldură albă reacţionează cu apa: C + H 2 O = CO + H 2; amestecul de gaz rezultat se numește „gaz de apă” și este un combustibil gazos. De asemenea, CO se formează în timpul arderii incomplete a produselor petroliere, se găsește în cantități semnificative în gazele de eșapament ale automobilelor și se obține prin disocierea termică a acidului formic:
Starea de oxidare a carbonului în CO este +2 și, deoarece carbonul este mai stabil în starea de oxidare +4, CO este ușor oxidat de oxigen la CO 2: CO + O 2 → CO 2, această reacție este extrem de exotermă (283 kJ / mol). CO este utilizat în industrie în amestec cu H 2 și alte gaze combustibile ca combustibil sau agent reducător gazos. Când este încălzit la 500 ° C, CO formează C și CO 2 într-o măsură vizibilă, dar la 1000 ° C, echilibrul este stabilit la concentrații scăzute de CO 2. CO reacționează cu clorul, formând fosgen - COCl 2, reacțiile cu alți halogeni decurg similar, în reacția cu sulful se obține sulfură de carbonil COS, cu metale (M) CO formează carbonili de diverse compoziții M (CO) X, care sunt compuși complecși. Carbonilul de fier se formează prin interacțiunea hemoglobinei din sânge cu CO, prevenind reacția hemoglobinei cu oxigenul, deoarece carbonilul de fier este un compus mai puternic. Ca urmare, funcția hemoglobinei ca purtător de oxigen către celule este blocată, care apoi mor (și în primul rând, celulele creierului sunt afectate). (De aici un alt nume pentru CO - „monoxid de carbon”). Deja 1% (vol.) CO în aer este periculos pentru o persoană dacă se află într-o astfel de atmosferă mai mult de 10 minute. Unele proprietăți fizice ale CO sunt prezentate în tabel.
Dioxid de carbon sau monoxid de carbon (IV) CO 2 se formează în timpul arderii carbonului elementar în exces de oxigen cu degajare de căldură (395 kJ/mol). CO 2 (numele trivial este „dioxid de carbon”) se formează și în timpul oxidării complete a CO, a produselor petroliere, a benzinei, a uleiurilor și a altor compuși organici. Când carbonații sunt dizolvați în apă, CO 2 este, de asemenea, eliberat ca rezultat al hidrolizei:
Această reacție este adesea folosită în practica de laborator pentru a obține CO 2 . Acest gaz poate fi obținut și prin calcinarea bicarbonaților metalici:
în interacțiunea fază gazoasă a aburului supraîncălzit cu CO:
la arderea hidrocarburilor și a derivaților lor de oxigen, de exemplu:
În mod similar, produsele alimentare sunt oxidate într-un organism viu cu eliberarea de energie termică și de alte tipuri. În acest caz, oxidarea are loc în condiții blânde prin etape intermediare, dar produsele finale sunt aceleași - CO 2 și H 2 O, ca, de exemplu, în timpul descompunerii zaharurilor sub acțiunea enzimelor, în special în timpul fermentației. de glucoză:
Producția cu tonaj mare de dioxid de carbon și oxizi metalici se realizează în industrie prin descompunerea termică a carbonaților:
CaO este utilizat în cantități mari în tehnologia de producție a cimentului. Stabilitatea termică a carbonaților și consumul de căldură pentru descompunerea lor conform acestei scheme cresc în seria CaCO 3 ( Vezi si PREVENIREA INCENDIILOR ȘI PROTECȚIA INCENDIILOR).
Structura electronică a oxizilor de carbon.
Structura electronică a oricărui monoxid de carbon poate fi descrisă prin trei scheme echiprobabile cu diferite aranjamente de perechi de electroni - trei forme rezonante:
Toți oxizii de carbon au o structură liniară.
Acid carbonic.
Când CO2 interacționează cu apa, se formează acid carbonic H2CO3. Într-o soluție saturată de CO2 (0,034 mol/l), doar o parte din molecule formează H2CO3, iar cea mai mare parte a CO2 este în stare hidratată de CO2CHH2O.
Carbonați.
Carbonații se formează prin interacțiunea oxizilor metalici cu CO 2, de exemplu, Na 2 O + CO 2 Na 2 CO 3.
Cu excepția carbonaților de metale alcaline, restul sunt practic insolubili în apă, iar carbonatul de calciu este parțial solubil în acid carbonic sau soluție de CO 2 în apă sub presiune:
Aceste procese au loc în apele subterane care curg prin stratul de calcar. În condiţii de joasă presiune şi evaporare, CaCO3 precipită din apele subterane care conţin Ca(HCO3)2. Așa cresc stalactitele și stalagmitele în peșteri. Culoarea acestor formațiuni geologice interesante se explică prin prezența impurităților de ioni de fier, cupru, mangan și crom în ape. Dioxidul de carbon reacționează cu hidroxizii metalici și soluțiile acestora pentru a forma hidrocarbonați, de exemplu:
CS2 + 2Cl2® CCl4 + 2S
Tetraclorura CCl 4 este o substanță neinflamabilă, folosită ca solvent în procesele de curățare chimică, dar nu este recomandată utilizarea ca ignifug, deoarece la temperatură ridicată formează fosgen toxic (o substanță gazoasă otrăvitoare). CCl 4 în sine este, de asemenea, otrăvitor și, dacă este inhalat în cantități apreciabile, poate provoca intoxicații hepatice. CCl4 se formează de asemenea printr-o reacție fotochimică între metan CH4 și CI2; în acest caz, este posibilă formarea de produse de clorurare incompletă a metanului - CHCl 3 , CH 2 Cl 2 și CH 3 Cl. Reacțiile se desfășoară în mod similar cu alți halogeni.
reacții cu grafit.
Grafitul ca o modificare a carbonului, caracterizat prin distanțe mari între straturile de inele hexagonale, intră în reacții neobișnuite, de exemplu, metalele alcaline, halogenii și unele săruri (FeCl 3) pătrund între straturi, formând compuși ai KC 8, KC 16 de tip (numit interstițial, incluziune sau clatrați). Agenții oxidanți puternici precum KClO 3 într-un mediu acid (acid sulfuric sau azotic) formează substanțe cu un volum mare al rețelei cristaline (până la 6 Å între straturi), ceea ce se explică prin introducerea atomilor de oxigen și formarea de compuși, pe a căror suprafață, ca urmare a oxidării, grupări carboxil (–COOH ) - compuși precum grafitul oxidat sau acidul melitic (benzenhexacarboxilic) C 6 (COOH) 6. În acești compuși, raportul C:O poate varia de la 6:1 la 6:2,5.
Carburi.
Carbonul formează cu metale, bor și siliciu diverși compuși numiți carburi. Cele mai active metale (subgrupe IA-IIIA) formează carburi asemănătoare sărurilor, de exemplu, Na2C2, CaC2, Mg4C3, Al4C3. În industrie, carbura de calciu este obținută din cocs și calcar prin următoarele reacții:
Carburele sunt neconductoare, aproape incolore, se hidrolizează pentru a forma hidrocarburi, de exemplu
CaC 2 + 2H 2 O \u003d C 2 H 2 + Ca (OH) 2
Acetilena C2H2 formată prin reacție servește ca materie primă în producerea multor substanțe organice. Acest proces este interesant deoarece reprezintă trecerea de la materii prime de natură anorganică la sinteza compușilor organici. Carburele care formează acetilenă la hidroliză se numesc acetilide. În siliciul și carburile de bor (SiC și B 4 C), legătura dintre atomi este covalentă. Metalele de tranziție (elementele subgrupului B) când sunt încălzite cu carbon formează și carburi cu compoziție variabilă în fisurile de pe suprafața metalului; legătura dintre ele este aproape de metal. Unele carburi de acest tip, cum ar fi WC, W2C, TiC și SiC, se caracterizează prin duritate și refractaritate ridicate și au o conductivitate electrică bună. De exemplu, NbC, TaC și HfC sunt cele mai refractare substanțe (p.t. = 4000–4200 ° C), carbura de diniobiu Nb 2 C este un supraconductor la 9,18 K, TiC și W 2 C sunt aproape ca duritate de diamant, iar duritatea B 4 C (analog structural al diamantului) este 9,5 pe scara Mohs ( cm. orez. 2). Se formează carburi inerte dacă raza metalului de tranziție
Derivați de azot ai carbonului.
Această grupă include ureea NH 2 CONH 2 - un îngrășământ cu azot utilizat sub formă de soluție. Ureea se obține din NH3 și CO2 când este încălzită sub presiune:
Cianogenul (CN) 2 este similar în multe proprietăți cu halogenii și este adesea denumit pseudohalogen. Cianura se obtine prin oxidarea usoara a ionului de cianura cu oxigen, peroxid de hidrogen sau ion Cu 2+: 2CN - ® (CN) 2 + 2e.
Ionul de cianură, fiind un donor de electroni, formează cu ușurință compuși complecși cu ioni de metale de tranziție. La fel ca CO, ionul de cianură este o otravă, care leagă compuși vitali ai fierului într-un organism viu. Ionii complexi de cianuri au formula generală -0,5 X, Unde X este numărul de coordonare al metalului (agent de complexare), empiric egal cu dublul valorii stării de oxidare a ionului metalic. Exemple de astfel de ioni complecși sunt (structura unor ioni este prezentată mai jos) tetraciano-nichelat (II) -ion 2–, hexacianoferrat (III) 3–, dicianoargentat -:
Carbonili.
Monoxidul de carbon este capabil să reacționeze direct cu multe metale sau ioni metalici, formând compuși complecși numiți carbonili, cum ar fi Ni(CO)4, Fe(CO)5, Fe2(CO)9,3, Mo(CO)6,2 . Legătura din acești compuși este similară cu legătura din complecșii ciano descriși mai sus. Ni(CO)4 este o substanță volatilă folosită pentru a separa nichelul de alte metale. Deteriorarea structurii fontei și oțelului în structuri este adesea asociată cu formarea carbonililor. Hidrogenul poate face parte din carbonili, formând hidruri de carbonil, cum ar fi H2Fe (CO)4 și HCo (CO)4, care prezintă proprietăți acide și reacţionează cu alcalii:
H2Fe(CO)4 + NaOH → NaHFe(CO)4 + H2O
Halogenurile de carbonil sunt de asemenea cunoscute, de exemplu Fe (CO) X 2 , Fe (CO ) 2 X 2 , Co (CO ) I 2 , Pt (CO) CI 2 , unde X este orice halogen.
Hidrocarburi.
Se cunosc un număr mare de compuși ai carbonului cu hidrogen
CARBON, C (a. carbon; n. Kohlenstoff; f. carbone; și. carbono), este un element chimic din grupa IV a sistemului periodic al lui Mendeleev, număr atomic 6, masă atomică 12,041. Carbonul natural este format dintr-un amestec de 2 izotopi stabili: 12 C (98,892%) și 13 C (1,108%). Există, de asemenea, 6 izotopi radioactivi ai carbonului, dintre care cel mai important este izotopul 14 C cu un timp de înjumătățire de 5,73,10 3 ani (acest izotop se formează constant în cantități mici în atmosfera superioară ca urmare a iradierii de 14 ani). N nuclee cu neutroni de radiație cosmică).
Carbonul este cunoscut din cele mai vechi timpuri. Lemnul a fost folosit pentru a recupera metalele din minereuri, iar diamantul a fost folosit ca. Recunoașterea carbonului ca element chimic este asociată cu numele chimistului francez A. Lavoisier (1789).
Modificări și proprietăți ale carbonului
Sunt cunoscute 4 modificări cristaline ale carbonului: grafit, diamant, carbyne și lonsdaleit, care diferă foarte mult în proprietățile lor. Carbyne este o varietate de carbon obținută artificial, care este o pulbere neagră fin cristalină, a cărei structură cristalină se caracterizează prin prezența lanțurilor lungi de atomi de carbon dispuși paralel unul cu celălalt. Densitate 3230-3300 kg/m 3, capacitate termică 11,52 J/mol.K. Lonsdaleitul se găsește în meteoriți și se obține artificial; structura și proprietățile sale fizice nu au fost stabilite în final. Carbonul se caracterizează și printr-o stare cu o structură dezordonată - așa-numita. carbon amorf (funingine, cocs, cărbune). Proprietățile fizice ale carbonului „amorf” depind în mare măsură de finețea particulelor și de prezența impurităților.
Proprietățile chimice ale carbonului
În compuși, carbonul are stări de oxidare +4 (cele mai frecvente), +2 și +3. În condiții normale, carbonul este inert din punct de vedere chimic; la temperaturi ridicate, se combină cu multe elemente, prezentând proprietăți reducătoare puternice. Activitatea chimică a carbonului scade în seria „amorf” carbon, grafit, diamant; interacțiunea cu oxigenul atmosferic în aceste tipuri de carbon are loc, respectiv, la temperaturi de 300-500°C, 600-700°C și 850-1000°C cu formarea de dioxid de carbon (CO 2) și monoxid (CO) de carbon. Dioxidul se dizolvă în apă pentru a forma acid carbonic. Toate formele de carbon sunt rezistente la alcalii și acizi. Carbonul practic nu interacționează cu halogenii (cu excepția grafitului, care reacționează cu F2 peste 900 ° C), prin urmare halogenurile sale sunt obținute indirect. Dintre compușii care conțin azot, cianura de hidrogen HCN (acidul cianhidric) și numeroșii săi derivați sunt de mare importanță practică. La temperaturi peste 1000°C, carbonul interacționează cu multe metale, formând carburi. Toate formele de carbon sunt insolubile în solvenți anorganici și organici obișnuiți.
Cea mai importantă proprietate a carbonului este capacitatea atomilor săi de a forma legături chimice puternice între ei, precum și între ei și alte elemente. Capacitatea carbonului de a forma 4 legături de valență echivalente cu alți atomi de carbon vă permite să construiți diferite tipuri de schelete de carbon (liniare, ramificate, ciclice); Tocmai aceste proprietăți explică rolul excepțional al carbonului în structura tuturor compușilor organici și, în special, a tuturor organismelor vii.
carbon în natură
Conținutul mediu de carbon din scoarța terestră este de 2,3,10% (în masă); în acest caz, cea mai mare parte a carbonului este concentrată în rocile sedimentare (1%), în timp ce în alte roci există concentrații semnificativ mai mici și aproximativ aceleași (1-3,10%) ale acestui element. Carbonul se acumulează în partea superioară, unde prezența lui este asociată în principal cu materia vie (18%), lemnul (50%), cărbunele (80%), petrolul (85%), antracitul (96%), precum și cu dolomite și calcare. Sunt cunoscute peste 100 de minerale de carbon, dintre care cele mai comune sunt carbonații de calciu, magneziu și fier (calcit CaCO 3 , dolomit (Ca, Mg) CO 3 și siderit FeCO 3 ). Acumularea de carbon în scoarța terestră este adesea asociată cu acumularea altor elemente absorbite de materia organică și depuse după îngroparea acesteia pe fundul corpurilor de apă sub formă de compuși insolubili. Cantități mari de dioxid de CO 2 sunt emise în atmosferă de pe Pământ în timpul activității vulcanice și în timpul arderii combustibililor fosili. Din atmosferă, CO 2 este preluat de plante în timpul fotosintezei și dizolvat în apa de mare, formând astfel cele mai importante legături în ciclul general al carbonului de pe Pământ. Carbonul joacă, de asemenea, un rol important în spațiu; pe Soare, carbonul ocupă locul 4 în abundență după hidrogen, heliu și oxigen, participând la procesele nucleare.
Aplicare și utilizare
Cea mai importantă semnificație economică națională a carbonului este determinată de faptul că aproximativ 90% din toate sursele de energie primară consumate de oameni sunt combustibili fosili. Există tendința de a folosi uleiul nu ca combustibil, ci ca materie primă pentru diverse industrii chimice. Un rol mai mic, dar totuși foarte semnificativ în economia națională îl joacă carbonul extras sub formă de carbonați (metalurgie, construcții, industrii chimice), diamante (bijuterii, tehnologie) și grafit (tehnologie nucleară, creuzete rezistente la căldură, creioane, anumite tipuri de lubrifianți etc.). În funcție de activitatea specifică a izotopului 14 C în resturile de origine biogenă, se determină vârsta acestora (metoda de datare cu radiocarbon). 14 C este utilizat pe scară largă ca trasor radioactiv. Cel mai comun izotop 12 C este de mare importanță - o doisprezece parte din masa unui atom al acestui izotop este luată ca unitate de masă atomică a elementelor chimice.
Carbon
CARBON-A; m. Elementul chimic (C), cel mai important constituent al tuturor substanțelor organice din natură. atomi de carbon. Procentul de conținut de carbon. Viața este imposibilă fără carbon.
◁ Carbon, th, th. Atomii Y. Carbonacee, th, th. conţinând carbon. Wow oțel.
carbon(lat. Carboneum), un element chimic din grupa IV a sistemului periodic. Principalele modificări cristaline sunt diamantul și grafitul. În condiții obișnuite, carbonul este inert chimic; se combină cu multe elemente la temperaturi ridicate (agent reducător puternic). Conținutul de carbon din scoarța terestră este de 6,5 10 16 t. 11 t) și hidrosferă (10 14 t). Principalele minerale purtătoare de carbon sunt carbonații. Carbonul are capacitatea unică de a forma un număr mare de compuși care pot fi compusi dintr-un număr practic nelimitat de atomi de carbon. Varietatea compușilor de carbon a determinat apariția uneia dintre principalele ramuri ale chimiei - chimia organică. Carbonul este un element biogen; compușii săi joacă un rol deosebit în viața organismelor vegetale și animale (conținutul mediu de carbon este de 18%). Carbonul este distribuit pe scară largă în spațiu; pe Soare, ocupă locul 4 după hidrogen, heliu și oxigen.
CARBONCARBON (lat. Carboneum, din carbo - cărbune), C (a se citi „ce”), un element chimic cu număr atomic 6, masă atomică 12.011. Carbonul natural este format din doi nuclizi stabili: 12 C, 98,892% din greutate, și 13 C, 1,108%. Într-un amestec natural de nuclizi, nuclidul radioactiv 14 C este întotdeauna prezent în urme (b - emițător, timp de înjumătățire 5730 ani). Se formează constant în straturile inferioare ale atmosferei sub acțiunea neutronilor radiațiilor cosmice asupra izotopului de azot 14 N:
14 7 N + 1 0 n = 14 6 C + 1 1 H.
Carbonul este situat în grupa IVA, în a doua perioadă a sistemului periodic. Configurația stratului exterior de electroni al unui atom în starea fundamentală 2 s 2
p 2
. Cele mai importante stări de oxidare sunt +2 +4, -4, valențele IV și II.
Raza atomului de carbon neutru este de 0,077 nm. Raza ionului C 4+ este de 0,029 nm (numărul de coordonare 4), 0,030 nm (numărul de coordonare 6). Energiile succesive de ionizare ale unui atom neutru sunt 11,260, 24,382, 47,883, 64,492 și 392,09 eV. Electronegativitatea după Pauling (cm. PAULING Linus) 2,5.
Referință istorică
Carbonul este cunoscut din cele mai vechi timpuri. Cărbunele a fost folosit pentru a recupera metale din minereuri, diamante (cm. DIAMANT (mineral))- ca o bijuterie. În 1789 chimistul francez A. L. Lavoisier (cm. Lavoisier Antoine Laurent) a făcut o concluzie despre natura elementară a carbonului.
Diamantele artificiale au fost obținute pentru prima dată în 1953 de către cercetătorii suedezi, dar aceștia nu au avut timp să publice rezultatele. În decembrie 1954 s-au obținut diamante artificiale, iar la începutul anului 1955 rezultatele au fost publicate de angajații Companiei General Electric. (cm. GENERAL ELECTRIC)
În URSS, diamantele artificiale au fost obținute pentru prima dată în 1960 de un grup de oameni de știință condus de V. N. Bakul și L. F. Vereshchagin (cm. Vereșchagin Leonid Fedorovich) .
În 1961, un grup de chimiști sovietici condus de VV Korshak a sintetizat o modificare liniară a carbonului, carabina. La scurt timp, carabina a fost descoperită în craterul de meteorit Rees (Germania). În 1969, mustații de diamant au fost sintetizate în URSS sub presiune obișnuită, care au o rezistență ridicată și sunt practic lipsite de defecte.
În 1985 G. Kroto (cm. KROTO Harold) a descoperit o nouă formă de carbon - fulerenele (cm. FULLERENES) C 60 și C 70 în spectrul de masă al grafitului s-au evaporat în timpul iradierii cu laser. Lonsdaleitul a fost obținut la presiuni mari.
Fiind în natură
Conținutul din scoarța terestră este de 0,48% din greutate. Se acumulează în biosferă: în materie vie 18% cărbune, în lemn 50%, turbă 62%, gaze naturale combustibile 75%, șisturi bituminoase 78%, cărbune tare și brun 80%, petrol 85%, antracit 96%. O parte semnificativă a cărbunelui din litosferă este concentrată în calcare și dolomite. Carbonul în starea de oxidare +4 este o parte a rocilor carbonatice și a mineralelor (cretă, calcar, marmură, dolomite). Dioxidul de carbon CO 2 (0,046% din masă) este o componentă constantă a aerului atmosferic. Dioxidul de carbon în formă dizolvată este întotdeauna prezent în apa râurilor, lacurilor și mărilor.
Substanțe care conțin carbon au fost găsite în atmosfera stelelor, planetelor și în meteoriți.
Chitanță
Din cele mai vechi timpuri, cărbunele a fost obținut prin arderea incompletă a lemnului. În secolul al XIX-lea, cărbunele în metalurgie a fost înlocuit cu cărbune (cocs).
În prezent, cracarea este utilizată pentru producția industrială de carbon pur. (cm. CRACARE) metan de gaz natural (cm. METAN) CH 4:
CH 4 \u003d C + 2H 2
Cărbunele în scopuri medicale este preparat prin arderea cojilor de nuci de cocos. Pentru nevoile de laborator, cărbunele pur, care nu conține impurități incombustibile, se obține prin arderea incompletă a zahărului.
Proprietati fizice si chimice
Carbonul este un nemetal.
Varietatea compușilor de carbon se explică prin capacitatea atomilor săi de a se lega între ei, formând structuri tridimensionale, straturi, lanțuri, cicluri. Sunt cunoscute patru modificări alotropice ale carbonului: diamant, grafit, carbyne și fullerit. Cărbunele este format din cristale minuscule cu o structură dezordonată de grafit. Densitatea sa este de 1,8-2,1 g/cm3. Funinginea este grafit puternic sub formă de pulbere.
Diamantul este un mineral cu o rețea cubică centrată pe față. Atomii de C din diamant sunt în sp 3
-stare hibridizată. Fiecare atom formează 4 legături covalente S cu patru atomi de C vecini aflați de-a lungul vârfurilor tetraedrului, în centrul cărora se află atomul C. Distanțele dintre atomi din tetraedru sunt de 0,154 nm. Nu există conductivitate electronică, banda interzisă este de 5,7 eV. Dintre toate substanțele simple, diamantul are numărul maxim de atomi pe unitatea de volum. Densitatea sa este de 3,51 g/cm3. Duritatea Mohs (cm. SCALA MOHS) luat ca 10. Un diamant poate fi zgâriat doar cu un alt diamant; dar este casant și se rupe în bucăți de formă neregulată la impact. Stabil termodinamic numai la presiuni mari. Cu toate acestea, la 1800°C, transformarea diamantului în grafit este rapidă. Transformarea inversă a grafitului în diamant are loc la 2700°C și o presiune de 11-12 GPa.
Grafitul este o substanță stratificată de culoare gri închis, cu o rețea cristalină hexagonală. Stabil termodinamic într-o gamă largă de temperaturi și presiuni. Este alcătuit din straturi paralele formate din hexagoane regulate de atomi C. Atomii de carbon ai fiecărui strat sunt situați vizavi de centrele hexagoanelor situate în straturi adiacente; poziția straturilor se repetă printr-unul, iar fiecare strat este deplasat față de celălalt pe direcția orizontală cu 0,1418 nm. În interiorul stratului, legăturile dintre atomi sunt covalente, formate sp 2
orbitali hibrizi. Legăturile dintre straturi sunt realizate de slab van der Waals (cm. INTERACȚIUNEA INTERMOLECULARĂ) forțe, astfel încât grafitul este ușor stratificat. Această stare este stabilizată de a patra legătură p delocalizată. Grafitul are o conductivitate electrică bună. Densitatea grafitului este de 2,1-2,5 kg / dm 3.
În toate modificările alotropice, în condiții normale, carbonul este inactiv din punct de vedere chimic. Intră în reacții chimice numai atunci când este încălzit. În acest caz, activitatea chimică a carbonului scade în seria funingine-cărbune-grafit-diamant. Funinginea din aer se aprinde când este încălzită la 300°C, diamant - la 850-1000°C. În timpul arderii se formează dioxid de carbon CO 2 și CO. Prin încălzirea CO 2 cu cărbune se obține și monoxid de carbon (II) CO:
CO 2 + C \u003d 2CO
C + H 2 O (abur supraîncălzit) \u003d CO + H 2
Monoxid de carbon sintetizat C 2 O 3 .
CO 2 este un oxid acid, el corespunde unui acid carbonic slab instabil H 2 CO 3 care există numai în soluții apoase reci foarte diluate. Săruri ale acidului carbonic - carbonați (cm. CARBONATE)(K2C03, CaC03) şi bicarbonaţi (cm. HIDROCARBONAȚI)(NaHC03, Ca(HC03)2).
Cu hidrogen (cm. HIDROGEN) grafitul și cărbunele reacționează la temperaturi peste 1200°C, formând un amestec de hidrocarburi. Reacționând cu fluorul la 900°C, formează un amestec de compuși fluorocarbonici. Prin trecerea unei descărcări electrice între electrozii de carbon într-o atmosferă de azot se obține gaz cianogen (CN) 2; dacă hidrogenul este prezent în amestecul de gaze, se formează acidul cianhidric HCN. La temperaturi foarte ridicate, grafitul reacţionează cu sulful, (cm. SULF) siliciu, bor, care formează carburi - CS 2, SiC, B 4 C.
Carburele se obțin prin interacțiunea grafitului cu metalele la temperaturi ridicate: carbură de sodiu Na 2 C 2, carbură de calciu CaC 2, carbură de magneziu Mg 2 C 3, carbură de aluminiu Al 4 C 3. Aceste carburi sunt ușor descompuse de apă în hidroxid metalic și hidrocarbura corespunzătoare:
Al 4 C 3 + 12H 2 O \u003d 4Al (OH) 3 + 3CH 4
Cu metalele de tranziție, carbonul formează carburi rezistente chimic asemănătoare metalelor, de exemplu, carbură de fier (cementită) Fe 3 C, carbură de crom Cr 2 C 3, carbură de tungsten WC. Carburele sunt substanțe cristaline, natura legăturii chimice poate fi diferită.
Când este încălzit, cărbunele reduce multe metale din oxizii lor:
FeO + C = Fe + CO
2CuO+ C = 2Cu+ CO 2
Când este încălzit, reduce sulful (VI) în sulf (IV) din acid sulfuric concentrat:
2H 2 SO 4 + C \u003d CO 2 + 2SO 2 + 2H 2 O
La 3500°C și presiune normală, carbonul se sublimează.
Aplicație
Peste 90% din toate sursele primare de energie consumate în lume provin din combustibili fosili. 10% din combustibilul extras este folosit ca materie primă pentru principalele sinteze organice și petrochimice, pentru producția de materiale plastice.
Acțiune fiziologică
Carbonul este cel mai important element biogen; este o unitate structurală de compuși organici implicați în construcția organismelor și care asigură activitatea lor vitală (biopolimeri, vitamine, hormoni, mediatori și altele). Conținutul de carbon din organismele vii pe bază de substanță uscată este de 34,5-40% pentru plante și animale acvatice, 45,4-46,5% pentru plante și animale terestre și 54% pentru bacterii. În procesul activității vitale a organismelor, are loc descompunerea oxidativă a compușilor organici cu eliberarea de CO 2 în mediul extern. Dioxid de carbon (cm. DIOXID DE CARBON), dizolvată în fluide biologice și ape naturale, este implicată în menținerea acidității mediului care este optimă pentru viață. Ca parte a CaCO 3, carbonul formează scheletul exterior al multor nevertebrate, se găsește în corali, coji de ouă.
În timpul diferitelor procese de producție, particulele de cărbune, funingine, grafit, diamant intră în atmosferă și se află în ea sub formă de aerosoli. MPC pentru praful de carbon în zonele de lucru 4,0 mg/m 3 , pentru cărbune 10 mg/m 3 .
Dicţionar enciclopedic. 2009 .
Sinonime:Vedeți ce înseamnă „carbon” în alte dicționare:
Tabelul nuclizilor Informații generale Nume, simbol Carbon 14, 14C Denumiri alternative radiocarbon, radiocarbon Neutroni 8 Protoni 6 Proprietăți ale nuclizilor Masa atomică ... Wikipedia
Tabelul nuclizilor Informații generale Nume, simbol Carbon 12, 12C Neutroni 6 Protoni 6 Proprietățile nuclizilor Masa atomică 12.0000000 (0) ... Wikipedia
Tabelul nuclizilor Informații generale Nume, simbol Carbon 13, 13C Neutroni 7 Protoni 6 Proprietățile nuclizilor Masa atomică 13.0033548378 (10) ... Wikipedia
- (lat. Carboneum) C, chimic. element din grupa IV a sistemului periodic al lui Mendeleev, număr atomic 6, masă atomică 12.011. Principalele modificări cristaline sunt diamantul și grafitul. În condiții obișnuite, carbonul este inert chimic; la mare ...... Dicţionar enciclopedic mare
- (Carboneum), C, element chimic din grupa IV a sistemului periodic, număr atomic 6, masă atomică 12,011; metaloid. Conținutul din scoarța terestră este de 2,3 × 10 2% din masă. Principalele forme cristaline ale carbonului sunt diamantul și grafitul. Carbonul este componenta principală ...... Enciclopedia modernă
Carbon- (Carboneum), C, element chimic din grupa IV a sistemului periodic, număr atomic 6, masă atomică 12,011; metaloid. Conținutul din scoarța terestră este de 2,3×10 2% din greutate. Principalele forme cristaline ale carbonului sunt diamantul și grafitul. Carbonul este componenta principală ...... Dicţionar Enciclopedic Ilustrat
CARBON- (1) chimic. element, simbol C (lat. Carboneum), la. Și. 6, la. m. 12.011. Există sub mai multe modificări (forme) alotropice (diamant, grafit și mai rar carabină, haoit și lonsdaleit în cratere de meteoriți). Din 1961 / masa unui atom al izotopului 12C a fost acceptată... Marea Enciclopedie Politehnică
- (simbol C), un element nemetalic larg răspândit din grupa a patra a tabelului periodic. Carbonul formează un număr mare de compuși, care, împreună cu hidrocarburile și alte substanțe nemetalice, formează baza ... ... Dicționar enciclopedic științific și tehnic
Carbonul din tabelul periodic al elementelor este situat în a doua perioadă în grupa IVA. Configurația electronică a atomului de carbon ls 2 2s 2 2p 2 . Când este excitat, se realizează cu ușurință o stare electronică în care există patru electroni nepereche în cei patru orbitali atomici exteriori:
Acest lucru explică de ce carbonul din compuși este de obicei tetravalent. Egalitatea numărului de electroni de valență din atomul de carbon cu numărul de orbitali de valență, precum și raportul unic dintre sarcina nucleară și raza atomului, îi conferă capacitatea de a adăuga și dona electroni la fel de ușor, în funcție de proprietățile partenerului (Sec. 9.3.1). Ca rezultat, carbonul se caracterizează prin diferite stări de oxidare de la -4 la +4 și prin ușurința hibridizării orbitalilor săi atomici în funcție de tip. sp3,sp2Și sp 1în timpul formării legăturilor chimice (secțiunea 2.1.3):

Toate acestea conferă carbonului capacitatea de a forma legături simple, duble și triple nu numai între ele, ci și cu atomii altor elemente organogene. Moleculele formate în acest caz pot avea o structură liniară, ramificată și ciclică.
Datorită mobilității electronilor comuni - MO formată cu participarea atomilor de carbon, aceștia sunt deplasați către atomul unui element mai electronegativ (efect inductiv), ceea ce duce la polaritatea nu numai a acestei legături, ci și a moleculei în ansamblu. . Cu toate acestea, carbonul, datorită valorii medii a electronegativității (0E0 = 2,5), formează legături slab polare cu atomii altor elemente organogene (Tabelul 12.1). În prezența sistemelor de legături conjugate în molecule (Sec. 2.1.3), electronii mobili (MO) și perechile de electroni neîmpărțiți sunt delocalizați odată cu alinierea densității electronilor și a lungimii legăturilor în aceste sisteme.

Din punctul de vedere al reactivității compușilor, polarizabilitatea legăturilor joacă un rol important (Sec. 2.1.3). Cu cât polarizabilitatea unei legături este mai mare, cu atât reactivitatea acesteia este mai mare. Dependența polarizabilității legăturilor care conțin carbon de natura lor reflectă următoarea serie:
Toate datele luate în considerare cu privire la proprietățile legăturilor care conțin carbon indică faptul că carbonul din compuși formează, pe de o parte, legături covalente suficient de puternice între ele și cu alți organogeni și, pe de altă parte, perechile de electroni comuni ale acestor legături. sunt destul de labile. Ca urmare, poate apărea atât o creștere a reactivității acestor legături, cât și o stabilizare. Aceste caracteristici ale compușilor care conțin carbon sunt cele care fac din carbon organogenul numărul unu.
Proprietățile acido-bazice ale compușilor de carbon. Monoxidul de carbon(4) este un oxid acid, iar hidroxidul corespunzător, acidul carbonic H2CO3, este un acid slab. Molecula de monoxid de carbon(4) este nepolară și, prin urmare, este slab solubilă în apă (0,03 mol/l la 298 K). În acest caz, la început, în soluție se formează hidratul de CO2 H2O, în care CO2 se află în cavitatea unui asociat de molecule de apă, iar apoi acest hidrat se transformă lent și reversibil în H2CO3. Majoritatea monoxidului de carbon (4) dizolvat în apă este sub formă de hidrat.
In organism, in eritrocitele sangvine, sub actiunea enzimei carboanhidrazei, echilibrul intre CO2 H2O si H2CO3 hidrat se stabileste foarte repede. Acest lucru face posibilă neglijarea prezenței CO2 sub formă de hidrat în eritrocit, dar nu și în plasma sanguină, unde nu există anhidrază carbonică. H2CO3 rezultat se disociază în condiții fiziologice într-un anion bicarbonat și într-un mediu mai alcalin într-un anion carbonat:

Acidul carbonic există doar în soluție. Formează două serii de săruri - bicarbonați (NaHCO3, Ca(HC0 3) 2) și carbonați (Na2CO3, CaCO3). Bicarbonații sunt mai solubili în apă decât carbonații. În soluții apoase, sărurile acidului carbonic, în special carbonații, sunt ușor hidrolizate de către anion, creând un mediu alcalin:
Substanțe precum NaHC03 bicarbonat de sodiu; Creta CaCO3, magnezia albă 4MgC03 * Mg (OH) 2 * H2O, hidrolizând cu formarea unui mediu alcalin, sunt folosite ca antiacide (acizi neutralizanți) pentru a reduce aciditatea ridicată a sucului gastric:
Combinația de acid carbonic și ion de bicarbonat (Н2СО3, НСО3(-)) formează un sistem tampon de bicarbonat (Secțiunea 8.5) - un sistem tampon glorios al plasmei sanguine, care asigură constanta pH-ului sângelui la pH = 7,40 ± 0,05.
Prezența bicarbonaților de calciu și magneziu în apele naturale determină duritatea temporară a acestora. Când o astfel de apă este fiartă, duritatea ei este eliminată. Acest lucru se datorează hidrolizei anionului HCO3 (-), descompunerii termice a acidului carbonic și precipitării cationilor de calciu și magneziu sub formă de compuși insolubili CaCO3 și Mg (OH)2:
Formarea Mg(OH)2 este cauzată de hidroliza completă a cationului de magneziu, care are loc în aceste condiţii datorită solubilităţii mai scăzute a Mg(0H)2 comparativ cu MgC03.
În practica biomedicală, pe lângă acidul carbonic, trebuie să se ocupe de alți acizi care conțin carbon. Aceasta este în primul rând o mare varietate de acizi organici diferiți, precum și acid cianhidric HCN. Din punct de vedere al proprietăților acide, puterea acestor acizi este diferită:
Aceste diferențe se datorează influenței reciproce a atomilor din moleculă, naturii legăturii de disociere și stabilității anionului, adică capacității sale de a delocaliza sarcina.
Acidul cianhidric sau cianura de hidrogen, HCN - un lichid incolor, volatil (T balot = 26 °C) cu miros de migdale amare, miscibil cu apă în orice raport. În soluții apoase, se comportă ca un acid foarte slab, ale cărui săruri se numesc cianuri. Cianurile metalelor alcaline și alcalino-pământoase sunt solubile în apă, în timp ce sunt hidrolizate de anion, motiv pentru care soluțiile lor apoase au miros de acid cianhidric (miros de migdale amare) și au un pH > 12:
Cu expunerea prelungită la CO2 conținut în aer, cianurile se descompun cu eliberarea de acid cianhidric:
Ca urmare a acestei reacții, cianura de potasiu (cianura de potasiu) și soluțiile sale își pierd toxicitatea în timpul depozitării pe termen lung. Anionul cianură este una dintre cele mai puternice otrăvuri anorganice, deoarece este un ligand activ și formează cu ușurință compuși complecși stabili cu enzime care conțin Fe3+ și Сu2(+) ca ioni de complexare (Sec. 10.4).
proprietăți redox. Deoarece carbonul din compuși poate prezenta orice stare de oxidare de la -4 la +4, în timpul reacției, carbonul liber poate dona și adăuga electroni, acționând ca agent reducător sau, respectiv, agent oxidant, în funcție de proprietățile celui de-al doilea reactiv:
Atunci când agenții oxidanți puternici interacționează cu substanțele organice, poate avea loc oxidarea incompletă sau completă a atomilor de carbon ai acestor compuși.
În condiții de oxidare anaerobă, cu lipsa sau absența oxigenului, atomii de carbon ai unui compus organic, în funcție de conținutul de atomi de oxigen din acești compuși și de condițiile externe, se pot transforma în CO2, CO, C și chiar CH4 și alți organogeni se transformă în H2O, NH3 și H2S.
În organism, oxidarea completă a compușilor organici cu oxigen în prezența enzimelor oxidaze (oxidare aerobă) este descrisă de ecuația:
Din ecuațiile de mai sus ale reacțiilor de oxidare, se poate observa că în compușii organici, doar atomii de carbon modifică starea de oxidare, în timp ce atomii altor organogeni își păstrează starea de oxidare.
În reacțiile de hidrogenare, adică adăugarea de hidrogen (agent reducător) la o legătură multiplă, atomii de carbon care o formează își reduc starea de oxidare (acționează ca agenți de oxidare):
Reacțiile de substituție organică cu apariția unei noi legături intercarbonice, de exemplu, în reacția Wurtz, sunt, de asemenea, reacții redox în care atomii de carbon acționează ca agenți de oxidare și atomii de metal ca agenți reducători:
Acest lucru se observă în reacțiile de formare a compușilor organometalici:
În același timp, în reacțiile de alchilare cu formarea unei noi legături intercarbonice, rolul de agent oxidant și de agent reducător este jucat de atomii de carbon ai substratului și respectiv ai reactivului:
Ca urmare a reacțiilor de adăugare a unui reactiv polar la un substrat printr-o legătură intercarbonică multiplă, unul dintre atomii de carbon scade gradul de oxidare, prezentând proprietățile unui agent oxidant, iar celălalt crește gradul de oxidare, acționând ca un agent reducător:

În aceste cazuri are loc reacția de oxidare-reducere intramoleculară a atomilor de carbon ai substratului, adică procesul dismutații, sub acţiunea unui reactiv care nu prezintă proprietăţi redox.
Reacțiile tipice de dismutare intramoleculară a compușilor organici în detrimentul atomilor lor de carbon sunt reacțiile de decarboxilare ale aminoacizilor sau cetoacizilor, precum și reacțiile de rearanjare și izomerizare a compușilor organici, care au fost luate în considerare în Sec. 9.3. Exemplele date de reacții organice, precum și reacțiile din Sec. 9.3 indică în mod convingător faptul că atomii de carbon din compușii organici pot fi atât agenți oxidanți, cât și reductori.
Un atom de carbon într-un compus- un agent oxidant, dacă în urma reacției numărul legăturilor sale cu atomi ai elementelor mai puțin electronegative (hidrogen, metale) crește, deoarece, prin atragerea electronilor comuni ai acestor legături, atomul de carbon în cauză își scade starea de oxidare .

Un atom de carbon într-un compus- un agent reducător, dacă în urma reacției crește numărul legăturilor sale cu atomi ai mai multor elemente electronegative(C, O, N, S), deoarece, împingând electronii comuni ai acestor legături, atomul de carbon în cauză își mărește starea de oxidare.

Astfel, multe reacții din chimia organică, datorită dualității redox a atomilor de carbon, sunt reacții redox. Cu toate acestea, spre deosebire de reacțiile similare din chimia anorganică, redistribuirea electronilor între un agent oxidant și un agent reducător în compușii organici poate fi însoțită doar de o schimbare a perechii de electroni comune a unei legături chimice la un atom care acționează ca un agent oxidant. În acest caz, această conexiune poate fi păstrată, dar în cazurile de polarizare puternică, se poate rupe.
Proprietăți de complexare ale compușilor de carbon. Atomul de carbon din compuși nu are perechi de electroni neîmpărțiți și, prin urmare, numai compușii de carbon care conțin legături multiple cu participarea sa pot acționa ca liganzi. Deosebit de activi în procesele de formare a complexului sunt electronii legăturii triple polare a monoxidului de carbon (2) și anionul acidului cianhidric.
Într-o moleculă de monoxid de carbon(2), atomii de carbon și de oxigen formează o legătură una și una datorită suprapunerii reciproce a celor doi orbitali atomici 2p ai lor prin mecanismul de schimb. A treia legătură, adică încă o legătură, este formată de mecanismul donor-acceptor. Acceptorul este orbitalul atomic liber 2p al atomului de carbon, iar donorul este atomul de oxigen, care furnizează o pereche de electroni singuratică din orbitalul 2p:

Multiplicitatea crescută a legăturilor oferă acestei molecule stabilitate și inerție ridicate în condiții normale în ceea ce privește proprietățile acido-bazice (CO - oxid care nu formează sare) și proprietăți redox (CO - agent reducător la T > 1000 K). În același timp, îl face un ligand activ în reacții complexe de formare cu atomi și cationi ai d-metalelor, în primul rând cu fier, cu care formează pentacarbonilul de fier, un lichid otrăvitor volatil:
![]()
Capacitatea de a forma compuși complecși cu cationi d-metalici este motivul toxicității monoxidului de carbon (H) pentru sistemele vii (Sec. 10.4) datorită apariției reacțiilor reversibile cu hemoglobină și oxihemoglobină care conține cationul Fe 2+, cu formarea carboxihemoglobinei:
Aceste echilibre sunt deplasate către formarea carboxihemoglobinei HHbCO, a cărei stabilitate este de 210 de ori mai mare decât cea a oxihemoglobinei HHbO2. Acest lucru duce la acumularea de carboxihemoglobină în sânge și, în consecință, la o scădere a capacității sale de a transporta oxigen.
Anionul acid cianhidric CN- conține, de asemenea, electroni ușor polarizabili, din cauza cărora formează în mod eficient complexe cu metalele d, inclusiv metalele de viață care fac parte din enzime. Prin urmare, cianurile sunt compuși foarte toxici (Secțiunea 10.4).
Ciclul carbonului în natură. Ciclul carbonului în natură se bazează în principal pe reacțiile de oxidare și reducere a carbonului (Fig. 12.3).
Plantele asimilează (1) monoxidul de carbon (4) din atmosferă și hidrosferă. O parte din masa vegetală este consumată (2) de om și animale. Respirația animalelor și putrezirea rămășițelor lor (3), precum și respirația plantelor, putrezirea plantelor moarte și arderea lemnului (4) returnează CO2 în atmosferă și hidrosferă. Procesul de mineralizare a resturilor de plante (5) și animale (6) cu formarea de turbă, cărbuni fosili, petrol, gaze duce la trecerea carbonului în resurse naturale. Reacțiile acido-bazice (7) care se desfășoară între CO2 și diverse roci cu formare de carbonați (medii, acizi și bazici) acționează în aceeași direcție:
Această parte anorganică a ciclului duce la pierderi de CO2 în atmosferă și hidrosferă. Activitatea umană în arderea și prelucrarea cărbunelui, petrolului, gazelor (8), lemnului de foc (4), dimpotrivă, îmbogățește mediul cu monoxid de carbon (4). Multă vreme s-a crezut că fotosinteza a menținut constantă concentrația de CO2 din atmosferă. Cu toate acestea, în prezent, creșterea conținutului de CO2 din atmosferă din cauza activităților umane nu este compensată de scăderea lui naturală. Eliberarea totală de CO2 în atmosferă crește exponențial cu 4-5% pe an. Conform calculelor, în anul 2000 conţinutul de CO2 din atmosferă va ajunge la aproximativ 0,04% în loc de 0,03% (1990).
După luarea în considerare a proprietăților și caracteristicilor compușilor care conțin carbon, rolul principal al carbonului trebuie subliniat încă o dată.

Orez. 12.3. Ciclul carbonului în natură
organogenul nr. 1: în primul rând, atomii de carbon formează scheletul moleculelor de compuși organici; în al doilea rând, atomii de carbon joacă un rol cheie în procesele redox, deoarece dintre atomii tuturor organogenilor, dualitatea redox este cea mai caracteristică pentru carbon. Pentru mai multe informații despre proprietățile compușilor organici, consultați modulul IV „Fundamentals of Bioorganic Chemistry”.
Caracteristicile generale și rolul biologic al elementelor p din grupa IVA. Analogii electronici ai carbonului sunt elementele grupului IVA: siliciu Si, germaniu Ge, staniu Sn și plumb Pb (vezi Tabelul 1.2). Razele atomice ale acestor elemente cresc în mod natural odată cu creșterea numărului atomic, în timp ce energia lor de ionizare și electronegativitatea scad în mod natural în acest caz (Sec. 1.3). Prin urmare, primele două elemente ale grupului: carbonul și siliciul sunt nemetale tipice, iar germaniul, staniul, plumbul sunt metale, deoarece se caracterizează cel mai mult prin întoarcerea electronilor. În seria Ge - Sn - Pb, proprietățile metalice sunt îmbunătățite.
Din punct de vedere al proprietăților redox, elementele C, Si, Ge, Sn și Pb în condiții normale sunt destul de stabile față de aer și apă (metale Sn și Pb - datorită formării unei pelicule de oxid la suprafață). În același timp, compușii de plumb(4) sunt agenți oxidanți puternici:
Proprietățile de complexare sunt cele mai caracteristice plumbului, deoarece cationii săi Pb 2+ sunt agenți de complexare puternici în comparație cu cationii celorlalte elemente p din grupa IVA. Cationii de plumb formează complexe puternice cu bioliganzii.
Elementele grupului IVA diferă puternic atât în conținutul din organism, cât și în rolul lor biologic. Carbonul joacă un rol fundamental în viața organismului, unde conținutul său este de aproximativ 20%. Conținutul din corpul elementelor rămase din grupul IVA este în intervalul 10 -6 -10 -3%. În același timp, dacă siliciul și germaniul joacă, fără îndoială, un rol important în viața organismului, atunci staniul și în special plumbul sunt toxice. Astfel, odată cu creșterea masei atomice a elementelor din grupa IVA, toxicitatea compușilor acestora crește.
Praful, format din particule de cărbune sau dioxid de siliciu SiO2, atunci când este expus sistematic la plămâni, provoacă boli - pneumoconioză. În cazul prafului de cărbune, acesta este antracoza, o boală profesională a minerilor. Silicoza apare atunci când praful care conține Si02 este inhalat. Mecanismul de dezvoltare a pneumoconiozei nu a fost încă stabilit. Se presupune că la contactul prelungit al boabelor de silicat cu fluidele biologice, acidul polisilicic Si02 yH2O se formează într-o stare asemănătoare unui gel, a cărui depunere în celule duce la moartea lor.
Efectul toxic al plumbului este cunoscut omenirii de foarte mult timp. Utilizarea plumbului pentru fabricarea vaselor și a conductelor de apă a dus la otrăvirea în masă a oamenilor. În prezent, plumbul continuă să fie unul dintre principalii poluanți ai mediului, deoarece eliberarea de compuși ai plumbului în atmosferă este de peste 400.000 de tone anual. Plumbul se acumulează în principal în schelet sub formă de fosfat slab solubil Pb3(PO4)2, iar în timpul demineralizării osoase are un efect toxic regulat asupra organismului. Prin urmare, plumbul este clasificat ca o otravă cumulativă. Toxicitatea compușilor de plumb este asociată în primul rând cu proprietățile sale de complexare și cu afinitatea ridicată pentru bioliganzi, în special cei care conțin grupări sulfhidril (-SH):
Formarea compușilor complecși ai ionilor de plumb cu proteine, fosfolipide și nucleotide duce la denaturarea acestora. Ionii de plumb inhibă adesea metaloenzimele EM 2+, înlocuind cationii metalici de viață din ele:
Plumbul și compușii săi sunt otrăvuri care acționează în primul rând asupra sistemului nervos, a vaselor de sânge și a sângelui. În același timp, compușii de plumb afectează sinteza proteinelor, echilibrul energetic al celulelor și aparatul lor genetic.
În medicină se folosesc ca antiseptice externe astringente: acetat de plumb Pb (CH3COO) 2 ZH2O (loțiuni de plumb) și oxid de plumb (2) PbO (gips de plumb). Ionii de plumb ai acestor compuși reacționează cu proteinele (albuminele) din citoplasma celulelor și țesuturilor microbiene, formând albuminate asemănătoare gelului. Formarea gelurilor ucide microbii și, în plus, le face dificilă pătrunderea în celulele țesuturilor, ceea ce reduce răspunsul inflamator local.
Conținutul articolului
CARBON, C (carboneum), un element chimic nemetalic din grupa IVA (C, Si, Ge, Sn, Pb) din Tabelul Periodic al Elementelor. Se găsește în natură sub formă de cristale de diamant (Fig. 1), grafit sau fullerenă și alte forme și face parte din substanțe organice (cărbune, ulei, organisme animale și vegetale etc.) și anorganice (calcar, bicarbonat de sodiu etc.). .).
Carbonul este larg răspândit, dar conținutul său în scoarța terestră este de doar 0,19%.
Carbonul este utilizat pe scară largă sub formă de substanțe simple. Pe lângă diamantele prețioase, care fac obiectul bijuteriilor, diamantele industriale sunt de mare importanță - pentru fabricarea sculelor de șlefuit și tăiere.
Cărbunele și alte forme amorfe de carbon sunt utilizate pentru decolorare, purificare, adsorbție de gaze, în domeniile de tehnologie în care sunt necesari adsorbanți cu suprafață dezvoltată. Carburele, compușii de carbon cu metale, precum și cu bor și siliciu (de exemplu, Al 4 C 3 , SiC, B 4 C) se caracterizează prin duritate ridicată și sunt utilizați la fabricarea sculelor abrazive și tăietoare. Carbonul este prezent în oțeluri și aliaje în stare elementară și sub formă de carburi. Saturarea suprafeței pieselor turnate de oțel cu carbon la temperatură ridicată (cimentare) crește semnificativ duritatea suprafeței și rezistența la uzură. Vezi si ALIAJE.
Există multe forme diferite de grafit în natură; unele sunt obținute artificial; sunt disponibile forme amorfe (ex. cocs și cărbune). Funingine, cărbune de os, negru de lampă, negru de acetilenă se formează atunci când hidrocarburile sunt arse în absența oxigenului. Așa-zisul carbon alb obținute prin sublimarea grafitului pirolitic sub presiune redusă - acestea sunt cele mai mici cristale transparente de frunze de grafit cu margini ascuțite.
Referință istorică.
Grafitul, diamantul și carbonul amorf sunt cunoscute încă din antichitate. Se știe de mult timp că alte materiale pot fi marcate cu grafit, iar chiar numele „grafit”, care provine din cuvântul grecesc care înseamnă „a scrie”, a fost propus de A. Werner în 1789. Cu toate acestea, istoria grafitului este confuz, adesea substanțe cu proprietăți fizice externe similare au fost confundate cu acesta, cum ar fi molibdenitul (sulfura de molibden), considerat la un moment dat grafit. Alte denumiri pentru grafit includ „plumb negru”, „carbură de fier”, „plumb argintiu”. În 1779, K. Scheele a descoperit că grafitul poate fi oxidat cu aer pentru a forma dioxid de carbon.
Pentru prima dată, diamantele și-au găsit utilizare în India, iar în Brazilia, pietrele prețioase au căpătat importanță comercială în 1725; zăcăminte din Africa de Sud au fost descoperite în 1867. În secolul al XX-lea. Principalii producători de diamante sunt Africa de Sud, Zair, Botswana, Namibia, Angola, Sierra Leone, Tanzania și Rusia. Diamantele artificiale, a căror tehnologie a fost creată în 1970, sunt produse în scopuri industriale.
alotropie.
Dacă unitățile structurale ale unei substanțe (atomi pentru elemente monoatomice sau molecule pentru elemente și compuși poliatomici) sunt capabile să se combine între ele în mai multe forme cristaline, acest fenomen se numește alotropie. Carbonul are trei modificări alotrope - diamant, grafit și fullerene. În diamant, fiecare atom de carbon are 4 vecini situati tetraedric, formând o structură cubică (Fig. 1, A). Această structură corespunde covalenței maxime a legăturii și toți cei 4 electroni ai fiecărui atom de carbon formează legături C-C de înaltă rezistență, adică. nu există electroni de conducere în structură. Prin urmare, diamantul se distinge prin lipsa de conductivitate, conductivitate termică scăzută, duritate ridicată; este cea mai dură substanță cunoscută (fig. 2). Ruperea legăturii C–C (lungimea legăturii 1,54 Å, de unde raza covalentă 1,54/2 = 0,77 Å) în structura tetraedrică necesită multă energie, astfel încât diamantul, împreună cu o duritate excepțională, se caracterizează printr-un punct de topire ridicat (3550). °C).
O altă formă alotropică de carbon este grafitul, care este foarte diferit de diamant în proprietăți. Grafitul este o substanță neagră moale din cristale care se exfoliază ușor, caracterizată printr-o bună conductivitate electrică (rezistență electrică 0,0014 Ohm cm). Prin urmare, grafitul este utilizat în lămpi cu arc și cuptoare (Fig. 3), în care este necesar să se creeze temperaturi ridicate. Grafitul de înaltă puritate este utilizat în reactoarele nucleare ca moderator de neutroni. Punctul său de topire la presiune ridicată este de 3527 ° C. La presiune normală, grafitul se sublimează (se transferă de la o stare solidă la un gaz) la 3780 ° C.
Structura din grafit (Fig. 1, b) este un sistem de inele hexagonale topite cu o lungime a legăturii de 1,42 Å (semnificativ mai scurtă decât în diamant), dar fiecare atom de carbon are trei (în loc de patru, ca în diamant) legături covalente cu trei vecini și a patra legătură (3,4). Å) este prea lungă pentru o legătură covalentă și leagă slab straturile paralele stivuite de grafit între ele. Este al patrulea electron de carbon care determină conductivitatea termică și electrică a grafitului - această legătură mai lungă și mai puțin puternică formează grafit mai puțin compact, ceea ce se reflectă în duritatea sa mai mică în comparație cu diamantul (densitatea grafitului este de 2,26 g/cm 3, diamant - 3,51). g/cm3). Din același motiv, grafitul este alunecos la atingere și separă cu ușurință fulgii substanței, care este folosită pentru a face lubrifianți și mine de creion. Lustrul plumbului se datorează în principal prezenței grafitului.
Fibrele de carbon au o rezistență ridicată și pot fi folosite pentru a face fire de raion sau alte fire cu conținut ridicat de carbon.
La presiune și temperatură ridicată, în prezența unui catalizator precum fierul, grafitul poate fi transformat în diamant. Acest proces a fost implementat pentru producția industrială de diamante artificiale. Cristalele de diamant cresc pe suprafața catalizatorului. Echilibrul grafit-diamant există la 15.000 atm și 300 K sau la 4.000 atm și 1.500 K. Diamantele artificiale pot fi obținute și din hidrocarburi.
Formele amorfe de carbon care nu formează cristale includ cărbunele obținut prin încălzirea unui copac fără acces la aer, funinginea de lampă și gaz formată în timpul arderii la temperatură scăzută a hidrocarburilor cu lipsă de aer și condensată pe o suprafață rece, cărbunele de os este un amestec pentru fosfat de calciu în procesul de distrugere a țesăturilor osoase, precum și cărbunele (o substanță naturală cu impurități) și cocs, un reziduu uscat obținut din cocsificarea combustibililor prin distilarea uscată a reziduurilor de cărbune sau petrol (cărbuni bituminoși), adică. incalzire fara aer. Cocsul este folosit pentru topirea fierului, în metalurgia feroasă și neferoasă. În timpul cocsării se formează și produse gazoase - gaz de cocs (H 2 , CH 4 , CO etc.) și produse chimice care sunt materii prime pentru producerea benzinei, vopselelor, îngrășămintelor, medicamentelor, materialelor plastice etc. Schema aparatului principal pentru producerea de cocs - un cuptor de cocs - este prezentată în fig. 3.
Diferite tipuri de cărbune și funingine sunt caracterizate de o suprafață dezvoltată și, prin urmare, sunt utilizate ca adsorbanți pentru purificarea gazelor și lichidelor, precum și ca catalizatori. Pentru a obține diferite forme de carbon, se folosesc metode speciale de tehnologie chimică. Grafitul artificial este obținut prin calcinarea antracitului sau a cocsului de petrol între electrozii de carbon la 2260°C (procesul Acheson) și este utilizat în producția de lubrifianți și electrozi, în special pentru producerea electrolitică a metalelor.
Structura atomului de carbon.
Nucleul celui mai stabil izotop de carbon de masă 12 (abundență de 98,9%) are 6 protoni și 6 neutroni (12 nucleoni) dispuși în trei cvartete, fiecare conținând 2 protoni și doi neutroni, similar unui nucleu de heliu. Un alt izotop stabil de carbon este 13 C (cca. 1,1%), iar un izotop instabil 14 C există în natură în urme, cu un timp de înjumătățire de 5730 de ani, care are b-radiații. Toți cei trei izotopi sub formă de CO 2 participă la ciclul normal al carbonului al materiei vii. După moartea unui organism viu, consumul de carbon se oprește și obiectele care conțin C pot fi datate prin măsurarea nivelului de radioactivitate 14 C. Scăderea b-radiaţia de 14 CO 2 este proporţională cu timpul scurs de la moarte. În 1960, W. Libby a primit Premiul Nobel pentru cercetarea carbonului radioactiv.
În starea fundamentală, 6 electroni de carbon formează o configurație electronică de 1 s 2 2s 2 2px 1 2py 1 2pz 0 . Patru electroni de al doilea nivel sunt valența, care corespunde poziției carbonului în grupul IVA al sistemului periodic ( cm. TABEL PERIODIC AL ELEMENTELOR). Întrucât desprinderea unui electron de un atom în faza gazoasă necesită o energie mare (aproximativ 1070 kJ/mol), carbonul nu formează legături ionice cu alte elemente, deoarece aceasta ar necesita desprinderea unui electron cu formarea unui element pozitiv. ion. Cu o electronegativitate de 2,5, carbonul nu prezintă o afinitate puternică pentru electroni și, prin urmare, nu este un acceptor de electroni activ. Prin urmare, nu este predispus să formeze o particulă cu sarcină negativă. Dar cu o natură parțial ionică a legăturii, există unii compuși de carbon, de exemplu, carburi. În compuși, carbonul prezintă o stare de oxidare de 4. Pentru ca patru electroni să poată participa la formarea legăturilor, este necesară depărtarea lui 2. s-electroni și saltul unuia dintre acești electroni cu 2 pz-orbital; în acest caz, se formează 4 legături tetraedrice cu un unghi între ele de 109°. În compuși, electronii de valență ai carbonului sunt îndepărtați doar parțial de acesta, astfel încât carbonul formează legături covalente puternice între atomii vecini de tip C-C folosind o pereche de electroni comună. Energia de rupere a unei astfel de legături este de 335 kJ/mol, în timp ce pentru legătura Si–Si este de doar 210 kJ/mol; prin urmare, lanțurile lungi –Si–Si– sunt instabile. Natura covalentă a legăturii este păstrată chiar și în compușii de halogeni foarte reactivi cu carbon, CF4 și CCl4. Atomii de carbon sunt capabili să furnizeze mai mult de un electron din fiecare atom de carbon pentru formarea legăturilor; astfel se formează legături duble C=C și triple CºC. Alte elemente formează, de asemenea, legături între atomii lor, dar numai carbonul este capabil să formeze lanțuri lungi. Prin urmare, mii de compuși sunt cunoscuți pentru carbon, numiți hidrocarburi, în care carbonul este legat de hidrogen și alți atomi de carbon, formând catene lungi sau structuri inelare. Cm. CHIMIE ORGANICE.
În acești compuși, este posibilă înlocuirea hidrogenului cu alți atomi, cel mai adesea cu oxigen, azot și halogeni, cu formarea multor compuși organici. Fluorocarburile, hidrocarburi în care hidrogenul este înlocuit cu fluor, ocupă un loc important printre ele. Astfel de compuși sunt extrem de inerți și sunt utilizați ca plastic și lubrifianți (fluorocarburi, adică hidrocarburi în care toți atomii de hidrogen sunt înlocuiți cu atomi de fluor) și ca agenți frigorifici la temperatură joasă (freoni, sau freoni, - fluoroclorhidrocarburi).
În anii 1980, fizicienii americani au descoperit compuși de carbon foarte interesanți în care atomii de carbon sunt legați în 5 sau 6 gooane, formând o moleculă C 60 sub forma unei mingi goale, cu o simetrie perfectă a mingii de fotbal. Întrucât un astfel de design stă la baza „domului geodezic” inventat de arhitectul și inginerul american Buckminster Fuller, noua clasă de compuși a fost numită „buckminsterfullerenes” sau „fullerenes” (și, de asemenea, mai pe scurt, „fasiballs” sau „buckyballs”). Fulerenele - a treia modificare a carbonului pur (cu excepția diamantului și grafitului), constând din 60 sau 70 (și chiar mai mulți) atomi - a fost obținută prin acțiunea radiației laser asupra celor mai mici particule de carbon. Fulerenele de o formă mai complexă constau din câteva sute de atomi de carbon. Diametrul moleculei C60 este de ~ 1 nm. Există suficient spațiu în centrul unei astfel de molecule pentru a găzdui un atom mare de uraniu.
masa atomică standard.
În 1961, Uniunile Internaționale de Chimie Pură și Aplicată (IUPAC) și în fizică au adoptat masa izotopului de carbon 12 C ca unitate de masă atomică, eliminând scara de oxigen existentă anterior a maselor atomice. Masa atomică a carbonului în acest sistem este de 12.011, deoarece este media pentru cei trei izotopi naturali de carbon, ținând cont de abundența lor în natură. Cm. MASĂ ATOMICĂ.
Proprietățile chimice ale carbonului și ale unora dintre compușii săi.
Unele proprietăți fizice și chimice ale carbonului sunt prezentate în articolul ELEMENTE CHIMICE. Reactivitatea carbonului depinde de modificarea, temperatura și dispersia acestuia. La temperaturi scăzute, toate formele de carbon sunt destul de inerte, dar atunci când sunt încălzite, sunt oxidate de oxigenul atmosferic, formând oxizi:
Carbonul fin dispersat în exces de oxigen este capabil să explodeze atunci când este încălzit sau de la o scânteie. Pe lângă oxidarea directă, există metode mai moderne de obținere a oxizilor.
suboxid de carbon
C 3 O 2 se formează în timpul deshidratării acidului malonic peste P 4 O 10:
C 3 O 2 are un miros neplăcut, se hidrolizează ușor, reformând acidul malonic.
Monoxid de carbon (II) CO se formează în timpul oxidării oricărei modificări a carbonului în absența oxigenului. Reacția este exotermă, se eliberează 111,6 kJ/mol. Cocsul la căldură albă reacţionează cu apa: C + H 2 O = CO + H 2; amestecul de gaz rezultat se numește „gaz de apă” și este un combustibil gazos. De asemenea, CO se formează în timpul arderii incomplete a produselor petroliere, se găsește în cantități semnificative în gazele de eșapament ale automobilelor și se obține prin disocierea termică a acidului formic:
Starea de oxidare a carbonului în CO este +2 și, deoarece carbonul este mai stabil în starea de oxidare +4, CO este ușor oxidat de oxigen la CO 2: CO + O 2 → CO 2, această reacție este extrem de exotermă (283 kJ / mol). CO este utilizat în industrie în amestec cu H 2 și alte gaze combustibile ca combustibil sau agent reducător gazos. Când este încălzit la 500 ° C, CO formează C și CO 2 într-o măsură vizibilă, dar la 1000 ° C, echilibrul este stabilit la concentrații scăzute de CO 2. CO reacționează cu clorul, formând fosgen - COCl 2, reacțiile cu alți halogeni decurg similar, în reacția cu sulful se obține sulfură de carbonil COS, cu metale (M) CO formează carbonili de diverse compoziții M (CO) X, care sunt compuși complecși. Carbonilul de fier se formează prin interacțiunea hemoglobinei din sânge cu CO, prevenind reacția hemoglobinei cu oxigenul, deoarece carbonilul de fier este un compus mai puternic. Ca urmare, funcția hemoglobinei ca purtător de oxigen către celule este blocată, care apoi mor (și în primul rând, celulele creierului sunt afectate). (De aici un alt nume pentru CO - „monoxid de carbon”). Deja 1% (vol.) CO în aer este periculos pentru o persoană dacă se află într-o astfel de atmosferă mai mult de 10 minute. Unele proprietăți fizice ale CO sunt prezentate în tabel.
Dioxid de carbon sau monoxid de carbon (IV) CO 2 se formează în timpul arderii carbonului elementar în exces de oxigen cu degajare de căldură (395 kJ/mol). CO 2 (numele trivial este „dioxid de carbon”) se formează și în timpul oxidării complete a CO, a produselor petroliere, a benzinei, a uleiurilor și a altor compuși organici. Când carbonații sunt dizolvați în apă, CO 2 este, de asemenea, eliberat ca rezultat al hidrolizei:
Această reacție este adesea folosită în practica de laborator pentru a obține CO 2 . Acest gaz poate fi obținut și prin calcinarea bicarbonaților metalici:
în interacțiunea fază gazoasă a aburului supraîncălzit cu CO:
la arderea hidrocarburilor și a derivaților lor de oxigen, de exemplu:
În mod similar, produsele alimentare sunt oxidate într-un organism viu cu eliberarea de energie termică și de alte tipuri. În acest caz, oxidarea are loc în condiții blânde prin etape intermediare, dar produsele finale sunt aceleași - CO 2 și H 2 O, ca, de exemplu, în timpul descompunerii zaharurilor sub acțiunea enzimelor, în special în timpul fermentației. de glucoză:
Producția cu tonaj mare de dioxid de carbon și oxizi metalici se realizează în industrie prin descompunerea termică a carbonaților:
CaO este utilizat în cantități mari în tehnologia de producție a cimentului. Stabilitatea termică a carbonaților și consumul de căldură pentru descompunerea lor conform acestei scheme cresc în seria CaCO 3 ( Vezi si PREVENIREA INCENDIILOR ȘI PROTECȚIA INCENDIILOR).
Structura electronică a oxizilor de carbon.
Structura electronică a oricărui monoxid de carbon poate fi descrisă prin trei scheme echiprobabile cu diferite aranjamente de perechi de electroni - trei forme rezonante:
Toți oxizii de carbon au o structură liniară.
Acid carbonic.
Când CO2 interacționează cu apa, se formează acid carbonic H2CO3. Într-o soluție saturată de CO2 (0,034 mol/l), doar o parte din molecule formează H2CO3, iar cea mai mare parte a CO2 este în stare hidratată de CO2CHH2O.
Carbonați.
Carbonații se formează prin interacțiunea oxizilor metalici cu CO 2, de exemplu, Na 2 O + CO 2 Na 2 CO 3.
Cu excepția carbonaților de metale alcaline, restul sunt practic insolubili în apă, iar carbonatul de calciu este parțial solubil în acid carbonic sau soluție de CO 2 în apă sub presiune:
Aceste procese au loc în apele subterane care curg prin stratul de calcar. În condiţii de joasă presiune şi evaporare, CaCO3 precipită din apele subterane care conţin Ca(HCO3)2. Așa cresc stalactitele și stalagmitele în peșteri. Culoarea acestor formațiuni geologice interesante se explică prin prezența impurităților de ioni de fier, cupru, mangan și crom în ape. Dioxidul de carbon reacționează cu hidroxizii metalici și soluțiile acestora pentru a forma hidrocarbonați, de exemplu:
CS2 + 2Cl2® CCl4 + 2S
Tetraclorura CCl 4 este o substanță neinflamabilă, folosită ca solvent în procesele de curățare chimică, dar nu este recomandată utilizarea ca ignifug, deoarece la temperatură ridicată formează fosgen toxic (o substanță gazoasă otrăvitoare). CCl 4 în sine este, de asemenea, otrăvitor și, dacă este inhalat în cantități apreciabile, poate provoca intoxicații hepatice. CCl4 se formează de asemenea printr-o reacție fotochimică între metan CH4 și CI2; în acest caz, este posibilă formarea de produse de clorurare incompletă a metanului - CHCl 3 , CH 2 Cl 2 și CH 3 Cl. Reacțiile se desfășoară în mod similar cu alți halogeni.
reacții cu grafit.
Grafitul ca o modificare a carbonului, caracterizat prin distanțe mari între straturile de inele hexagonale, intră în reacții neobișnuite, de exemplu, metalele alcaline, halogenii și unele săruri (FeCl 3) pătrund între straturi, formând compuși ai KC 8, KC 16 de tip (numit interstițial, incluziune sau clatrați). Agenții oxidanți puternici precum KClO 3 într-un mediu acid (acid sulfuric sau azotic) formează substanțe cu un volum mare al rețelei cristaline (până la 6 Å între straturi), ceea ce se explică prin introducerea atomilor de oxigen și formarea de compuși, pe a căror suprafață, ca urmare a oxidării, grupări carboxil (–COOH ) - compuși precum grafitul oxidat sau acidul melitic (benzenhexacarboxilic) C 6 (COOH) 6. În acești compuși, raportul C:O poate varia de la 6:1 la 6:2,5.
Carburi.
Carbonul formează cu metale, bor și siliciu diverși compuși numiți carburi. Cele mai active metale (subgrupe IA-IIIA) formează carburi asemănătoare sărurilor, de exemplu, Na2C2, CaC2, Mg4C3, Al4C3. În industrie, carbura de calciu este obținută din cocs și calcar prin următoarele reacții:
Carburele sunt neconductoare, aproape incolore, se hidrolizează pentru a forma hidrocarburi, de exemplu
CaC 2 + 2H 2 O \u003d C 2 H 2 + Ca (OH) 2
Acetilena C2H2 formată prin reacție servește ca materie primă în producerea multor substanțe organice. Acest proces este interesant deoarece reprezintă trecerea de la materii prime de natură anorganică la sinteza compușilor organici. Carburele care formează acetilenă la hidroliză se numesc acetilide. În siliciul și carburile de bor (SiC și B 4 C), legătura dintre atomi este covalentă. Metalele de tranziție (elementele subgrupului B) când sunt încălzite cu carbon formează și carburi cu compoziție variabilă în fisurile de pe suprafața metalului; legătura dintre ele este aproape de metal. Unele carburi de acest tip, cum ar fi WC, W2C, TiC și SiC, se caracterizează prin duritate și refractaritate ridicate și au o conductivitate electrică bună. De exemplu, NbC, TaC și HfC sunt cele mai refractare substanțe (p.t. = 4000–4200 ° C), carbura de diniobiu Nb 2 C este un supraconductor la 9,18 K, TiC și W 2 C sunt aproape ca duritate de diamant, iar duritatea B 4 C (analog structural al diamantului) este 9,5 pe scara Mohs ( cm. orez. 2). Se formează carburi inerte dacă raza metalului de tranziție
Derivați de azot ai carbonului.
Această grupă include ureea NH 2 CONH 2 - un îngrășământ cu azot utilizat sub formă de soluție. Ureea se obține din NH3 și CO2 când este încălzită sub presiune:
Cianogenul (CN) 2 este similar în multe proprietăți cu halogenii și este adesea denumit pseudohalogen. Cianura se obtine prin oxidarea usoara a ionului de cianura cu oxigen, peroxid de hidrogen sau ion Cu 2+: 2CN - ® (CN) 2 + 2e.
Ionul de cianură, fiind un donor de electroni, formează cu ușurință compuși complecși cu ioni de metale de tranziție. La fel ca CO, ionul de cianură este o otravă, care leagă compuși vitali ai fierului într-un organism viu. Ionii complexi de cianuri au formula generală -0,5 X, Unde X este numărul de coordonare al metalului (agent de complexare), empiric egal cu dublul valorii stării de oxidare a ionului metalic. Exemple de astfel de ioni complecși sunt (structura unor ioni este prezentată mai jos) tetraciano-nichelat (II) -ion 2–, hexacianoferrat (III) 3–, dicianoargentat -:
Carbonili.
Monoxidul de carbon este capabil să reacționeze direct cu multe metale sau ioni metalici, formând compuși complecși numiți carbonili, cum ar fi Ni(CO)4, Fe(CO)5, Fe2(CO)9,3, Mo(CO)6,2 . Legătura din acești compuși este similară cu legătura din complecșii ciano descriși mai sus. Ni(CO)4 este o substanță volatilă folosită pentru a separa nichelul de alte metale. Deteriorarea structurii fontei și oțelului în structuri este adesea asociată cu formarea carbonililor. Hidrogenul poate face parte din carbonili, formând hidruri de carbonil, cum ar fi H2Fe (CO)4 și HCo (CO)4, care prezintă proprietăți acide și reacţionează cu alcalii:
H2Fe(CO)4 + NaOH → NaHFe(CO)4 + H2O
Halogenurile de carbonil sunt de asemenea cunoscute, de exemplu Fe (CO) X 2 , Fe (CO ) 2 X 2 , Co (CO ) I 2 , Pt (CO) CI 2 , unde X este orice halogen.
Hidrocarburi.
Se cunosc un număr mare de compuși ai carbonului cu hidrogen