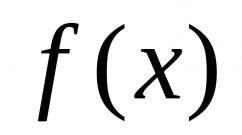Substanțe anorganice: exemple și proprietăți. Lecții de chimie anorganică pentru pregătirea pentru examenul unificat de stat Clasificarea compușilor chimici, substanțelor anorganice
„Clasificarea și nomenclatura compușilor anorganici”
Cele mai importante clase de compuși anorganici sunt oxizii, acizii, bazele și sărurile.
Oxizii sunt substanțe complexe formate din două elemente, dintre care unul este oxigenul în stare de oxidare (– 2).
Când scrieți formula unui oxid, simbolul elementului care formează oxidul este plasat primul, iar oxigenul este plasat pe al doilea. Formula generală a oxizilor: EhOy.
Un grup special de compuși de oxigen ai elementelor sunt peroxizii. Ele sunt de obicei considerate ca săruri ale peroxidului de hidrogen H2O2, care prezintă proprietăți acide slabe. În peroxizi, atomii de oxigen sunt legați chimic nu numai de atomii altor elemente, ci și unul de celălalt (formând gruparea peroxidului –O–O–). De exemplu, peroxidul de sodiu este Na2O2 (Na–O–O–Na), iar oxidul de sodiu este Na2O (Na–O–Na). În peroxizi, starea de oxidare a oxigenului este (–1). Astfel, în peroxidul de bariu BaO2, starea de oxidare a bariului este +2, iar cea a oxigenului este –1.
Denumiri de oxizi
Numele oxizilor, în conformitate cu regulile de nomenclatură, sunt formate din cuvântul „oxid” și din numele elementului care formează oxizi în cazul genitiv, de exemplu, CaO - oxid de calciu, K2O - oxid de potasiu.
În cazul în care un element are o stare de oxidare variabilă și formează mai mulți oxizi, după denumirea acestui element starea sa de oxidare este indicată cu o cifră romană între paranteze, sau se recurge la cifre grecești (1-mono, 2-di, 3-). tri, 4-tetra, 5-penta, 6-hexa, 7-hepta, 8-octa). De exemplu,
VO – oxid de vanadiu (II) sau monoxid de vanadiu;
V2O3 – oxid de vanadiu (III) sau trioxid de divanadiu;
VO2 – oxid de vanadiu (IV) sau dioxid de vanadiu;
V2O5 – oxid de vanadiu (V) sau pentoxid de divanadiu.
Clasificarea oxizilor
Pe baza reactivității lor, oxizii pot fi împărțiți în formatori de sare și neformatori de sare (indiferenți). La rândul lor, oxizii care formează sare sunt împărțiți în bazici, acizi și amfoteri.
Oxizii bazici. Prepararea oxizilor bazici și proprietățile lor chimice
Oxizii bazici sunt cei care au baze corespunzătoare. De exemplu, Na2O, CaO sunt oxizi bazici, deoarece corespund bazelor NaOH, Ca(OH)2.
Prepararea oxizilor bazici
1. Interacțiunea metalului cu oxigenul. De exemplu: 4 Li + O2 → 2 Li2O.
2. Descompunerea la incalzirea compusilor oxigenati: carbonati, nitrati, baze. De exemplu:
![]() .
.
Proprietățile chimice ale oxizilor bazici
1. Interacțiunea cu apa. În ceea ce privește apa, oxizii bazici sunt împărțiți în solubili și insolubili. Solubili sunt oxizii metalelor alcaline () și metalelor alcalino-pământoase ( ![]() ). Când sunt dizolvați în apă, oxizii metalelor alcaline și alcalino-pământoase formează baze solubile în apă numite alcaline. Oxizii altor metale sunt insolubili în apă. De exemplu:
). Când sunt dizolvați în apă, oxizii metalelor alcaline și alcalino-pământoase formează baze solubile în apă numite alcaline. Oxizii altor metale sunt insolubili în apă. De exemplu:
Na2O + H2O → 2NaOH;
CaO + H2O → Ca(OH)2.
2. Oxizii bazici reacţionează cu acizii formând sare şi apă. De exemplu:
CaO + H2SO4 → CaSO4 + H2O
3. Oxizii bazici reacţionează cu cei acizi, formând o sare. De exemplu:
CaO + SO3 → CaSO4
Oxizi acizi. Prepararea oxizilor acizi
și proprietățile lor chimice
Oxizii care corespund acizilor se numesc acizi. De exemplu, CO2, P2O5, SO3 sunt oxizi acizi, deoarece corespund acizilor H2CO3, H3PO4, H2SO4.
Prepararea oxizilor acizi
1. Arderea unui nemetal. De exemplu: S + O2 → SO2;
2. Arderea substanţelor complexe. De exemplu: CH4 + 2O2 → CO2 + 2 H2O;
3. Descompunerea la incalzirea compusilor oxigenati: carbonati, nitrati, hidroxizi. De exemplu:
![]() ;
;
Proprietățile chimice ale oxizilor acizi
1. Interacțiunea cu apa. Majoritatea oxizilor acizi reacţionează direct cu apa pentru a forma un acid. Singurele excepții sunt oxizii de siliciu (SiO2), telur (TeO2, TeO3), molibden și wolfram (MoO3, WO3). De exemplu:
СO2 + H2O ↔ Н2СО3
2. Oxizii acizi reacţionează cu bazele formând sare şi apă. De exemplu:
SO3 + 2 NaOH → Na2SO4 + H2O
3. Oxizii acizi reacţionează cu cei bazici, formând o sare. De exemplu:
3CaO + P2O5 → Ca3(PO4)2
4. Oxizii acizi volatili sunt capabili să-i înlocuiască pe cei mai volatili din sărurile lor. De exemplu, oxidul de siliciu acid nevolatil (IV) înlocuiește oxidul acid volatil CO2 din sarea sa CaCO3 + SiO2 → CaSiO3 + CO2.
Oxizi amfoteri
Oxizii amfoteri sunt cei care, în funcție de condiții, prezintă proprietăți bazice sau acide, adică au proprietăți duble.
1. Oxizii amfoteri nu interacționează cu apa.
2. Oxizii amfoteri reacţionează cu acizii. De exemplu:
Al2O3 + 6 HCl → 2 AlCl3 + 3 H2O
3. Oxizii amfoteri interacționează cu bazele. De exemplu:
Al2O3 + 2 NaOH 2 NaAlO2 + H2O
4. Oxizii amfoteri interacționează cu oxizii bazici și acizi.
Al2O3 + 3 SO3 https://pandia.ru/text/78/037/images/image008_73.gif" width="43" height="29 src="> 2 NaAlO2
Hidroxizii sunt compuși chimici complecși cu mai multe elemente care conțin atomi ai unui element, oxigen și hidrogen. Caracterul chimic al hidroxizilor este determinat de proprietățile oxizilor corespunzători acestora. Prin urmare, hidroxizii sunt împărțiți în trei grupuri mari:
1. Hidrații de oxizi acizi, numiți acizi, de exemplu, H2SO4.
2. Hidrații oxizilor bazici, numiți baze, de exemplu, Ba(OH)2.
3. Hidrații oxizilor amfoteri, numiți hidroxizi amfoteri, de exemplu, Be(OH)2.
Terenuri
Bazele sunt electroliți care se disociază într-o soluție apoasă pentru a forma un cation metalic (sau ion de amoniuNH4+) și grupările hidroxo OH–.
Numele bazelor
Formula generală de bază: Me(OH)n. Conform nomenclaturii internaționale, denumirile bazelor sunt compuse din cuvântul hidroxid și denumirea metalului. De exemplu, NaOH este hidroxid de sodiu, Ca(OH)2 este hidroxid de calciu. Dacă un element formează mai multe baze, atunci denumirea indică gradul de oxidare a acestuia cu o cifră romană între paranteze: Fe(OH)2 - hidroxid de fier (II), Fe(OH)3 - hidroxid de fier (III).
Pe lângă aceste nume, pentru unele dintre cele mai importante baze sunt folosite și alte nume, în principal tradiționale rusești. De exemplu, hidroxidul de sodiu NaOH se numește sodă caustică, hidroxidul de calciu Ca(OH)2 se numește var stins, KOH se numește potasiu caustic.
Numărul de grupări OH– conținute într-o moleculă de bază determină aciditatea acesteia. Pe baza acestui criteriu, bazele sunt împărțite în un acid (KOH), doi acizi (Cu(OH)2) și trei acizi (Cr(OH)3).
Hidroxizii care sunt solubili în apă se numesc alcalii. Aceștia sunt hidroxizi ai metalelor alcaline și alcalino-pământoase: NaOH, KOH, RbOH, CsOH, Ba(OH)2, Ca(OH)2, Sr(OH)2.
Metode de obținere a alcalinelor și bazelor
1. Bazele solubile în apă (alcalii) se obțin prin reacția metalelor alcaline și alcalino-pământoase cu apa.
2Na + 2H2O → 2NaOH + H2
2. Bazele solubile în apă (alcalii) se obțin prin reacția oxizilor metalelor alcaline și alcalino-pământoase cu apa.
Na2O + H2O → 2NaOH
3. Alcaliile pot fi obținute prin electroliza soluțiilor apoase ale sărurilor corespunzătoare (De exemplu, hidroxidul de sodiu poate fi obținut prin electroliza unei soluții de sare de NaCl).
2 NaCl + 2 H2O → 2 NaOH + H2 + Cl2
Catod: 2 H2O + 2e– → H2 + 2 OH–
Anod: 2 Cl– – 2e– → Cl2
4. Bazele ușor solubile sau insolubile în apă se obțin prin reacția soluțiilor sărurilor corespunzătoare cu soluții de alcalii. De exemplu:
Proprietățile chimice ale bazelor
Bazele sunt în mare parte solide. În ceea ce privește apa, acestea pot fi împărțite în două grupe: solubile în apă - alcaline și insolubile în apă. Soluțiile alcaline se simt săpunoase la atingere. Schimbați culoarea indicatorilor: turnesol în albastru, fenolftaleina în purpuriu, metil portocaliu în galben.
1. Proprietățile electrolitice ale bazelor. Una dintre cele mai caracteristice proprietăți ale bazelor este capacitatea lor electrolitică de a se disocia în stare lichidă. La disociarea bazei, se formează o grupare hidroxo OH–, iar reziduul principal este un cation.
Disocierea bazelor care conțin o grupare hidroxo OH– are loc într-o singură etapă:
KOH ↔ K+ + OH–.
Bazele care conțin mai multe grupări hidroxo într-o moleculă se disociază treptat, cu eliminarea treptată a ionilor OH–.
Cationul format după eliminarea unuia sau mai multor ioni de hidroxid dintr-o moleculă de hidroxid se numește reziduu bazic. Numărul de reziduuri bazice care corespund unui hidroxid dat este egal cu numărul de grupări OH-hidroxo din molecula de hidroxid.
Numele reziduului principal este format din numele rusesc al metalului din reziduu cu adăugarea cuvântului „ion”. Dacă reziduurile conțin una sau două grupări hidroxo, la denumirea metalului se adaugă prefixele „hidroxo” sau „dihidroxo”.
De exemplu: Fe(OH)3 « OH– + Fe(OH)2+ ion dihidroxofer (III)
Fe(OH)2+ « OH– + FeOH2+ hidroxifer (III) ion
FeOH2+ « OH– + Fe3+ ion de fier (III).
Din punctul de vedere al teoriei disocierii electrolitice, toate proprietățile generale ale bazelor (săpunul la atingere, schimbarea culorii indicatorilor, interacțiunea cu acizi, oxizi acizi, săruri) se datorează prezenței ionilor de hidroxid în compoziția lor. .
2. Interacțiunea cu acizii. Aceasta este o reacție de neutralizare care are ca rezultat formarea de sare și apă:
2 NaOH + H2SO4 → Na2SO4 + H2O.
3. Alcalii interacționează cu oxizii acizi:
Ca(OH)2 + CO2 → CaCO3 + H2O.
4. Alcalii interacționează cu soluțiile sărate. Această interacțiune are loc dacă după reacție se formează baze puțin solubile sau slabe. De exemplu:
2 KOH + CuSO4 → Cu(OH)2¯ + K2SO4.
5. Când sunt încălzite, bazele insolubile se descompun în oxid și apă. De exemplu:
2 Fe(OH)3Fe2O3 + 3 H2O.
Hidroxizi amfoteri
Amfoteritatea hidroxizilor este înțeleasă ca capacitatea hidroxizilor metalici slab solubili de a prezenta proprietăți acide sau bazice, în funcție de natura interacțiunii acid-bază. Următorii hidroxizi sunt amfoteri: Al(OH)3, Zn(OH)2, Cr(OH)3, Be(OH)2, Ge(OH)2, Sn(OH)4, Pb(OH)2 etc.
Formula unui hidroxid amfoter este de obicei scrisă folosind formula bazei Me(OH)n, dar poate fi reprezentată și ca acid HnMeOm. De exemplu, Zn(OH)2 – hidroxid de zinc sau H2ZnO2 – acid de zinc; Al(OH)3 – hidroxid de aluminiu sau НAlO2 – acid meta-aluminiu (Н3AlO3 – acid orto-aluminiu).
Proprietățile chimice ale hidroxizilor amfoteri
Datorită dualității lor, hidroxizii amfoteri sunt capabili să reacționeze atât cu acizii, cât și cu alcalii.
1. La interacțiunea cu acizii puternici se formează sare și apă; în acest caz, hidroxidul amfoter prezintă proprietăți de bază.
2. La interacțiunea cu baze puternice (alcalii), se formează sare și apă; în acest caz, hidroxidul amfoter prezintă proprietăți acide și forma sa acidă trebuie utilizată în ecuație.
H2ZnO2 + 2 NaOH → Na2ZnO2 + 2 H2O
zincat de sodiu
НAlO2 + NaOH NaAlO2 + H2O (fuziune)
metaaluminat de sodiu
3. Cu soluții apoase de alcaline, hidroxizii amfoteri formează compuși complecși:
Zn(OH)2 + 2 NaOH → Na2
Hidroxizii amfoteri sunt compuși insolubili. Prepararea hidroxizilor amfoteri este posibilă numai indirect - prin reacția alcalinelor cu sărurile metalelor corespunzătoare.
CuSO4 + 2 NaOH → Cu(OH)2¯ + Na2SO4
Acizi
Acizii sunt electroliți care se disociază într-o soluție apoasă pentru a forma cationul de hidrogen H+ și un anion rezidual acid.
Denumiri de acizi
În general, formula acidă este scrisă ca НmЭ sau НmЭОn, unde E este elementul care formează acid.
După compoziția lor chimică, și anume absența sau prezența atomilor de oxigen în molecule, acizii se împart în oxigenați (H2SO4, HNO3) și fără oxigen (H2S, HF, HCl).
Acizii au denumiri tradiționale și sistematice, compilate conform regulilor de nomenclatură IUPAC pentru compuși complecși.
Denumirea tradițională a acidului este alcătuită din două cuvinte. Primul cuvânt este un adjectiv cu o rădăcină din numele rusesc al unui element care formează acid, al doilea este cuvântul „acid”, de exemplu, acid sulfuric, acid azotic. În denumirile acizilor care conțin oxigen, următoarele sufixe sunt folosite pentru a indica gradul de oxidare a elementului care formează acid:
–n, –ov, –ev – (cel mai mare sau orice stare de oxidare unică), cum ar fi HClO4 – acid percloric, H2SO4 – acid sulfuric, HMnO4 – acid mangan; H2SiO3 – acid metasilicic.
–novate – (stare intermediară de oxidare +5), ca HClO3 – acid percloric, HIO3 – acid iod, H2MnO4 – acid permanganat.
–ovist, –ist – (stare intermediară de oxidare +3, +4), ca H3AsO3 – acid ortoarsenos; HClO2 – clorura; HNO2 – azotat.
–novatist – (cel mai mic grad pozitiv +1), ca HClO – hipocloros.
Dacă un element în aceeași stare de oxidare formează mai mulți acizi care conțin oxigen, atunci numele acidului cu un conținut mai mic de atomi de oxigen este adăugat cu prefixul „meta”, cu cel mai mare număr - prefixul „orto”: HPO3 - acid metafosforic, H3PO4 - acid ortofosforic (fosforul în starea de oxidare este +5).
Numele acizilor fără oxigen sunt derivate din numele nemetalului cu terminația „o” și adăugarea cuvântului hidrogen:
HF – acid fluorhidric sau acid fluorhidric
HCl – acid clorhidric sau clorhidric
Denumiri de acizi și reziduuri acide
Denumirea acidului | Reziduu acid | Nume |
|
Azotat | Ioni de nitrit |
||
Ioni de nitrat |
|||
Ortoborică | Ion ortoborat |
||
Metasiliciul | Ion metasilicat |
||
Mangan | Ioni de permanganat |
||
Ortoarsenic | Ion ortoarsenat |
||
Ortoarsenic | Ion de ortoarsenit |
||
Ioni sulfat |
|||
Sulfuros | Ioni sulfit |
||
Sulfat de hidrogen | Ioni sulfuri |
||
Tiosulf | ion tiosulfat |
||
Cărbune | Ion carbonat |
||
Metafosforic | Ion metafosfat |
||
Ortofosforic | Ion ortofosfat |
||
Difosfor (pirofosforic) | Difosfat (pirofosfat) |
||
Fosfor | Ioni de fosfit |
||
Ion de perclorat |
|||
Clorură | Ion de clorit |
||
Crom | Ioni de cromat |
||
Clorhidric | Ion clor |
||
Bromhidric | Ion de bromură |
||
Hidroidură | Ion de iodură |
||
Oţet | Ion acetat |
||
Acid cianhidric | Ioni de cianura |
Metode de producere a acizilor
1. Interacțiunea oxidului acid cu apa. De exemplu:
SO2 + H2O → H2SO3
Excepțiile sunt SiO2, TeO2, TeO3, MoO3, WO3, care nu interacționează cu apa.
2. Dacă oxidul acid nu este solubil în apă, atunci acizii corespunzători se obțin indirect și anume prin acțiunea unui alt acid asupra sării corespunzătoare. De exemplu:
Na2SiO3 + H2SO4 → Na2SO4 + H2SiO3¯
3. Acizii fără oxigen se obțin prin reacția nemetalelor cu hidrogenul și apoi dizolvarea produselor în apă. De exemplu:
H2(g) + Cl2(g) → 2 HCl(g)
Proprietățile chimice ale acizilor
Acizii sunt lichide (H2SO4, HNO3) sau solide (H3PO4). Mulți acizi sunt foarte solubili în apă. Soluțiile apoase de acizi au un gust acru și schimbă culoarea indicatorilor: turnesolul primește o culoare roșie, metil portocaliu are o culoare roz.
1. Proprietățile electrolitice ale acizilor. Conform teoriei disocierii electrolitice, acizii sunt substanțe care se disociază în soluții apoase pentru a forma ioni de hidrogen H+, care determină toate proprietățile generale ale acizilor (gustul acru al soluțiilor, colorarea roșu de turnesol, interacțiunea cu metalele etc.).
Numărul de ioni de hidrogen ai unui acid care pot fi înlocuiți cu cationi metalici determină bazicitatea acestui acid și numărul de etape de disociere. Deci HCl, H2SO4, H3PO4 sunt exemple de acizi unu, doi și tribazici.
Disocierea acidului clorhidric monobazic HCI are loc într-o singură etapă:
HCl « H+ + Cl–
Ea corespunde unui reziduu acid – ionul clorură Cl–.
Acidul carbonic, fiind un acid dibazic, se disociază în două etape cu formarea de reziduuri acide:
Н2СО3 « Н+ + НСО3– ion hidrocarbonat
HCO3– « H+ + CO32– ion carbonat
Acidul ortofosforic H3PO4 se disociază în trei etape pentru a forma trei resturi acide:
H3PO4 « H+ + H2PO4– ion dihidroortofosfat
H2PO4– « H+ + HPO42– ion hidroortofosfat
HPO42– « H+ + PO43– ion ortofosfat
Dacă reziduul acid conține un ion de hidrogen, atunci prefixul „hidro” este adăugat la numele său, dacă doi ioni de hidrogen – „dihidro”.
2. Interacțiunea cu bazele, rezultând formarea de sare și apă.
HCl + NaOH → NaCl + H2O
3. Interacțiunea cu oxizii bazici.
2 HCl + CaO → CaCl2 + H2O
4. Interacțiunea cu sărurile. Acizii reacţionează cu sărurile dacă rezultă formarea unui acid mai slab, a unui compus uşor solubil sau volatil.
H2SO4 + BaCl2 → BaSO4¯ + 2 HCl
4. Interacțiunea acizilor cu metalele (cu formarea de săruri și eliberarea de hidrogen).
2 HCl + Fe → FeCl2 + H2
Metalele cu un potențial de electrod standard mai mare decât hidrogenul nu interacționează cu acizii. Când metalele interacționează cu acidul sulfuric concentrat, acidul azotic concentrat și diluat, hidrogenul nu este eliberat.
Săruri
Sărurile sunt electroliți care se disociază într-o soluție apoasă pentru a forma cationi ai reziduurilor bazice și anioni ai reziduurilor acide.
Formule și denumiri de săruri
Compoziția unei sări este descrisă printr-o formulă în care formula cationului este plasată pe primul loc, iar formula anionului pe locul al doilea. Denumirile sărurilor se formează din denumirea reziduului acid (în cazul nominativ) și denumirea reziduului bazic (în cazul genitiv) care alcătuiesc sarea. Starea de oxidare a metalului care formează cationul este indicată cu cifre romane între paranteze, dacă este necesar. De exemplu, K2S este sulfura de potasiu, FeSO4 este sulfat de fier (II), Fe2(SO4)3 este sulfat de fier (III).
Anionul acidului anoxic are terminația „ide”. De exemplu, FeCl3 este clorură de fier (III).
Numele sărurilor acide se formează în același mod ca și cele medii, dar la numele anionului se adaugă prefixul „hidro”, indicând prezența atomilor de hidrogen, al căror număr este indicat de cifrele grecești: di , trei și. etc. De exemplu: Fe(HSO4)3 – hidrogen sulfat de fier (III), NaH2PO4 – dihidrogen fosfat de sodiu.
Numele principalelor săruri sunt formate în același mod ca și cele din mijloc, dar la numele cationului se adaugă prefixul „hidroxo”, indicând prezența grupărilor hidroxo, al căror număr este indicat de cifrele grecești: di, trei și. etc. De exemplu: (CuOH)2CO3 – carbonat de hidroxicupru (II), Fe(OH)2Cl – clorură de dihidroxifer (III).
Sărurile sunt împărțite în medii, acide și bazice.
Săruri medii (normale). nu conțin în moleculă nici atomi de hidrogen, nici grupări hidroxo. Ele se disociază aproape complet (nu treptat), formând cationi metalici și anioni ai reziduului acid:
K2S « 2 K+ + S2–
AlCl3 « Al3+ + 3 Cl–
Sărurile medii pot fi obținute prin înlocuirea completă a atomilor de hidrogen din moleculele acide cu atomi de metal sau prin înlocuirea completă a grupărilor hidroxil în baze cu reziduuri acide. De exemplu:
Zn(OH)2 + H2SO4 → ZnSO4 + 2 H2O
Săruri acide– acestea sunt săruri al căror reziduu acid conține hidrogen, de exemplu, KHS, Fe(HSO4)3. Astfel de săruri se disociază treptat. Mai întâi (în stadiul I), sarea este complet disociată în cationi metalici și anioni ai reziduului acid:
KHS « K+ + HS– (disocierea completă)
Apoi, reziduul acid se disociază într-o măsură mai mică (parțial), eliminând treptat cationii de hidrogen:
HS– « H+ + S2– (disocierea parțială)
După proprietățile lor, sărurile acide sunt compuși intermediari între sărurile intermediare și acizi. La fel ca acizii, ei sunt de obicei foarte solubili în apă și sunt capabili să neutralizeze reacțiile.
Sărurile acide sunt formate numai de acizi polibazici în cazul înlocuirii incomplete a atomilor de hidrogen din acid cu atomi de metal (acid în exces). De exemplu:
NaOH + H2SO4 → NaHSO4 + H2O
sulfat acid de sodiu
Acizii monobazici (HCl, HNO3) nu formează săruri acide.
Săruri de bază– acestea sunt săruri ai căror cationi conțin una sau mai multe grupări hidroxo, de exemplu, (CuOH)2CO3, (FeOH)Cl2.
Sărurile de bază, precum cele acide, se disociază treptat. În etapa I, are loc disocierea completă în cationi ai reziduului bazic și anioni ai reziduului acid și apoi are loc disocierea parțială a reziduului bazic. De exemplu, carbonatul de hidroxicupru (II) se disociază complet în prima etapă:
(CuOH)2CO3 « 2 CuOH+ + CO32–, (disocierea completă)
apoi reziduul principal se disociază parțial ca un electrolit slab în ioni:
CuOH+ « Cu2+ + OH– (disocierea parțială)
De regulă, sărurile bazice sunt ușor solubile și, atunci când sunt încălzite, se descompun odată cu eliberarea de apă.
Sărurile bazice sunt formate numai din baze poliacide în cazul înlocuirii incomplete a grupărilor hidroxo ale bazei cu reziduuri acide (bază în exces). De exemplu:
Mg(OH)2 + HCI → MgOHCI + H2O
clorură de hidroxomagneziu
Obținerea sărurilor
Sărurile medii pot fi obținute prin interacțiunea unor substanțe:
1. metal cu nemetal. De exemplu:
2. metal cu acid. De exemplu:
Zn + 2 HCl → ZnCl2 + H2
3 Zn + 4 H2SO4(conc.) → 3 ZnSO4 + S + 4 H2O
3. oxid bazic cu acid. De exemplu:
CuO + H2SO4 → CuSO4 + H2O
4. oxid acid cu baze. De exemplu:
CO2 + Ca(OH)2 → CaCO3 + H2O
5. baze cu acid (reacție de neutralizare). De exemplu:
Ca(OH)2 + 2 HCI → CaCl2 + 2 H2O
6. două săruri diferite. De exemplu:
Na2SO4 + BaCl2 → BaSO4¯ + 2 NaCl
7. alcaline cu săruri. De exemplu:
3 KOH + FeCl3 → 3 KCl + Fe(OH)3¯
8. deplasarea unui metal pasiv dintr-o soluție a sării sale de către un metal mai activ (în conformitate cu un număr de tensiuni metalice). De exemplu:
Fe + CuSO4 → FeSO4 + Cu
9. interacţiunea unui oxid acid cu unul bazic. De exemplu:
CaO + SiO2 → CaSiO3
Sărurile acide pot fi obținute:
1. când warping reacţionează cu excesul de acid sau oxid acid. De exemplu:
Pb(OH)2 + 2 H2SO4 → Pb(HSO4)2 + 2 H2O
Ca(OH)2 + 2CO2 → Ca(HCO3)2
2. când o sare medie interacționează cu un acid, al cărui reziduu acid face parte din această sare. De exemplu:
PbSO4 + H2SO4 → Pb(HSO4)2
Se obțin principalele săruri:
Când un acid reacţionează cu un exces de bază. De exemplu:
HCl + Mg(OH)2 → MgOHCI + H2O
Când sarea medie interacționează cu alcalii:
Bi(NO3)3 + 2 NaOH → Bi(OH)2NO3 + 2 NaNO3
Sărurile acide sau bazice se formează prin hidroliza sărurilor intermediare:
Na2CO3 + H2O → NaHCO3 + NaOH
Al2(SO4)3 + H2O → 2 AlOHSO4 + H2SO4
Proprietățile chimice ale sărurilor
1. Într-o serie de potențiale standard ale electrodului, fiecare metal anterior le înlocuiește pe cele ulterioare din soluțiile sărurilor lor. De exemplu:
Zn + Hg(NO3)2 → Zn(NO3)2 + Hg
Sărurile interacționează cu alcalii. De exemplu:
CuSO4 + 2 NaOH → Cu(OH)2¯ + Na2SO4
Sărurile reacţionează cu acizii:
CuSO4 + H2S → CuS¯ + H2SO4
Multe săruri interacționează între ele:
CaCl2 + Na2CO3 → CaCO3¯ + 2 NaCl
Când elaborați ecuații chimice pentru reacții, trebuie să vă amintiți că o reacție are loc dacă unul dintre produsele rezultate precipită, este eliberat sub formă de gaz sau este un compus ușor disociat.
Transformarea sărurilor acide și bazice în săruri intermediare
1. Interacțiunea unei sări acide cu un hidroxid din același metal:
KHSO4 + KOH → K2SO4 + H2O
2. Interacțiunea unei sări acide cu o sare a aceluiași metal, dar a unui acid diferit:
KHSO4 + KСl → K2SO4 + HCl
3. Descompunerea termică a sărurilor acide:
Ca(HCO3)2 → CaCO3 + CO2 + H2O
4. Interacțiunea sării bazice cu acidul corespunzător:
2 FeOHSO4 + H2SO4 → Fe2(SO4)3 + 2 H2O
Starea de oxidare
Când se clasifică diferite substanțe, se elaborează formule ale compușilor chimici și se descrie proprietățile acestora, se utilizează o caracteristică a stării atomilor elementelor - gradul de oxidare. Starea de oxidare este o caracteristică cantitativă a stării atomului unui element dintr-un compus.
Starea de oxidare este sarcina condiționată a unui atom dintr-o moleculă a unui compus chimic, calculată pe ipoteza că toate moleculele unui compus chimic constau din ioni, adică perechile de electroni obișnuite merg la elementul cel mai electronegativ.
Numărul de oxidare poate fi un număr negativ, un număr pozitiv sau zero. Numărul de oxidare este indicat cu cifre arabe cu semnul (+) sau (–) în fața numărului și este scris deasupra simbolului elementului în formula unui compus chimic.
O valoare negativă a stării de oxidare este atribuită atomului care a atras electroni la sine, iar valoarea acestuia, egală cu numărul de electroni atrași, este marcată cu semnul (-).
O stare de oxidare pozitivă este determinată de numărul de electroni extrași dintr-un atom dat și este marcată cu semnul (+).
Când se calculează stările de oxidare ale atomilor, se utilizează următorul set de reguli:
1) în moleculele de substanţe simple starea de oxidare a unui atom este zero;
2) hidrogenul din compușii cu nemetale are o stare de oxidare (+1), cu excepția hidrurilor în care starea de oxidare a hidrogenului este (–1);
3) oxigenul din toți compușii complecși are o stare de oxidare (–2), cu excepția OF2 și a diferiților compuși peroxid.
4) fluorul, ca element cel mai electronegativ, are o stare de oxidare (–1) în toți compușii;
5) halogenii din compușii cu hidrogen și metale prezintă o stare de oxidare negativă (–1), iar cu oxigenul prezintă o stare de oxidare pozitivă, cu excepția fluorului.
6) toate metalele din compușii lor se caracterizează numai prin stări de oxidare pozitive, inclusiv metalele alcaline au o stare de oxidare (+1), iar metalele alcalino-pământoase – (+2);
7) suma stărilor de oxidare ale tuturor atomilor dintr-o moleculă este egală cu zero, suma stărilor de oxidare ale tuturor atomilor dintr-un ion complex este egală cu sarcina acestui ion.
Și derivatele lor. Toate celelalte substanțe sunt anorganice.
Clasificarea substantelor anorganice
Substanțele anorganice sunt împărțite în simple și complexe în funcție de compoziția lor.
Substanțele simple constau din atomi ai unui element chimic și sunt împărțite în metale, nemetale și gaze nobile. Substanțele complexe constau din atomi de diferite elemente legați chimic între ele.
Substanțele anorganice complexe, după compoziția și proprietățile lor, se împart în următoarele clase importante: oxizi, baze, acizi, hidroxizi amfoteri, săruri.
Conținutul lecției notele de lecție sprijinirea metodelor de accelerare a prezentării lecției cadru tehnologii interactive Practică sarcini și exerciții ateliere de autotestare, instruiri, cazuri, întrebări teme pentru acasă întrebări de discuție întrebări retorice de la elevi Ilustrații audio, clipuri video și multimedia fotografii, imagini, grafice, tabele, diagrame, umor, anecdote, glume, benzi desenate, pilde, proverbe, cuvinte încrucișate, citate Suplimente rezumate articole trucuri pentru pătuțurile curioși manuale dicționar de bază și suplimentar de termeni altele Îmbunătățirea manualelor și lecțiilorcorectarea erorilor din manual actualizarea unui fragment dintr-un manual, elemente de inovație în lecție, înlocuirea cunoștințelor învechite cu altele noi Doar pentru profesori lecții perfecte plan calendaristic pentru anul; recomandări metodologice; programe de discuții Lecții integratePentru elementele incluse în tabelul periodic (PS) al elementelor D.I. Mendeleev are voie să folosească următoarele nume de grup, care, de regulă, reflectă proprietățile generale ale elementelor și substanțelor simple. Pentru elemente principalele subgrupuriîn versiunea PS pe termen scurt
sau 1-2 și 13-18 grupeîn versiunea de lungă durată (modernă) a PS

- alcalin metale (grupa I sau IA): (H), Li, Na, K, Rb, Cs, Fr;
- alcalino-pământos(cu excepția Mg) metale (grupa a 2-a sau IIAg): Be, Mg, Ca, Sr, Ba, Ra;
- elemente subgrupuri de bor(grupa a 13-a sau IIIA), metalele (pupa cu bor), nu au o denumire specială: B, Al, Ga, In, Ti;
- elemente subgrupe de carbon(grupul 14 sau IVA) sau cristalogeni: C, Si, Ge, Sn, Pb;
- elemente subgrupe de azot(grupul 15 sau VA), nume învechit pnicogeniși derivatul său -pnictide: N, P, As, Sb, Bi;
- elemente subgrupe de oxigen(grupul 16 sau VIA) saucalcogeni ,
- halogeni(grupul 17 sau VIIA),
- nobil sau inertgaze (grupa 18 sau VIIIA)
Pentru elemente subgrupuri laterale:
- lantanide(La – Lu),
- actinide(Ac – Lr) (nu se recomandă denumirile lantanide și actinide);
- metale pământuri rare(grupa a 3-a sau IIIB, cu excepția actinidelor);
- familia fierului(Fe, Co, Ni);
- familia platinei sau metale platinei(Ru, Rh, Pd, Os, Ir, Pt);
- metale pretioase(Au, Ag + platină: Ru, Rh, Pd, Os, Ir, Pt)
- elemente de tranziție(elementele d și f, adică toate elementele subgrupurilor laterale).
Substanțele simple sunt de obicei denumite în același mod ca și elementele corespunzătoare. Au doar propriile nume modificări alotropice carbon (diamant, grafit, carbyne, fulerene) și a doua modificare a oxigenului (ozon). La denumirea modificărilor alotropice ale altor elemente sunt de obicei indicate caracteristicile lor fizice scurte (fosfor alb, roșu, negru, sulf cristalin și plastic, staniu gri și alb etc.).
Elementele oxigen, azot, carbon și sulf din compușii cu metale sau cu nemetale mai puțin electronegative pot forma anioni nu numai în stările lor de oxidare negative caracteristice ($O^(2-), S^(2-), N^( 3- ), C^(4-)$, dar și ioni în care starea de oxidare a elementului depinde de numărul de atomi din structurile „punte”. Starea de oxidare a carbonului din compușii organici este determinată prin metode speciale ( vezi subiectul „Determinarea stării de oxidare a carbonului”). De exemplu, elementul oxigen poate forma ioni de peroxid și superoxid, în care atomii de oxigen formează „punți de oxigen” -O-O- sau -O-O-O-. Astfel de anioni au propriile nume : $(O_2)^(2-)$ - peroxid; $ (O_2)^-$ - superoxid; $(O_3)^-$ - ozonidă; $(N_3)^-$ - azidă; $(C_2)^( 2-)$ - acetilenidă; $(S_2)^(2- )$ - disulfură; $(Sn)^(2-)$ - polisulfură.
Denumirile unor anioni stabili, formați din atomi ai mai mult de un element, au în mod tradițional și terminația -ide: $(OH)^-$ - hidroxid; $(CN)^-$ - cianura; $(CN_2)^(2-)$ - cianamidă; $(NH_2)^-$ - amida; $(NH)^(2-)$ - imidă; $(SCN)^-$ - tiocianat.
CLASIFICAREA SUBSTANȚELOR ANORGANICE
Principiile generale de clasificare a substanțelor anorganice sunt prezentate în diagramă. Pe baza acestei clasificări, toate substanțele anorganice pot fi împărțite în simple și complexe.
Definiție
Substanțe simple constau din atomi de elemente identice și sunt împărțite în metale, nemetale și gaze inerte.
Substanțe complexe constau din atomi de diferite elemente legați chimic între ele.
La rândul lor, pe baza proprietăților comune, substanțele anorganice complexe pot fi împărțite în patru clase principale: compuși binari, oxizi, hidroxizi și săruri.
Clasificarea și nomenclatura compușilor binari este discutată în detaliu în subiectul „Compuși binari”.

CLASIFICAREA SI CARACTERISTICI ALE PROPRIETATILOR OXIZILOR
Definiție
Oxizi se numesc compuși chimici binari constituiți din elemente metalice sau nemetalice și oxigen. Sau, cu alte cuvinte, oxizii sunt substanțe complexe formate din două elemente, dintre care unul este oxigenul.
Clasificarea oxizilor se bazează pe proprietățile chimice ale compușilor, determinate de structura chimică (adică tipul de legături formate și tipul rețelei cristaline, structura și caracteristicile electronice ale elementelor).
Oxizii diferă în ceea ce privește proprietățile fizice starea de agregare, puncte de topire și de fierbere, culoare, miros, solubilitate în apă.
După starea lor de agregare, oxizii sunt:
- solid (toți oxizii de metal, oxid de siliciu, oxid de fosfor),
- lichid (apă $H_2O$),
- gazos (aproape toți ceilalți oxizi nemetalici).
Pe baza proprietăților lor chimice, oxizii sunt împărțiți în care nu formează sare și care formează sare.
Definiție
care formează sare sunt oxizi capabili să formeze hidroxizi atunci când sunt combinați cu apa.
Acesta din urmă, la rândul său, poate prezenta proprietățile acizilor, bazelor sau poate avea proprietăți amfotere. Prin urmare, oxizii care formează sare sunt de obicei împărțiți în bazici, acizi și amfoteri.

CLASIFICAREA acizilor și bazelor
De la cursul inițial de chimie sunteți familiarizat cu următoarea definiție a acizilor și bazelor:
Definiție
Acizi- sunt substante complexe formate din atomi de hidrogen care pot fi inlocuiti cu atomi de metal si reziduuri acide. Formula generală a acizilor este: $H_x(Ac)^(-n)$, unde Ac este restul acid (acid - engleză acid), x este numărul de atomi de hidrogen, n este starea de oxidare a reziduului acid. În acizi x=n.
Definiție
Terenuri(hidroxizii) sunt substanțe complexe formate din atomi de metal și una sau mai multe grupări hidroxil (-OH). Formula generală a bazelor este: $M^(+n)(OH)_x$, unde n este starea de oxidare a metalului, x este numărul de grupări hidroxil. n=x.
Trebuie remarcat faptul că atât bazele, cât și acizii aparțin clasei de hidroxizi, deoarece conțin grupări hidroxo (-OH). Prin urmare, acizii se numesc și hidroxizi acizi, iar bazele sunt numite hidroxizi bazici.
Interacțiunile acido-bazice sunt extrem de comune în natură și sunt utilizate pe scară largă în practica științifică și industrială. Teoria acizilor și bazelor este un set de concepte fundamentale fizice și chimice care descriu natura și proprietățile acizilor și bazelor. Pe lângă definiția obișnuită a clasei a VIII-a, există și alte teorii:
| Teorie | Conţinut | Exemple |
|---|---|---|
| Teoria Arrhenius a disocierii electrolitice |
Acizi- sunt substanțe care formează ioni într-o soluție apoasă - cationi de hidrogen hidratați $H^+$ (ioni de hidroniu $H_3O$) și anioni ai reziduului acid, sau cu alte cuvinte, aceștia sunt electroliți care se disociază în cationi de hidrogen și anioni de reziduul acid. Terenuri- substanţe electrolitice complexe care se disociază formând un ion hidroxid şi un cation metalic. |
$NaOH \Leftrightarrow Na^+ + OH^-$ bază $HNO_3 \Leftrightarrow H^+ + NO_3^-$ acid |
| Teoria protolitică a lui Bronsted |
Acizi- acestea sunt substanțe complexe care, ca urmare a rupturii heterolitice, eliberează o particulă cu sarcină pozitivă - un proton de hidrogen (acid Brønsted) Baza este un compus chimic capabil să formeze o legătură covalentă cu un proton (bază de Bronsted) |
$HCl + NH_3 = NH_4^+ + Cl^-$ la principal la principal |
| teoria lui Lewis |
Acid- o moleculă sau ion care are orbitali de electroni liberi și este un acceptor de perechi de electroni (acid Lewis) Baza este un compus chimic care poate forma o legătură covalentă cu un orbital vacant al altui compus chimic |
|
Acest subiect este descris mai detaliat în secțiunea „Conceptele moderne ale structurii și proprietăților acizilor și bazelor”.
Clasificarea acizilor
se realizează conform următoarelor caracteristici formale:
1. prin elementare, adică numărul de atomi de hidrogen: unu- ($HCl$), doi- ($H_2S$) și trei baze ($H_3PO_4$);
2. prin prezenta atomilor de oxigen: conţinând oxigen ($H_2CO_3$) şi fără oxigen (HCL);
3. prin putere, adică grade de disociere: puternic ($HCl, HNO_3, H_2SO_4, HClO_4$ etc.), slab ($H_2S, H_2CO_3, CH_3COOH$ etc.)
4. din punct de vedere al stabilitatii: persistent ($H_2SO_4$); instabil ($H_2CO_3$).
5. după clase de compuși chimici: anorganic (HBr); organic ($HCOOH,CH_3COOH$);
6.prin volatilitate: volatil ($HNO_3,H_2S, HCl$); nevolatil ($H_2SO_4$);
7. prin solubilitate în apă: solubil ($H_2SO_4$); insolubil ($H_2SiO_3$);
Clasificarea bazelor
se realizează conform următoarelor caracteristici formale::
1. prin aciditate(număr de grupe hidroxil): monoacid (NaOH), diacid ($Ca(OH)_2$), triacid ($Al(OH)_3$)
2. prin solubilitate: alcaline sau baze solubile ($KOH, NaOH$), insolubile ($Mg(OH)_2, Cu(OH)_2$)
3. prin putere(grade de disociere): puternic (NaOH), slab ($Cu(OH)_2$)
** Nu confundați rezistența unei baze cu solubilitatea acesteia. De exemplu, hidroxidul de calciu este o bază puternică, deși solubilitatea sa în apă nu este mare. În acest caz, o bază puternică (alcalină) este considerată a fi acea parte a hidroxidului de calciu care este dizolvată în apă.
HIDROXIZI AMFOTERICI
Definiție
Hidroxizi amfoteri- sunt substanțe complexe care prezintă atât proprietățile acizilor, cât și proprietățile bazelor.
Formula hidroxizilor amfoteri poate fi scrisă atât sub formă acidă, cât și sub formă de bază, de exemplu: hidroxidul de aluminiu poate fi scris sub formă de bază ca $Al(OH)_3$. Dacă numărați numărul total de atomi de hidrogen și oxigen, puteți scrie: $H_3ALO_3$ sau cea mai simplă formulă - $HAlO_2$.
Oxizii și hidroxizii amfoteri sunt formați din elemente amfoterice. Tine minte! Elementele metaloide prezintă proprietăți amfotere: Al, Zn, B, Be, Fe(III), Cr (III)și alte câteva elemente de tranziție care au stări de oxidare diferite și sunt situate pe diagonala amfoteră din PS (vezi subiectul „Sistemul periodic ca notație convențională a legii periodice”). Metalele din grupul A care formează diagonala amfoteră din Tabelul periodic Be-Al-Ge-Sb-Po, precum și metalele adiacente acestora (Ga, In, Tl, Sn, Pb, Bi) nu prezintă metale tipice. proprietăți.

Manifestarea proprietăților dualității (amfotere), atât metalice (de bază), cât și nemetalice, se datorează naturii legăturii chimice.
CLASIFICAREA ȘI CARACTERISTICI ALE PROPRIETĂȚILOR SĂRII
Determinarea sărurilor, precum și determinarea acizilor și bazelor, are mai multe opțiuni. În cursul școlii de clasa a VIII-a, definiția sărurilor este următoarea:
Definiție
Săruri - acestea sunt substanțe complexe formate din cationi metalici (ion de amoniu) și anioni de reziduuri acide. Formula generală a sărurilor este: $M^(+n)_xAc^(m-)_y$, unde n, m sunt stările de oxidare ale metalului și restul acid, x, y sunt numărul de atomi de metal și reziduu acid, respectiv. m=x și n=y
Această definiție se referă la sărurile intermediare care se formează ca urmare a unei reacții de neutralizare între un acid și o bază, adică pot fi obținute prin interacțiunea acizilor și bazelor cu eliberarea de apă. Prin urmare, o definiție mai precisă a sărurilor medii:
Definiție
Săruri medii- acestea sunt produsele înlocuirii complete a atomilor de hidrogen dintr-o moleculă de acid cu atomi de metal sau înlocuirea completă a grupărilor hidroxo într-o moleculă de bază cu reziduuri acide.
Din punctul de vedere al teoriei disocierii electrolitice (DE):
Săruri- sunt substanțe complexe care se disociază în soluții apoase în cationi metalici și anioni ai reziduurilor acide.
Uniunea Internațională de Chimie Pură și Aplicată (IUPAC) definește sărurile ca fiind compuși chimici constând din cationi și anioni.
Astfel, clasificarea sărurilor poate fi efectuată:
1.prin solubilitate: solubil, ușor solubil și insolubil (puteți determina din care grupă aparține sarea folosind tabelul de solubilitate)
2. prin gradul de substituţie a ionilor de hidrogen şi grupărilor hidroxil: mediu, acru, de bază, dublu, mixt. Subiectul este discutat mai detaliat în secțiunea „Clasificarea și nomenclatura sărurilor”.
Tabelul oferă exemple și definiții ale sărurilor acide și bazice.
| in medie | acru | de bază | dubla | |
|---|---|---|---|---|
| Produs de înlocuire completă a hidrogenului acid cu metal | Produs de înlocuire incompletă a hidrogenului acid cu metal (cunoscut numai pentru acizii polibazici) | Produs al înlocuirii incomplete a grupărilor hidroxil ale unei baze cu un reziduu acid (cunoscut numai pentru bazele poliacide) | Produs al înlocuirii complete a atomilor de hidrogen ai unui acid di- sau polibazic cu două metale diferite | |
|
Na$_2$SO$_4$ sulfat de sodiu CuCl$_2$ clorură de cupru(II) $Ca_3(PO_4)_2$ ortofosfat de calciu |
sulfat acid de sodiu CaHPO$_4$ hidrogen ortofosfat de calciu Ca(H$_2$PO$_4$)$_2$ ortofosfat dihidrogen de calciu |
hidroxiclorura de cupru (II). Ca$_5$(PO$_4$)$_3$(OH) hidroxiortofosfat de calciu |
$NaKCO_3$ carbonat de sodiu de potasiu sulfat de aluminiu și potasiu |
O clasă mare separată este formată din săruri complexe, care aparțin unor compuși complecși.
Definiție
Conexiuni complexe sau compuși de coordonare- particule (molecule neutre sau ioni) care se formează ca urmare a atașării la un anumit ion (sau atom), numite agent de complexare, molecule neutre sau alti ioni numiti liganzi.
Sfera Interioară compus complex - un atom central cu liganzi asociați, adică, de fapt, o particulă complexă.
Sfera exterioară compus complex - particulele rămase asociate cu particula complexă prin legături ionice sau intermoleculare, inclusiv hidrogen.
De exemplu, luați în considerare structura sării complexe $K_3$ - hexacianoferrat de potasiu (III).

Sfera interioară este formată dintr-un ion de fier (III), deci este un agent complexant având o stare de oxidare de +3. În jurul acestui ion sunt coordonați șase ioni $CN^-$. Aceștia sunt liganzi, numărul de coordonare este șase. Sarcina totală a sferei interioare este egală cu: (+3)+ (-1)x6=(-3).
Sfera exterioară este formată din cationi de potasiu $K^+$. În conformitate cu sarcina sferei interioare, egală cu (-3), ar trebui să existe 3 ioni de potasiu în sfera exterioară.
Sărurile complexe având o sferă exterioară se disociază complet într-o soluție apoasă într-un cation sau anion complex cu disociere scăzută.
Compușii complecși fără sferă exterioară sunt insolubili în apă (de exemplu, carbonili metalici).
Substanțe simple. Moleculele sunt formate din atomi de același tip (atomi ai aceluiași element). În reacțiile chimice nu se pot descompune pentru a forma alte substanțe.
Substanțe complexe (sau compuși chimici). Moleculele constau din diferite tipuri de atomi (atomi ai diferitelor elemente chimice). În reacțiile chimice se descompun pentru a forma câteva alte substanțe.
Nu există o graniță ascuțită între metale și nemetale, deoarece Există substanțe simple care prezintă proprietăți duble.
alotropie
alotropie- capacitatea unor elemente chimice de a forma mai multe substanţe simple care diferă ca structură şi proprietăţi.
C - diamant, grafit, carabină.
O - oxigen, ozon.
S - rombic, monoclinic, plastic.
P - alb, roșu, negru.
Fenomenul de alotropie este cauzat de două motive:
1) numere diferite de atomi din moleculă, de exemplu oxigen O 2 și ozon O 3
2) formarea diferitelor forme cristaline, de exemplu diamant și grafit.
BAZELE
Terenuri- substanțe complexe în care atomii de metal sunt legați de una sau mai multe grupări hidroxil (din punctul de vedere al teoriei disocierii electrolitice, bazele sunt substanțe complexe, la disociarea cărora, în soluție apoasă, cationi metalici (sau NH 4 +) iar hidroxid - anioni OH - se formează) .
Clasificare. Solubil în apă (alcalii) și insolubil. Bazele amfotere prezintă, de asemenea, proprietățile acizilor slabi.
Chitanță
1. Reacțiile metalelor active (metale alcaline și alcalino-pământoase) cu apa:
2Na + 2H2O® 2NaOH + H2-
Ca + 2H2O® Ca(OH)2 + H2-
2. Interacțiunea oxizilor metalici activi cu apa:
BaO + H2O® Ba(OH)2
3. Electroliza soluțiilor apoase de sare
2NaCl + 2H2O® 2NaOH + H2- + CI2-
Proprietăți chimice
| Alcaline | Baze insolubile |
| 1. Acțiune asupra indicatorilor. | |
| turnesol - albastru metil portocaliu - galben fenolftaleină - zmeură |
-- |
| 2. Interacțiunea cu oxizii acizi. | |
| 2KOH + CO2® K2CO3 + H2O KOH + CO2® KHCO3 |
-- |
| 3. Interacțiunea cu acizii (reacție de neutralizare) | |
| NaOH + HNO3® NaNO3 + H2O | Cu(OH)2 + 2HCI® CuCl2 + 2H2O |
| 4. Reacția de schimb cu sărurile | |
| Ba(OH)2 + K2SO4® 2KOH + BaS04¯ 3KOH+Fe(NO 3) 3 ® Fe(OH) 3 ¯ + 3KNO 3 |
-- |
| 5. Descompunere termică. | |
| -- | Cu(OH)2 - t°® CuO + H2O |
OXIZI
Clasificare
Oxizi- acestea sunt substanțe complexe formate din două elemente, dintre care unul este oxigenul.
| OXIZI | |
| Neformatoare de sare | CO, N2O, NR |
| care formează sare | De bază - sunt oxizi metalici în care aceștia din urmă prezintă o mică stare de oxidare +1, +2 Na20; MgO; CuO |
| |
Amfoter (de obicei pentru metale cu stare de oxidare +3, +4). Hidroxizii amfoteri le corespund ca hidrați ZnO; Al203; Cr203; SnO2 |
| |
Acid - sunt oxizi de nemetale și metale cu o stare de oxidare de la +5 la +7 SO2; SO 3; P2O5; Mn207; CrO3 |
| |
Oxizii bazici bazele corespund acid- acizi, amfoter- și alea și altele |
Chitanță
1. Interacțiunea substanțelor simple și complexe cu oxigenul:
2Mg + O2® 2MgO
4P + 5O 2 ® 2P 2 O 5
S + O2® SO2
2CO + O2® 2CO2
2CuS + 3O 2 ® 2CuO + 2SO 2
CH4 + 2O2® CO2 + 2H2O
4NH 3 + 5O 2 - cat. ®4NO + 6H2O
2. Descompunerea unor substanțe care conțin oxigen (baze, acizi, săruri) la încălzire:
Cu(OH)2 - t°® CuO + H2O
(CuOH)2CO3 - t°® 2CuO + CO2 + H2O
2Pb(NO 3) 2 - t ° ® 2PbO + 4NO 2 + O 2
2HMnO4 - t°;H2SO4 (conc.) ® Mn2O7 + H2O
Proprietăți chimice
| Oxizii bazici | Oxizi acizi |
| 1. Interacțiunea cu apa | |
| Baza este formată: Na2O + H2O®2NaOH CaO + H2O® Ca(OH)2 |
Se formează acid: S03 + H2O® H2S04 P2O5 + 3H2O® 2H3PO4 |
| 2. Interacțiune cu acid sau bază: | |
| Când reacţionează cu acidul se formează sare și apă MgO + H2S04 - t°® MgS04 + H20 CuO + 2HCl - t°® CuCl2 + H2O |
Când reacționează cu o bază se formează sare și apă CO2 + Ba(OH)2® BaC03 + H20 SO2 + 2NaOH® Na2S03 + H2O |
| Oxizii amfoteri interacționează | |
| cu acizi ca baze: ZnO + H2SO4® ZnS04 + H2O |
cu baze ca acide: ZnO + 2NaOH® Na2ZnO2 + H2O (ZnO + 2NaOH + H2O® Na2) |
| 3. Interacțiunea oxizilor bazici și acizi între ei conduce la săruri. | |
| Na2O + CO2® Na2CO3 | |
| 4. Reducerea la substanțe simple: | |
| 3CuO + 2NH3® 3Cu + N2 + 3H2O P2O5 + 5C® 2P + 5CO |
|
Până în prezent, au fost identificați peste cinci sute de mii de compuși anorganici. Clasificarea și nomenclatura substanțelor anorganice este o problemă importantă care ne permite să înțelegem varietatea de compuși.
Referință istorică
În secolele XVIII-XIX, Antoine Lavoisier, Mihail Lomonosov și John Dalton au propus prima clasificare și nomenclatură a substanțelor anorganice. S-au distins cele simple, iar primul grup a fost împărțit în metale și nemetale. A fost izolat și un grup de compuși care aveau proprietăți intermediare, numite metaloizi. Această diviziune a stat la baza clasificării moderne.
În prezent există patru clase. Să aruncăm o privire mai atentă la fiecare dintre aceste clase.

Oxizi
Sunt compuși poliatomici care constau din două elemente, al doilea din ele este întotdeauna un ion de oxigen în starea de oxidare -2. Clasificarea și nomenclatura substanțelor anorganice implică împărțirea clasei de oxizi în trei grupe:
- de bază;
- amfoter;
- acid
Clasificare
Primul grup este format din compuși ai metalelor (cu stări minime de oxidare) cu oxigen. De exemplu, MgO este oxid de magneziu. Printre principalele proprietăți chimice ale acestui compus, se remarcă interacțiunea lor cu oxizi acizi, acizi și metale mai active.
Compușii oxigenați ai nemetalicilor, precum și elementele metalice cu stări de oxidare de la +4 la +7. De exemplu, acest grup include MnO2, CO2. Dintre cele tipice, evidențiază interacțiunea cu apa (se formează acid carbonic slab), oxizii bazici și bazele solubile (alcalii).
Oxizii amfoteri (de tranziție) sunt compuși metalici cu o stare de oxidare de +3 (precum și beriliu și oxid de zinc), care sunt capabili să interacționeze atât cu acizii, cât și cu alcalii.
Oxizii sunt împărțiți în care formează sare și care nu formează sare. Primul grup corespunde acizilor sau bazelor în care elementul principal își păstrează starea de oxidare. Grupul care nu formează sare este mic ca număr; reprezentanții săi nu sunt capabili să formeze săruri. De exemplu, printre oxizii care nu formează sare există: N2O, NO, SiO, CO.

Hidroxizi
Clasificarea și nomenclatura substanțelor anorganice presupune identificarea unei clase de hidroxizi. Ele sunt numite substanțe complexe care conțin atomi ai unui element, precum și grupări hidroxil OH. Această clasă este împărțită în două grupe mari:
- motive;
- acizi
Acizii conțin mai mulți atomi de hidrogen care pot fi înlocuiți cu atomi de metal supuși regulilor valenței stoechiometrice. Mulți sunt în formă meta, iar atomii lor de hidrogen sunt localizați la începutul formulei. Au forma generală HxEOy, unde a doua parte se numește reziduu acid. Clasificarea și nomenclatura lor sunt discutate ca parte a unui curs de chimie școlară. La acid sulfuric - sulfați, acid azotic - nitrați, acid carbonic - carbonați.
În funcție de numărul de atomi de hidrogen, se disting următoarele grupe:
- monobazic;
- dibazic;
- acizi tribazici
Bazele conțin cationi de metal și OH care pot fi înlocuiți în reacțiile chimice cu reziduuri acide, sub rezerva regulilor valenței stoechiometrice.
Bazele sunt în formă orto și au formula generală M(OH)n, cu n = 1 sau 2. La denumirea compușilor din această grupă, la hidroxid se adaugă metalul corespunzător.
Printre principalele proprietăți chimice pe care le posedă reprezentanții acestei clase de substanțe anorganice, este necesar să se remarce reacția lor cu acizii; produsele de reacție sunt apa și sarea.
De exemplu, în reacția hidroxidului de sodiu cu acidul clorhidric, produsele vor fi apă și clorură de sodiu.
În funcție de solubilitatea lor în apă, se disting bazele solubile (alcalii) și hidroxizii insolubili. Prima grupă include compuși hidroxil ai metalelor din prima și a doua grupă a subgrupurilor principale (metale alcaline și alcalino-pământoase).
De exemplu, NaOH este alcalin (hidroxid de sodiu); Fe(OH) 2 - hidroxid de fier II (compus insolubil).

Săruri
Ce mai include clasificarea și nomenclatura substanțelor anorganice? Temele pentru elevii din clasele 8-9 presupun împărțirea listei propuse de compuși în clase separate: oxizi, baze, acizi, săruri.
Sărurile sunt substanțe complexe care conțin cationi metalici și anioni ai unui reziduu acid. Sărurile medii au formula generală Mx(EOy) n. Un exemplu din acest grup este Ca 3 (PO 4) 2 - fosfat de calciu.
Dacă în compoziție apar și cationi de hidrogen, sărurile se numesc acide, iar prezența grupărilor hidroxil este caracteristică sărurilor bazice. De exemplu, NaHCO3 este bicarbonat de sodiu, iar CaOHCI este hidroxiclorura de calciu.
Acele săruri care conțin cationi ai două metale diferite se numesc săruri duble.
Sărurile complexe sunt compuși complecși care conțin un agent de complexare și liganzi. În liceu se are în vedere clasificarea și nomenclatura substanțelor anorganice. Teoria compușilor complecși este studiată în cadrul unui curs de specialitate de chimie generală. Întrebările referitoare la nomenclatura și proprietățile chimice ale sărurilor complexe nu sunt incluse în întrebările test ale examenului de stat unificat la chimie pentru cursul de liceu.

Concluzie
Cum se utilizează clasificarea și nomenclatura substanțelor anorganice în programa școlară? Grupele de substanțe sunt discutate pe scurt ca parte a curriculum-ului claselor a VIII-a și a IX-a și sunt studiate mai detaliat în cursul de chimie generală de clasa a XI-a. Sarcinile legate de clasificarea compușilor anorganici și compararea proprietăților chimice ale compușilor cu produsele propuse sunt incluse în testele finale de certificare în chimie (USE) pentru absolvenții clasei a XI-a. Pentru a le face față cu succes, studenții trebuie să aibă cunoștințe de bază privind clasificarea compușilor anorganici și abilitățile de a compara substanțele propuse cu proprietățile chimice ale întregii clase.