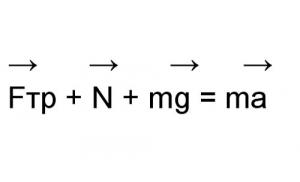Determinarea mediului într-o soluție chimică. Determinarea naturii mediului de soluție a acizilor și alcalinelor folosind indicatori. Reacții calitative la ionii în soluție (ionii de clorură, sulfat, carbonat, ion de amoniu). Obținerea de substanțe gazoase. Proprietăți chimice o
În funcție de care ioni H + sau OH - sunt în exces într-o soluție apoasă, se disting următoarele tipuri (caractere) de medii de soluție:
1) acru
2) alcalin
3) neutru
La natura acidă a mediului soluția conține un exces de cationi de hidrogen H +, iar concentrația ionilor de hidroxid este aproape de zero.
La mediu alcalin există un exces de ioni de hidroxid OH - în soluție, iar concentrația de cationi H + este aproape de zero.
La mediu neutru soluție, concentrațiile ionilor H + și OH - sunt egale între ele și practic egale cu zero (0,0000001 mol/l).
Există unele substanțe organice a căror culoare se schimbă în funcție de natura mediului. Acest fenomen este utilizat pe scară largă în chimie. Unii dintre cei mai comuni indicatori sunt turnesol, fenolftaleina și metil portocaliu (metil portocală). Culoarea acestor substanțe în funcție de natura mediului este prezentată în următorul tabel:
culoarea indicatorului |
|||
indicator |
într-un mediu neutru |
într-un mediu acid |
într-un mediu alcalin |
| turnesol | violet | roșu
|
albastru
|
| fenolftaleină | incolor | incolor | purpuriu
|
| metil portocală (orange de metil) |
portocale
|
roz
|
galben
|
După cum puteți vedea, o proprietate specifică a fenolftaleinei este că acest indicator nu permite să distingă mediile neutre și cele acide - în ambele medii nu este colorat în niciun fel. Această proprietate este, fără îndoială, un dezavantaj, totuși, fenolftaleina este utilizată pe scară largă datorită sensibilității sale excepționale chiar și la un mic exces de ioni OH -.
Evident, folosind indicatori puteți distinge acizi, alcalii și apa distilată unul de celălalt. Cu toate acestea, trebuie amintit că mediile acide, alcaline și neutre pot fi observate nu numai în soluții de acizi, alcaline și apă distilată. Mediul soluției poate fi, de asemenea, diferit în soluțiile sărate, în funcție de relația lor cu hidroliză.
De exemplu, o soluție de sulfit de sodiu poate fi distinsă de o soluție de sulfat de sodiu folosind fenolftaleină. Sulfitul de sodiu este o sare formată dintr-o bază tare și un acid slab, deci soluțiile sale vor avea o reacție alcalină. Fenolftaleina va deveni purpurie în soluția sa. Sulfatul de sodiu este format dintr-o bază tare și un acid tare, adică. nu suferă hidroliză, iar soluțiile sale apoase vor avea o reacție neutră. În cazul soluției de sulfat de sodiu, fenolftaleina va rămâne incoloră.
Subiectul lecției: Sarcini creative în variante GIA
Locația lecției: lecția generală în clasa a IX-a (în pregătirea examenului de stat la chimie).
Durata lectiei: (60 min.).
Conținutul lecției:
Lecția este împărțită structural în 3 părți, corespunzătoare întrebărilor din opțiunile GIA.
Obținerea de substanțe gazoase. Reacții calitative la substanțe gazoase (oxigen, hidrogen, dioxid de carbon, amoniac) (A 14).
Determinarea naturii mediului de soluție a acizilor și alcalinelor folosind indicatori. Reacții calitative la ionii în soluție (ionii de clorură, sulfat, carbonat, ion de amoniu) (A 14).
Proprietățile chimice ale substanțelor simple. Proprietățile chimice ale substanțelor complexe. Reacții calitative la ionii în soluție (ionii de clorură, sulfat, carbonat, ion de amoniu). Obținerea de substanțe gazoase. Reacții calitative la substanțe gazoase (oxigen, hidrogen, dioxid de carbon) (C 3).
În timpul lecției, profesorul folosește o prezentare multimedia: „Sarcini creative în variante GIA”, „Precauții de siguranță în lecțiile de chimie”, „Sarcini creative în variante GIA” pentru partea a 3-a a lecției.
Scopul lecției: Pregătiți elevii de clasa a IX-a pentru Examenul de Stat la Chimie pe probleme specifice.Scopul lucrării: consolidarea cunoștințelor despre proprietățile compușilor anorganici de diferite clase, despre reacțiile calitative la ioni.Aprofundarea cunoștințelor studenților despre chimie și dezvoltarea interesului pentru subiect.
Obiectivele lecției :
- Aprofundarea, sistematizarea și consolidarea,cunoștințele elevilor despre metodele de producere, colectare și proprietăți ale diferitelor gaze;
Dezvoltați capacitatea de a analiza, compara, generaliza și stabili relații cauza-efect;
Vă prezentăm metodologia de realizare a sarcinilor variantelor GIA pe această temă;
Dezvoltați abilitățile și abilitățile de a lucra cu reactivi chimici și echipamente chimice;
Promovarea dezvoltării abilităților de aplicare a cunoștințelor în situații specifice;
Lărgirea orizontului elevilor, creșterea motivației pentru învățare, socializarea elevilor prin activități independente;
Ajutați elevii să dobândească experiență reală în rezolvarea sarcinilor nestandardizate;
Dezvoltarea abilităților educaționale și de comunicare;
Să promoveze dezvoltarea abilităților copiilor în autoevaluarea și controlul activităților lor;
Ajutați elevii să se pregătească pentru intrarea în învățământul secundar.
Obiective pentru elevi:
Familiarizați-vă cu realizarea sarcinilor creative în variantele GIA (A-14, C3);
Învață să rezolvi probleme creative non-standard;
Exercitați controlul și autocontrolul activităților dvs.
(Elevii citesc).
Tip de lecție:
Lecție privind îmbunătățirea cunoștințelor, abilităților și abilităților (lecție despre formarea abilităților și abilităților, aplicarea direcționată a celor învățate în variantele GIA)
lectie de generalizare si sistematizare a cunostintelor;
combinate.
Forme de lucru:
Frontal, de grup, individual, colectiv.
Metode și mijloace de predare:munca independentă a elevilor, pe care o făceau acasă, la clasă,lucru individual, lucru în grup, experiență de laborator, lucru la bord, folosind TIC, fișe și obiecte abstracte din lume.
Eficacitatea lecției:
În timpul lecției, profesorul a creat condiții pentru activitatea activă a elevului, inclusiv activitatea creativă.
Echipament: baloane, baloane de săpun, carduri individuale, carduri de sarcini, teme practice, fișe de teme, fișă de reflecție, test „Cum am învățat materialul?”,computer, proiector, ecran,prezentări. Tabele: solubilitate, culoarea indicatorilor, determinarea ionilor. Mesele la tablă.
Reactivi: carbonat de sodiu, clorură de sodiu și sulfat de sodiu, acid clorhidric, azotat de argint, clorură de bariu, carbonat de calciu, apă, clorură de amoniu. Indicatori: metil portocală, fenolftaleină, turnesol).
Testează „Dispoziția noastră”
( Înainte de lecție, elevii sunt invitați să ia pătrate de orice culoare pe care copiii doresc să le ia):
Roșu – energic (gata de lucru).
Galbenul este culoarea bucuriei și a bunei dispoziții.
Albastrul este culoarea calmului și a echilibrului.
Green se plictisește, dar sper că această dispoziție se va schimba.
Maro – izolare.
Negrul este sumbru.
Motto-ul lecției: Cuvintele lui Goethe: „Nu este suficient să știi, trebuie și să aplici.
Nu este suficient să vrei, trebuie să o faci.”
În timpul orelor:
Încălzire:
Fondatorul teoriei disocierii electrolitice (Arrhenius).
Procesul de dezintegrare a unui electrolit în ioni se numește? (ED).
Ce substanțe se numesc electroliți? (Substanțe ale căror soluții apoase sau topituri conduc curentul electric).
Ionii încărcați pozitiv se numesc (cationi).
Ionii încărcați negativ se numesc (anioni).
Când alcalii se disociază, se formează ioni (ioni de hidroxid).
Enumerați condițiile pentru apariția reacțiilor de schimb ionic (reacțiile de schimb ionic se finalizează în trei cazuri: 1. În urma reacției, se formează un precipitat; 2. o substanță ușor disociabilă sau apă; 3. o substanță gazoasă este format) (răspunde elevul).
Când acizii se disociază, se formează ioni (ioni de hidrogen).
Prima parte a lecției.
Obținerea de substanțe gazoase. Reacții calitative la substanțe gazoase (oxigen, hidrogen, dioxid de carbon, amoniac)
Trebuie să știu:
Proprietățile fizice și chimice ale gazelor (hidrogen, oxigen, dioxid de carbon, amoniac).
Metode de colectare a gazelor.
Denumirea și funcționarea dispozitivelor de producere a gazelor
Principalele metode de obținere a gazelor în industrie și laboratoare
Identificarea gazelor ( reacții calitative) .
1. Varietate de gaze. Distribuiți gazele pe care le cunoașteți în grupuri (lucrare individuală - elevii finalizează sarcina pe bucăți separate de hârtie, răspunsurile sunt înregistrate pe ecran, se organizează testarea reciprocă, iar elevii sunt notați).
Formulele substanțelor gazoase sunt tipărite pe coli de hârtie și așezate în prealabil pe tablă:
O 2 ,CO,H 2 ,NU 2 , CO 2 , N 2 , N.H. 3 , H 2 S, CI 2 , HCI.
1) gaze – substanțe simple;
2) gaze - oxizi;
3) gaze colorate;
4) gaze cu miros caracteristic;
Răspuns: 1) Substanțe simple: N 2 , O 2 , H 2 ,Cl 2 .
2) Oxizi: CO, CO 2 ,NU 2 .
3) Gaze colorate: Cl 2 ,NU 2 .
4) Gaze cu miros caracteristic: Cl 2 ,NU 2 , N.H. 3 , H 2 S, HCI.
2. Stabiliți ce gaz umple mingea. Pentru a face acest lucru: Calculați densitatea aerului a gazelor care vi se oferă.
Pe tablă sunt suspendate baloane de diferite culori, situate la diferite înălțimi. În termen de 5 minute, elevii trebuie să stabilească ce gaz, dintre cele ale căror formule sunt enumerate mai jos, umple fiecare bilă: NH 3 , CO 2 , N 2 , DESPRE 2 .
Creăm grupuri. Fiecare grup primește propriul gaz (o bilă de o culoare diferită, corespunzătoare culorii cilindrilor în care este transportat gazul lichefiat. De exemplu, oxigenul: bila este albastră), ale căror proprietăți grupul le va determina. Grupa 1 - H 2 , grupa a 2-a - O 2 , grupa a 3-a - CO 2 , grupa a 4-a - NH 3 . Elevii dau și răspunsul: de ce sunt bilele situate la înălțimi diferite?
3. Experiență : De ce zboară în jos bulele de aer? (Pistol cu apă). Copiii dau răspunsul.
Lucrați în grupuri:
4. Numiți proprietățile fizice ale gazelor care vi se oferă. Scurt. (Lucrul în grupuri).
Oxigen-
Hidrogen -
amoniac -
Dioxid de carbon -
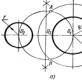
5.Răspundeți la întrebarea: Ce metode de colectare a gazelor cunoașteți? Să ne uităm la slide:
Dispozitive de colectare a gazelor.2) Ce gaze pot fi colectatedispozitiv din figura 1 și 2?
Care sunt mai ușoare decât aerul 1, mai grele - 2.
3) Ce gaze pot fi colectate cu dispozitivul din Figura 3?
Gaze care sunt insolubile în apă.
4) Ce număr de dispozitiv veți folosi pentru a colecta?
Grupa 1 - hidrogen? 2- oxigenul?
DESPRE  Lucrăm la această problemă conform instrucțiunilor Inspectoratului de Stat:
Lucrăm la această problemă conform instrucțiunilor Inspectoratului de Stat:
A) amoniac B) oxigen
C) dioxid de carbon D) hidrogen sulfurat

Producția a cărui gaz este prezentată în figură?
A) amoniac B) oxigen
C) dioxid de carbon D) hidrogen
6 . Vom elabora metode de laborator și industriale pentru producerea gazelor pe probleme GIA: (conform fișului, tabelul 1.)
LA  ce fel de gaz au?
ce fel de gaz au?
A) amoniac B) oxigen
C) dioxid de carbon D) hidrogen
 Ce gaz iei?
Ce gaz iei?
a) amoniac
B) oxigen
B) dioxid de carbon
D) hidrogen

Ce gaz iei?
a) amoniac
B) oxigen
B) dioxid de carbon
D) hidrogen

Ce gaz iei?
A) amoniac B) oxigen C) dioxid de carbon D) hidrogen
 Ce gaz iei?
Ce gaz iei?
A) amoniac B) oxigen
B) dioxid de carbon D) hidrogen
7 .Cum se disting gazele unele de altele?

Ce gaz se determină?
A) amoniac B) oxigen
C) dioxid de carbon D) hidrogen

Cu ce gaz sunt umplute baloanele?
A) hidrogen sulfurat B) oxigen
C) dioxid de carbon D) hidrogen

Ce gaz este transferat?
A) amoniac B) oxigen
C) dioxid de carbon D) hidrogen
O trăsătură distinctivă a sarcinilor A14 2012 au fost întrebările despre desene.
Astfel, în sarcinile GIA există următoarele întrebări despre desene:
Ce gaz se colectează? (Metode de colectare)
Ce gaz iei? (Metode de obținere)
Ce gaz se determină? (Identificare)
Prezentare
2.A doua parte a lecției.
Determinarea naturii mediului de soluție a acizilor și alcalinelor folosind indicatori.
Reacții calitative la ionii în soluție (ionii de clorură, sulfat, carbonat, ion de amoniu.
Reguli de siguranță (prezentare).
1. Experienta de laborator.
Măsuri de siguranță în lecțiile de chimie (prezentare multimedia)
Pe grupuri, identificați substanțele care vi se dau.
Grupa 1
HCI), alcaline (NaOH) si apa (H 2 O). Folosind substanțele date (metil portocaliu), determinați ce eprubetă conține fiecare substanță.
Grupa 2
Grupa 3
Anexa 1.2 (pentru grupa 1-3)
Lucrarea practică nr. 1
Obiectivele lecției:
Echipament: tablă, cretă, tabel „Determinarea naturii soluției de acizi și alcali folosind indicatori”, „Tabel de solubilitate a acizilor, bazelor, sărurilor în apă”, un suport cu eprubete, o lampă cu alcool, chibrituri, un suport pentru eprubete.
Reactivi: solutii: hidroxid de sodiu, acid clorhidric, apa, indicator - metil portocala.
Grupa 1
Trei eprubete sub numere conțin soluții: acizi (HCI), alcaline (NaOH) si apa (H 2 O). Folosind substanțele indicatoare date (metil portocală, fenolftaleină, turnesol), determinați ce eprubetă conține fiecare substanță.
Instructiuni de folosire.
Sarcina: trei eprubete numerotate (1, 2, 3) conțin următoarele substanțe: acizi (HCI), alcaline (NaOH) si apa (H 2 O).
Folosind reacții caracteristice, recunoașteți ce eprubetă conține aceste substanțe.
Efectuați experimentele 1, 2, 3.
Se toarnă 2 - 3 ml de soluție în eprubeta nr. 1 și se adaugă 1 - 2 picături dintr-o soluție de indicator metil portocaliu, turnesol, fenolftaleină, cum s-a schimbat culoarea soluției?
Se toarnă o soluție de indicator de metil portocaliu, turnesol, fenolftaleină în eprubeta nr. 2.
Ce observi?
Se toarnă o soluție de indicator de metil portocaliu, turnesol, fenolftaleină în eprubeta nr. 3.
Ce observi?
3. Completați tabelul.
Faceți notele necesare în caiet, exprimați concluzia (vorbește un elev din grup). Vezi fișele anexa 1.2.
Schimbarea culoriiîntr-un mediu acid
Schimbarea culorii în mediu alcalin
Lucrarea practică nr. 1
Tema: Reacții calitative la ioni.
Scopul lucrării: utilizarea reacțiilor caracteristice pentru recunoașterea substanțelor anorganice.
Îmbunătățirea abilităților în efectuarea de experimente chimice;
Într-un mod practic, confirmați condițiile pentru efectuarea reacțiilor de schimb ionic.
Obiectivele lecției:
Educativ: cu ajutorul unui experiment chimic, consolidați cunoștințele, deprinderile și abilitățile elevilor la secțiunea „Teoria disociației electrolitice” (reacții caracteristice la substanțele anorganice).
Dezvoltare: promovează dezvoltarea gândirii (analiza, compara, evidențiază principalul, stabilește relații cauză-efect), dezvoltarea intereselor cognitive.
Educațional: promovează formarea calităților personalității (responsabilitate, colectivism, inițiativă).
Tip de lecție: aplicarea cunoștințelor, abilităților și abilităților în practică.
Tip de lecție: lucrări practice.
Metode de predare: analitice, comparative, generalizante, clasificare.
Grupa 2
Trei eprubete cu numere conțin soluții: carbonat de sodiu, clorură de sodiu și sulfat de sodiu. Folosind substanțele date (acid clorhidric, azotat de argint, clorură de bariu), stabiliți ce eprubetă conține fiecare substanță.
Instructiuni de folosire.
Pentru a efectua acest experiment, împărțiți conținutul fiecărei eprubete numerotate în trei probe.
Progres:
Tabel pentru înregistrarea finalizării lucrărilor în formularul:
Ce observi?
Ce observi?
Ce observi?
Scrieți ecuația reacției în forme moleculare, ionice complete și ionice reduse.
3. Completați tabelul.
4. Trageți o concluzie generală. Notați rezultatele părții experimentale a lucrării în tabelul de raport. Când pregătiți un raport, utilizați §§ 2,3,4.
Faceți notele necesare
Lucrarea practică nr. 1
Tema: Reacții calitative la ioni.
Scopul lucrării: utilizarea reacțiilor caracteristice pentru recunoașterea substanțelor anorganice.
Îmbunătățirea abilităților în efectuarea de experimente chimice;
Într-un mod practic, confirmați condițiile pentru efectuarea reacțiilor de schimb ionic.
Obiectivele lecției:
Educativ: cu ajutorul unui experiment chimic, consolidați cunoștințele, deprinderile și abilitățile elevilor la secțiunea: „Teoria disociației electrolitice” (reacții caracteristice la substanțele anorganice).
Dezvoltare: promovează dezvoltarea gândirii (analiza, compara, evidențiază principalul, stabilește relații cauză-efect), dezvoltarea intereselor cognitive.
Educațional: promovează formarea calităților personalității (responsabilitate, colectivism, inițiativă).
Tip de lecție: aplicarea cunoștințelor, abilităților și abilităților în practică.
Tip de lecție: lucrări practice.
Metode de predare: analitice, comparative, generalizante, clasificare.
Echipament: tabla, creta, masa de solubilitate a acizilor, bazelor, sarurilor in apa, suport cu eprubete, lampa cu alcool, chibrituri, suport pentru eprubete.
Reactivi: solutii: acid clorhidric, apa, indicator - azotat de argint, carbonat de calciu, carbonat de sodiu si clorura de sodiu, acid clorhidric, clorura de amoniu.
Grupa 3
Trei eprubete numerotate conțin solide: carbonat de calciu, clorură de amoniu și clorură de sodiu. Folosind substanțele date (acid clorhidric, azotat de argint, hidroxid de sodiu), determinați ce eprubetă conține fiecare substanță.
Instructiuni de folosire.
Pentru a efectua acest experiment, împărțiți conținutul fiecărei eprubete numerotate în trei probe.
Progres:
1. Un tabel pentru înregistrarea finalizării lucrărilor sub forma:
2. Efectuați experimentele 1, 2, 3.Turnați soluția de azotat de argint în eprubeta nr. 1.
Ce observi?
Scrieți ecuația reacției în forme moleculare, ionice complete și ionice reduse.
Se toarnă o soluție de acid clorhidric în eprubeta nr. 2.
Ce observi?
Scrieți ecuația reacției în forme moleculare, ionice complete și ionice reduse.
Se toarnă soluția de hidroxid de sodiu în eprubeta nr. 3.
Ce observi?
Scrieți ecuația reacției în forme moleculare, ionice complete și ionice reduse.
3. Completați tabelul.
4. Trageți o concluzie generală. Notați rezultatele părții experimentale a lucrării în tabelul de raport. Când pregătiți un raport, utilizați §§ 2,3,4.
Faceți notele necesareîn caiet, concluzia este exprimată. (Un elev din grup vorbește). Vezi fișele anexa 1.2.
3. A treia parte a lecției
Proprietățile chimice ale substanțelor simple. Proprietățile chimice ale substanțelor complexe.
Reacții calitative la ionii în soluție (ionii de clorură, sulfat, carbonat, ion de amoniu).
Obținerea de substanțe gazoase.
Reacții calitative la substanțe gazoase (oxigen, hidrogen, dioxid de carbon, amoniac)
Sarcini creative, sarcina C 3, sarcinile sunt dificile.
3. Fiecare grup este rugat să rezolve o problemă combinată. Grupul decide împreună. Soluția este scrisă pe tablă.
3.1 : Basmul lui Pavel Bazhov „Stăpâna muntelui de cupru” menționează o frumoasă piatră ornamentală - malachitul, din care sunt făcute vaze, cutii și bijuterii. Formula chimică a malachitului (CuOH) 2 CO 3 . În timpul descompunerii termice a malachitului se formează trei substanțe complexe: un solid negru și două gazoase. Când una dintre substanțele gazoase rezultate este trecută prin apa de var, aceasta devine tulbure din cauza formării sedimentelor.
Notați formula chimică și numele precipitatului rezultat. Scrieți două ecuații moleculare pentru reacțiile care au fost efectuate.
Răspuns:t 0
(CuOH) 2 CO 3 → 2CuO + CO 2 +H 2 O
Malachit
CO 2 +Ca(OH) 2 →CaCO 3 ↓+H 2 O
Această reacție este utilizată pentru a detecta monoxidul de carbon (IV).
3.2: Substanța X 1 obţinut prin reacţia aluminiului cu pulbere galbenă. Când apa acționează asupra lui X 1 se eliberează un gaz otrăvitor cu miros de ouă putrezite. Acest gaz arde pentru a forma substanța X 2 cu un miros înțepător. Definiți X 1 al lor 2. Scrieți ecuațiile reacțiilor care au loc. Indicați masa molară a substanței X 2.
Răspuns:
2Al +3S → Al 2 S 3
Al 2 S 3 + 6 N 2 DESPRE→ 3H 2 S + 2Al(OH) 3
2 H 2 S + 3 O 2 → 2 ASA DE 2 + 2 ore 2 DESPRE
Al 2 S 3 - X 1 , ASA DE 2 - X 2 M (ASA DE 2 ) = 64 g/mol
Toate experimentele cu hidrogen sulfurat sunt efectuate într-o hotă!
3.3: Pentru a determina compoziția calitativă a unei substanțe, elevilor li s-a dat o sare metalică, din care 1 kg în 1854 costa de 270 de ori mai mult decât argintul, iar la mijlocXXsecolul a fost deja utilizat pe scară largă pentru fabricarea structurilor metalice ușoare. După ce au dizolvat cristalele sării date în apă, elevii au turnat soluția limpede rezultată în două eprubete.
La unul dintre ele s-au adăugat câteva picături de soluție de hidroxid de sodiu și s-a format un precipitat alb asemănător unui gel. Câteva picături de soluție de clorură de bariu au fost adăugate într-o altă eprubetă care conținea o soluție de sare, care a format un precipitat alb, asemănător laptelui.
Scrieți formula chimică și numele sării date. Creați două ecuații pentru reacțiile care au fost efectuate în procesul de recunoaștere.
Răspuns:
Al 2 (ASA DE 4 ) 3 +6NaOH→3Na 2 ASA DE 4 +2Al(OH) 3 ↓ asemănător unui gelalbsediment
Al 2 ( ASA DE 4 ) 3 + 3 BaCl 2 → 3 BaSO 4 ↓+ 2 AlCl 3
sediment alb, lăptos
Rezumând lecția. Reflecţie. Notare.
Bloc evaluativ-reflexiv
Să vă analizăm munca în grupuri. Cuvântul este acordat liderului fiecărei grupe.
Ce întrebări am abordat astăzi în clasă?
Care dintre aceste întrebări ți s-a părut cel mai dificil?
Test Anexa 3
Cum am învățat materialul?
Teme pentru acasă (tema este tipărită pentru fiecare student)
Sarcina nr. 1.
Pentru a efectua experimentele, cercetătorilor li s-a administrat o substanță care era cristale galbene insolubile în apă. Se știe că această substanță este folosită la fabricarea chibriturilor și la vulcanizarea cauciucului. Ca rezultat al interacțiunii substanței eliberate cu acidul sulfuric concentrat la încălzire, se formează oxid gazos și apă. Și când oxidul rezultat este trecut printr-o soluție de hidroxid de bariu, se formează un precipitat alb, care se dizolvă odată cu trecerea ulterioară a gazului.
Notează formula chimică și numește sarea obținută în urma celui de-al doilea experiment. Scrieți două ecuații ale reacțiilor moleculare care corespund experimentelor efectuate de elevi în timp ce explorau sarea.
t 0
S+2H 2 ASA DE 4 = 3SO 2 + 2 ore 2 O
ASA DE 2 +Ba(OH) 2 = BaSO 4 ↓ + 2H 2 O
Sulfat de bariu
(La sfârșitul lecției, elevii care doresc să schimbe pătratul într-un pătrat de altă culoare sunt rugați să facă acest lucru. Testul „Dispoziția noastră”).
Anexa 1.
Masa. Determinarea ionică
Rezultatul reacției
H +
Indicatori
Schimbarea culorii
Ag+
Cl -
Sediment alb
CUu 2+
OH -
S 2-
Sediment albastru
Sediment negru
Colorează flacăra albastru-verde
Fe 2+
OH -
Sediment verzui care devine maro în timp
Fe 3+
OH -
Sediment brun
Zn 2+
OH -
S 2-
Precipitat alb, dacă este în excesOH - se dizolvă
Sediment alb
Al 3+
OH -
Un precipitat alb, ca de jeleu, care, atunci când este în excesOH - se dizolvă
N.H. 4 +
OH -
Miros de amoniac
Ba 2+
ASA DE 4 2-
Sediment alb
Colorează flacăra galben-verde
Ca 2+
CO 3 2-
Sediment alb
Colorarea flăcării în roșu cărămiziu
N / A +
Culoare flacără galbenă
K +
Culoarea flăcării este violet (prin sticlă de cobalt)
Cl -
Ag +
Sediment alb
H 2 ASA DE 4 *
Eliberarea de gaz incolor cu miros înțepător (acid clorhidric)
Br -
Ag +
H 2 ASA DE 4 *
Sediment gălbui
SelecţieASA DE 2 ȘiBr 2 (culoarea maro)
eu -
Ag +
H 2 ASA DE 4 +
Precipitat galben
SelecţieH 2 SȘieu 2 (Violet)
ASA DE 3 2-
H +
SelecţieASA DE 2 - un gaz cu miros înțepător care albește o soluție de fucsin și cerneală violetă
CO 3 2-
H +
Emisia de gaz inodor care provoacă tulburări în apa de var
CH 3 GÂNGURI -
H 2 ASA DE 4
Miros de acid acetic
NU 3 -
H 2 ASA DE 4 (conc.) șiCu
Eliberare de gaz maro
ASA DE 4 2-
Ba 2+
Sediment alb
P.O. 4 3-
Ag +
Precipitat galben
OH -
Indicatori
Schimbarea culorii indicatoarelor
Anexa 2.
Lucrarea practică nr. 1
Tema: Reacții calitative la ioni.
Scopul lucrării: utilizarea reacțiilor caracteristice pentru recunoașterea substanțelor anorganice.
Îmbunătățirea abilităților în efectuarea de experimente chimice;
Într-un mod practic, confirmați condițiile pentru efectuarea reacțiilor de schimb ionic.
Obiectivele lecției:
Educativ: cu ajutorul unui experiment chimic, consolidați cunoștințele, deprinderile și abilitățile elevilor la secțiunea „Teoria disociației electrolitice” (reacții caracteristice la substanțele anorganice).
Dezvoltare: promovează dezvoltarea gândirii (analiza, compara, evidențiază principalul, stabilește relații cauză-efect), dezvoltarea intereselor cognitive.
Educațional: promovează formarea calităților personalității (responsabilitate, colectivism, inițiativă).
Tip de lecție: aplicarea cunoștințelor, abilităților și abilităților în practică.
Tip de lecție: lucrări practice.
Metode de predare: analitice, comparative, generalizante, clasificare.
Echipament: tabla, creta, masa de solubilitate a acizilor, bazelor, sarurilor in apa, suport cu eprubete, lampa cu alcool, chibrituri, suport pentru eprubete.
Reactivi: carbonat de sodiu, clorură de sodiu și sulfat de sodiu, acid clorhidric, azotat de argint, clorură de bariu.
Grupa 2
Trei eprubete cu numere conțin soluții: carbonat de sodiu, clorură de sodiu și sulfat de sodiu. Folosind substanțele date (acid clorhidric, azotat de argint, clorură de bariu), stabiliți ce eprubetă conține fiecare substanță.
Instructiuni de folosire.
Pentru a efectua acest experiment, împărțiți conținutul fiecărei eprubete numerotate în trei probe.
Progres:
Tabel pentru înregistrarea finalizării lucrărilor în formularul:
Se toarnă soluția de clorură de bariu în eprubeta nr. 1.
Ce observi?
Scrieți ecuația reacției în forme moleculare, ionice complete și ionice abreviate.
Se toarnă o soluție de acid clorhidric în eprubeta nr. 2.
Ce observi?
Scrieți ecuația reacției în forme moleculare, ionice complete și ionice reduse.
Se toarnă soluția de azotat de argint în eprubeta nr. 3.
Ce observi?
Scrieți ecuația reacției în forme moleculare, ionice complete și ionice reduse.
3. Completați tabelul.
4. Trageți o concluzie generală. Notați rezultatele părții experimentale a lucrării în tabelul de raport. Când pregătiți un raport, utilizați §§ 2,3,4.
Faceți notele necesare în caiet, concluzia este exprimată. (Un elev din grup vorbește).
Anexa 3
Test
Cum am învățat materialul?
1. A primit cunoștințe solide, a stăpânit tot materialul 9-10 puncte
2. Stăpânește parțial materialul 7-8 puncte
3. Nu am înțeles mare lucru, mai trebuie să lucrez 4-6 puncte
4. Ce notă ți-ai acorda pentru participarea la grupuri? (Oferiți-vă acest rating aici).
O lecție desfășurată folosind un caiet pentru lucrări practice de I.I. Novoshinsky, N.S. Novoshinskaya pentru manualul Chimie clasa a VIII-a la instituția de învățământ municipală „Școala secundară nr. 11” din Severodvinsk, regiunea Arhangelsk, de profesorul de chimie O.A. Olkina în clasa a VIII-a (în paralel ).
Scopul lecției: Formarea, consolidarea și controlul abilităților elevilor în determinarea reacției unui mediu de soluție folosind diverși indicatori, inclusiv cei naturali, folosind un caiet pentru lucrări practice de I.I. Novoshinsky, N.S. Novoshinskaya pentru manualul Chimie clasa a VIII-a.
Obiectivele lecției:
- Educational. Consolidați următoarele concepte: indicatori, reacție medie (tipuri), pH, filtrat, filtrare pe baza îndeplinirii sarcinilor de lucru practice. Testați cunoștințele elevilor care reflectă relația „soluția unei substanțe (formula) – valoarea pH (valoarea numerică) – reacția mediului”. Spuneți elevilor modalități de reducere a acidității solurilor din regiunea Arhangelsk.
- De dezvoltare. Să promoveze dezvoltarea gândirii logice a studenților pe baza analizei rezultatelor obținute în timpul lucrărilor practice, a generalizării acestora, precum și a capacității de a trage concluzii. Confirmați regula: practica demonstrează sau infirmă teoria. Continuarea formării calităților estetice ale personalității elevilor pe baza gamei diverse de soluții prezentate, precum și susținerea interesului copiilor pentru disciplina „Chimie” studiată.
- Educarea. Continuați să dezvoltați abilitățile studenților în îndeplinirea sarcinilor practice de lucru, respectând regulile de sănătate și securitate în muncă, inclusiv efectuarea corectă a proceselor de filtrare și încălzire.
Lucrare practică nr. 6 „Determinarea pH-ului mediului”.
Scopul elevilor: Învață să determine reacția mediului a soluțiilor diverselor obiecte (acizi, alcaline, săruri, soluție de sol, unele soluții și sucuri), precum și să studiezi obiectele vegetale ca indicatori naturali.
Echipamente și reactivi: suport cu eprubete, dop, tijă de sticlă, suport cu inel, hârtie de filtru, foarfece, pâlnie chimică, pahare, mortar de porțelan, răzătoare fină, nisip curat, hârtie indicator universal, soluție de testare, pământ, apă fiartă , fructe, fructe de pădure și alte materiale vegetale, soluție de hidroxid de sodiu și acid sulfuric, clorură de sodiu.
În timpul orelor
Baieti! Ne-am familiarizat deja cu concepte precum reacția mediului de soluții apoase, precum și indicatorii.
Ce tipuri de reacții în soluții apoase cunoașteți?
- neutru, alcalin și acid.
Ce sunt indicatorii?
- substanţe care pot fi folosite pentru a determina reacţia mediului.
Ce indicatori cunoașteți?
- în soluții: fenolftaleină, turnesol, metil portocală.
- uscat: hârtie indicator universal, hârtie turnesol, hârtie metil portocalie
Cum se poate determina reacția soluțiilor apoase?
- ud și uscat.
Care este pH-ul mediului?
- Valoarea pH-ului ionilor de hidrogen în soluție (pH=– log)
Să ne amintim ce om de știință a introdus conceptul de pH?
- Chimistul danez Sorensen.
Bine făcut!!! Acum deschideți caietul pentru lucrări practice de la p. 21 și citiți sarcina nr. 1.
Sarcina nr. 1. Determinați pH-ul soluției folosind un indicator universal.
Să ne amintim regulile atunci când lucrăm cu acizi și alcaline!
Finalizați experimentul de la sarcina nr. 1.
Trage o concluzie. Astfel, dacă o soluție are pH = 7 mediul este neutru, la pH< 7 среда кислотная, при pH >7 mediu alcalin.
Sarcina nr. 2. Obțineți o soluție de sol și determinați-i pH-ul folosind un indicator universal.
Citiți sarcina de la p. 21-p. 22, finalizați sarcina conform planului, introduceți rezultatele în tabel.
Să ne amintim regulile de siguranță atunci când lucrați cu dispozitive de încălzire (sobă cu alcool).
Ce este filtrarea?
- procesul de separare a unui amestec, care se bazează pe debitul diferit al materialului poros - filtratul în raport cu particulele care alcătuiesc amestecul.
Ce este filtratul?
- este o solutie limpede obtinuta dupa filtrare.
Prezentați rezultatele sub formă de tabel.
Care este reacția mediului de soluție a solului?
- Acru
Ce trebuie făcut pentru a îmbunătăți calitatea solului din regiunea noastră?
- CaCO3 + H2O + CO2 = Ca(HCO3)2
Aplicarea îngrășămintelor care au un mediu de reacție alcalină: calcar măcinat și alte minerale carbonatice: cretă, dolomit. În districtul Pinezhsky din regiunea Arhangelsk există depozite de un astfel de mineral precum calcarul lângă peșterile carstice, deci este accesibil.
Trage o concluzie. Reacția soluției de sol rezultată este pH = 4, ușor acidă, prin urmare, calcararea este necesară pentru îmbunătățirea calității solului.
Sarcina nr. 3. Determinați pH-ul unor soluții și sucuri folosind un indicator universal.
Citiți sarcina de la p. 22, finalizați sarcina conform algoritmului, introduceți rezultatele în tabel.
Sursa de suc |
Sursa de suc |
||
Cartof |
Adeziv silicat |
||
Varză proaspătă |
Oțet de masă |
||
Varză murată |
Soluție de bicarbonat de sodiu |
||
Portocale |
|||
Sfecla proaspata |
|||
Sfecla fiartă |
Trage o concluzie. Astfel, diferite obiecte naturale au valori diferite ale pH-ului: pH 1–7 – mediu acid (lămâie, merișor, portocală, roșie, sfeclă roșie, kiwi, măr, banană, ceai, cartofi, varză murată, cafea, lipici silicat).
pH 7–14 mediu alcalin (varză proaspătă, soluție de bicarbonat de sodiu).
pH = 7 mediu neutru (curmal, castravete, lapte).
Sarcina nr. 4. Cercetarea indicatorilor de plante.
Ce obiecte vegetale pot acționa ca indicatori?
- fructe de padure: sucuri, petale de flori: extracte, sucuri de legume: radacini, frunze.
- substanțe care pot schimba culoarea unei soluții în diferite medii.
Citiți sarcina de la p. 23 și finalizați-o conform planului.
Prezentați rezultatele într-un tabel.
Material vegetal (indicatori naturali) |
Indicator natural de culoare soluție |
||
Mediu acid |
Culoarea naturală a soluției (mediu neutru) |
Mediu alcalin |
|
Suc de merișoare) |
violet |
||
Suc de capsuni) |
portocale |
roz-piersică |
|
Afine (suc) |
roșu-violet |
Albastru violet |
|
coacaze negre (suc) |
roșu-violet |
Albastru violet |
|
Trage o concluzie. Astfel, în funcție de pH-ul mediului, indicatorii naturali: merișoare (suc), căpșuni (suc), afine (suc), coacăze negre (suc) capătă următoarele culori: în mediu acid - roșu și portocaliu, într-un neutru. mediu - rosu, piersic - culori roz si violet, intr-un mediu alcalin de la roz prin albastru-violet la violet.
În consecință, intensitatea culorii unui indicator natural poate fi judecată după reacția mediului dintr-o anumită soluție.
Când ați terminat, faceți ordine în zona de lucru.
Baieti! Azi a fost o lecție foarte neobișnuită! Ti-a placut?! Informațiile învățate în această lecție pot fi folosite în viața de zi cu zi?
Acum finalizați sarcina dată în caietele dvs. de practică.
Sarcina de control. Distribuiți substanțele ale căror formule sunt date mai jos în grupe în funcție de pH-ul soluțiilor lor: HCl, H 2 O, H 2 SO 4, Ca (OH) 2, NaCl, NaOH, KNO 3, H 3 PO 4, KOH.
pH 17 – mediu (acid), au soluții (HCl, H 3 PO 4, H 2 SO 4).
pH 714 mediu (alcalin), au soluții (Ca(OH) 2, KOH, NaOH).
pH = 7 mediu (neutru), au solutii (NaCl, H 2 O, KNO 3).
Evaluare pentru munca _______________