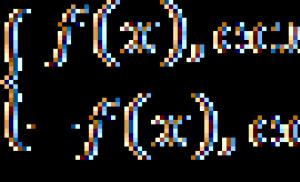Cea mai mare stare de oxidare a cromului este 4. Starea de oxidare a cromului. Exemple de rezolvare a problemelor
Proprietățile redox ale compușilor cromului cu diferite grade de oxidare.
Crom. Structura atomului. Posibile stări de oxidare. Proprietăți acido-bazice. Aplicație.
Cr +24)2)8)13)1
Cromul are stări de oxidare de +2, +3 și +6.
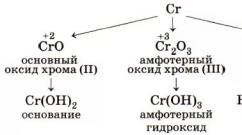
Pe măsură ce gradul de oxidare crește, crește proprietățile acide și oxidante. Derivații de crom Cr2+ sunt agenți reducători foarte puternici. Ionul Cr2+ se formează în prima etapă a dizolvării Cromului în acizi sau în timpul reducerii Cr3+ într-o soluție acidă cu zinc. Când este deshidratat, hidroxidul Cr(OH)2 se transformă în Cr2O3. Compușii Cr3+ sunt stabili în aer. Pot fi atât agenți reducători, cât și oxidanți. Cr3+ poate fi redus într-o soluție acidă cu zinc la Cr2+ sau oxidat într-o soluție alcalină la CrO42- cu brom și alți agenți oxidanți. Hidroxidul Cr(OH)3 (sau mai degrabă Cr2O3 nH2O) este un compus amfoter care formează săruri cu cationul Cr3+ sau săruri ale acidului cromos HCrO2 - cromiți (de exemplu, KSrO2, NaCrO2). Compușii Cr6+: anhidrida cromică CrO3, acizii cromici și sărurile acestora, dintre care cei mai importanți sunt cromații și dicromații - săruri puternic oxidante.
Folosit ca acoperiri galvanice rezistente la uzură și frumoase (cromare). Cromul este utilizat pentru producerea de aliaje: crom-30 și crom-90, care sunt indispensabile pentru producerea de duze pentru torțe cu plasmă puternice și în industria aerospațială.
Cromul este inactiv din punct de vedere chimic. În condiții normale, reacționează numai cu fluor (din nemetale), formând un amestec de fluoruri.
Cromati si bicromati
Cromații se formează prin interacțiunea CrO3 sau a soluțiilor de acizi cromici cu alcalii:
СгО3 + 2NaOH = Na2CrO4 + Н2О
Dicromații se obțin prin acțiunea acizilor asupra cromaților:
2 Na2Cr2O4 + H2SO4 = Na2Cr2O7 + Na2SO4 + H2O
Compușii cromului sunt caracterizați prin reacții redox.
Compușii cromului (II) sunt agenți reducători puternici și se oxidează ușor
4(5gCl2 + O2 + 4HCI = 4CrCl3 + 2H2O
Compușii cromului (!!!) se caracterizează prin proprietăți reducătoare. Sub influența agenților oxidanți merg:
la cromați - într-un mediu alcalin,
în dicromaţi – în mediu acid.
Cr(OH)3. CrOH + HCl = CrCl + H2O, 3CrOH + 2NaOH = Cr3Na2O3 + 3H2O
Cromații(III) (denumire veche: cromiți).
Compușii cromului se caracterizează prin proprietăți reducătoare. Sub influența agenților oxidanți, aceștia merg:
la cromați - într-un mediu alcalin,
în dicromaţi – în mediu acid.
2Na3 [Cr(OH)6] + 3Br2 + 4NaOH = 2Na2CrO4 + 6NaBr + 8H2O
5Cr2(SO4)3 + 6KMnO4 + 11H2O = 3K2Cr2O7 + 2H2Cr2O7 + 6MnSO4 + 9H2SO4
Sărurile acizilor cromici într-un mediu acid sunt agenți oxidanți puternici:
3Na2SO3 + K2Cr2O7 + 4H2SO4 = 3Na2SO4 + Cr2(SO4)3 + K2SO4 + 4H2O
Cromul (Cr), un element chimic din grupa VI a sistemului periodic al lui Mendeleev. Este un metal de tranziție cu număr atomic 24 și masă atomică 51,996. Tradus din greacă, numele metalului înseamnă „culoare”. Metalul își datorează numele varietății de culori care sunt inerente diferiților săi compuși.
Caracteristicile fizice ale cromului
Metalul are suficientă duritate și fragilitate în același timp. Pe scara Mohs, duritatea cromului este evaluată la 5,5. Acest indicator înseamnă că cromul are duritatea maximă a tuturor metalelor cunoscute astăzi, după uraniu, iridiu, wolfram și beriliu. Substanța simplă crom este caracterizată de o culoare alb-albăstruie.
Metalul nu este un element rar. Concentrația sa în scoarța terestră atinge 0,02% din masă. acțiuni Cromul nu se găsește niciodată în forma sa pură. Se găsește în minerale și minereuri, care sunt principala sursă de extracție a metalelor. Cromitul (minereu de crom de fier, FeO*Cr 2 O 3) este considerat principalul compus al cromului. Un alt mineral destul de comun, dar mai puțin important este crocoitul PbCrO 4 .
Metalul poate fi topit cu ușurință la o temperatură de 1907 0 C (2180 0 K sau 3465 0 F). La temperatura de 2672 0 C fierbe. Masa atomică a metalului este de 51,996 g/mol.
Cromul este un metal unic datorită proprietăților sale magnetice. La temperatura camerei, prezintă o ordonare antiferomagnetică, în timp ce alte metale o prezintă la temperaturi extrem de scăzute. Cu toate acestea, dacă cromul este încălzit peste 37 0 C, proprietățile fizice ale cromului se modifică. Astfel, rezistența electrică și coeficientul de dilatare liniară se modifică semnificativ, modulul elastic atinge o valoare minimă, iar frecarea internă crește semnificativ. Acest fenomen este asociat cu trecerea punctului Néel, la care proprietățile antiferomagnetice ale materialului se pot schimba în paramagnetice. Aceasta înseamnă că primul nivel a fost trecut, iar substanța a crescut brusc în volum.
Structura cromului este o rețea centrată pe corp, datorită căreia metalul este caracterizat de temperatura perioadei fragile-ductile. Totuși, în cazul acestui metal, gradul de puritate este de mare importanță, prin urmare, valoarea este în intervalul -50 0 C - +350 0 C. După cum arată practica, metalul cristalizat nu are nicio ductilitate, ci moale. recoacerea si turnarea il fac maleabil.
Proprietățile chimice ale cromului
Atomul are următoarea configurație externă: 3d 5 4s 1. De regulă, în compuși, cromul are următoarele stări de oxidare: +2, +3, +6, dintre care Cr 3+ prezintă cea mai mare stabilitate.În plus, există și alți compuși în care cromul prezintă o stare de oxidare complet diferită și anume : +1, +4, +5.
Metalul nu este deosebit de reactiv din punct de vedere chimic. Când cromul este expus la condiții normale, metalul prezintă rezistență la umiditate și oxigen. Cu toate acestea, această caracteristică nu se aplică compusului de crom și fluor - CrF 3, care, atunci când este expus la temperaturi care depășesc 600 0 C, interacționează cu vaporii de apă, formând Cr 2 O 3 ca urmare a reacției, precum și azot. , carbon și sulf.
Când cromul este încălzit, acesta reacționează cu halogeni, sulf, siliciu, bor, carbon și alte elemente, ducând la următoarele reacții chimice ale cromului:
Cr + 2F 2 = CrF 4 (cu un amestec de CrF 5)
2Cr + 3Cl2 = 2CrCl3
2Cr + 3S = Cr 2 S 3
Cromații pot fi obținuți prin încălzirea cromului cu sodă topită în aer, nitrați sau clorați de metale alcaline:
2Cr + 2Na 2 CO 3 + 3O 2 = 2Na 2 CrO 4 + 2CO 2.
Cromul nu este toxic, ceea ce nu se poate spune despre unii dintre compușii săi. După cum se știe, praful din acest metal, dacă intră în corp, poate irita plămânii; nu este absorbit prin piele. Dar, deoarece nu apare în forma sa pură, intrarea sa în corpul uman este imposibilă.
Cromul trivalent este eliberat în mediu în timpul exploatării și procesării minereului de crom. Cromul este probabil introdus în corpul uman sub forma unui supliment alimentar utilizat în programele de slăbire. Cromul, cu o valență de +3, este un participant activ în sinteza glucozei. Oamenii de știință au descoperit că consumul excesiv de crom nu dăunează organismului uman, deoarece acesta nu este absorbit, dar se poate acumula în organism.
Compușii care implică metal hexavalent sunt extrem de toxici. Probabilitatea ca acestea să intre în corpul uman apare în timpul producției de cromați, cromarea obiectelor și în timpul unor lucrări de sudare. Ingestia unui astfel de crom în organism este plină de consecințe grave, deoarece compușii în care este prezent elementul hexavalent sunt agenți oxidanți puternici. Prin urmare, pot provoca sângerări în stomac și intestine, uneori cu perforare a intestinului. Când astfel de compuși intră în contact cu pielea, apar reacții chimice puternice sub formă de arsuri, inflamații și ulcere.
În funcție de calitatea cromului care trebuie obținut la ieșire, există mai multe metode de producere a metalului: electroliza soluțiilor apoase concentrate de oxid de crom, electroliza sulfaților și reducerea cu oxid de siliciu. Cu toate acestea, ultima metodă nu este foarte populară, deoarece produce crom cu o cantitate imensă de impurități. În plus, nu este viabil din punct de vedere economic.
| Starea de oxidare | Oxid | Hidroxid | Caracter | Forme predominante în soluții | Note |
| +2 | CrO (negru) | Cr(OH)2 (galben) | De bază | Cr2+ (săruri albastre) | Agent reducător foarte puternic |
| Cr2O3 (verde) | Cr(OH)3 (gri-verde) | Amfoter |
Cr3+ (săruri verzi sau violete) |
||
| +4 | CrO2 | nu exista | Neformatoare de sare | - |
Rareori întâlnit, necaracteristic |
| +6 | CrO3 (roșu) |
H2CrO4 |
Acid |
CrO42- (cromați, galben) |
Tranziția depinde de pH-ul mediului. Un oxidant puternic, higroscopic, foarte toxic. |
Sarcina nr. 1
Starea de oxidare +2 la toți compușii prezintă
Raspuns: 4
Explicaţie:
Dintre toate opțiunile propuse, doar zincul prezintă starea de oxidare +2 în compuși complecși, fiind un element al subgrupului secundar al celui de-al doilea grup, unde starea de oxidare maximă este egală cu numărul grupului.
Staniul este un element al subgrupului principal al grupului IV, un metal, care prezintă stări de oxidare 0 (într-o substanță simplă), +2, +4 (numărul grupului).
Fosforul este un element al subgrupului principal al grupului principal, fiind un nemetal, prezentând stări de oxidare de la -3 (numărul grupului – 8) la +5 (numărul grupului).
Fierul este un metal, elementul este situat într-un subgrup secundar al grupului principal. Fierul se caracterizează prin stări de oxidare: 0, +2, +3, +6.
Sarcina nr. 2
Compusul din compoziția KEO 4 formează fiecare dintre două elemente:
1) fosfor și clor
2) fluor și mangan
3) clor și mangan
4) siliciu și brom
Raspuns: 3
Explicaţie:
Sarea compoziției KEO 4 conține un reziduu acid EO 4 -, unde oxigenul are o stare de oxidare de -2, prin urmare, starea de oxidare a elementului E din acest reziduu acid este +7. Dintre opțiunile propuse, clorul și manganul sunt potrivite - elemente ale subgrupelor principale și, respectiv, secundare ale grupului VII.
Fluorul este, de asemenea, un element al subgrupului principal al grupului VII, totuși, fiind elementul cel mai electronegativ, nu prezintă stări de oxidare pozitive (0 și -1).
Borul, siliciul și fosforul sunt elemente ale principalelor subgrupe ale grupelor 3, 4 și, respectiv, 5, prin urmare în săruri prezintă stările de oxidare maxime corespunzătoare de +3, +4, +5.
Sarcina nr. 3
- 1. Zn și Cr
- 2. Si și B
- 3. Fe și Mn
- 4. P și As
Raspuns: 4
Explicaţie:
Aceeași stare de oxidare cea mai mare în compuși, egală cu numărul grupului (+5), este prezentată de P și As. Aceste elemente sunt situate în subgrupul principal al grupului V.
Zn și Cr sunt elemente ale subgrupurilor secundare ale grupelor II și, respectiv, VI. În compuși, zincul prezintă cea mai mare stare de oxidare de +2, cromul - +6.
Fe și Mn sunt elemente ale subgrupurilor secundare ale grupelor VIII și, respectiv, VII. Cea mai mare stare de oxidare pentru fier este +6, pentru mangan - +7.
Sarcina nr. 4
Compușii prezintă aceeași stare de oxidare cea mai ridicată
- 1. Hg și Cr
- 2. Si si Al
- 3. F și Mn
- 4. P și N
Raspuns: 4
Explicaţie:
P și N prezintă aceeași stare de oxidare cea mai mare în compuși, egală cu numărul grupului (+5). Aceste elemente sunt situate în subgrupul principal al grupului V.
Hg și Cr sunt elemente ale subgrupurilor secundare ale grupelor II și, respectiv, VI. În compuși, mercurul prezintă cea mai mare stare de oxidare de +2, cromul - +6.
Si și Al sunt elemente ale principalelor subgrupe ale grupelor IV și, respectiv, III. În consecință, pentru siliciu, starea maximă de oxidare în compușii complecși este +4 (numărul grupului în care se află siliciul), pentru aluminiu - +3 (numărul grupului în care se află aluminiul).
F și Mn sunt elemente ale subgrupurilor principale și, respectiv, secundare ale grupului VII. Cu toate acestea, fluorul, fiind elementul cel mai electronegativ al Tabelului Periodic al Elementelor Chimice, nu prezintă stări de oxidare pozitive: în compușii complecși starea sa de oxidare este -1 (numărul grupului -8). Cea mai mare stare de oxidare a manganului este +7.
Sarcina nr. 5
Azotul prezintă o stare de oxidare +3 în fiecare dintre cele două substanțe:
- 1. HNO2 și NH3
- 2. NH4CI și N2O3
- 3. NaNO2 și NF3
- 4. HNO3 și N2
Raspuns: 3
Explicaţie:
În acidul azot HNO 2, starea de oxidare a oxigenului din reziduul acid este -2, cea a hidrogenului este +1, prin urmare, pentru ca molecula să rămână neutră din punct de vedere electric, starea de oxidare a azotului este +3. În amoniacul NH 3, azotul este un element mai electronegativ, deci atrage o pereche de electroni a unei legături polare covalente și are o stare de oxidare negativă de -3, starea de oxidare a hidrogenului din amoniac este +1.
Clorura de amoniu NH 4 Cl este o sare de amoniu, prin urmare starea de oxidare a azotului este aceeași ca la amoniac, adică. este egal cu -3. În oxizi, starea de oxidare a oxigenului este întotdeauna -2, deci pentru azot este +3.
În nitritul de sodiu NaNO 2 (o sare a acidului azotat), gradul de oxidare al azotului este același ca în azotul din acidul azot, deoarece este +3. În fluorura de azot, starea de oxidare a azotului este +3, deoarece fluorul este elementul cel mai electronegativ al Tabelului Periodic și în compușii complecși prezintă o stare de oxidare negativă de -1. Această opțiune de răspuns îndeplinește condițiile sarcinii.
În acidul azotic, azotul are cea mai mare stare de oxidare egală cu numărul de grup (+5). Azotul ca compus simplu (deoarece este format din atomi ai unui element chimic) are o stare de oxidare de 0.
Sarcina nr. 6
Cel mai mare oxid al unui element din grupa VI corespunde formulei
- 1. E 4 O 6
- 2. OE 4
- 3. OE 2
- 4. OE 3
Raspuns: 4
Explicaţie:
Cel mai mare oxid al unui element este oxidul elementului cu cea mai mare stare de oxidare. Într-un grup, cea mai mare stare de oxidare a unui element este egală cu numărul grupului, prin urmare, în grupul VI, starea maximă de oxidare a unui element este +6. În oxizi, oxigenul prezintă o stare de oxidare de -2. Numerele de sub simbolul elementului se numesc indici și indică numărul de atomi ai acelui element din moleculă.
Prima opțiune este incorectă, deoarece. elementul are o stare de oxidare de 0-(-2)⋅6/4 = +3.
În a doua versiune, elementul are o stare de oxidare de 0-(-2) ⋅ 4 = +8.
În a treia opțiune, starea de oxidare a elementului E: 0-(-2) ⋅ 2 = +4.
În a patra opțiune, starea de oxidare a elementului E: 0-(-2) ⋅ 3 = +6, adică. acesta este răspunsul pe care îl cauți.
Sarcina nr. 7
Starea de oxidare a cromului în dicromat de amoniu (NH 4) 2 Cr 2 O 7 este egală cu
- 1. +6
- 2. +2
- 3. +3
- 4. +7
Raspunsul 1
Explicaţie:
În dicromatul de amoniu (NH 4) 2 Cr 2 O 7 în cationul de amoniu NH 4 +, azotul, ca element mai electronegativ, are o stare de oxidare mai scăzută de -3, hidrogenul este încărcat pozitiv +1. Prin urmare, întregul cation are o sarcină de +1, dar deoarece există 2 dintre acești cationi, sarcina totală este +2.
Pentru ca molecula să rămână neutră din punct de vedere electric, reziduul acid Cr 2 O 7 2− trebuie să aibă o sarcină de -2. Oxigenul din reziduurile acide de acizi și săruri are întotdeauna o sarcină de -2, astfel încât cei 7 atomi de oxigen care alcătuiesc molecula de bicromat de amoniu sunt încărcați -14. Există 2 atomi de crom în molecule, prin urmare, dacă sarcina de crom este desemnată cu x, atunci avem:
2x + 7 ⋅ (-2) = -2, unde x = +6. Sarcina de crom din molecula de dicromat de amoniu este +6.
Sarcina nr. 8
Starea de oxidare +5 este posibilă pentru fiecare dintre cele două elemente:
1) oxigen și fosfor
2) carbon și brom
3) clor și fosfor
4) sulf și siliciu
Raspuns: 3
Explicaţie:
În primul răspuns propus, doar fosforul, ca element al subgrupului principal al grupului V, poate prezenta o stare de oxidare de +5, care este maximul său. Oxigenul (un element al subgrupului principal al grupei VI), fiind un element cu electronegativitate ridicată, prezintă o stare de oxidare de -2 în oxizi, ca substanță simplă - 0 și în combinație cu fluor OF 2 - +1. Starea de oxidare +5 nu este tipică pentru aceasta.
Carbonul și bromul sunt elemente ale principalelor subgrupe ale grupelor IV și, respectiv, VII. Carbonul are o stare de oxidare maximă de +4 (egal cu numărul grupului), iar bromul prezintă stări de oxidare de -1, 0 (în compusul simplu Br 2), +1, +3, +5 și +7.
Clorul și fosforul sunt elemente ale principalelor subgrupe ale grupelor VII și, respectiv, V. Fosforul prezintă o stare de oxidare maximă de +5 (egal cu numărul grupului); clorul, similar cu bromul, are stări de oxidare de -1, 0 (într-un compus simplu Cl 2), +1, +3, +5, + 7.
Sulful și siliciul sunt elemente ale principalelor subgrupe ale grupelor VI și, respectiv, IV. Sulful prezintă o gamă largă de stări de oxidare de la -2 (numărul grupului - 8) la +6 (numărul grupului). Pentru siliciu, starea maximă de oxidare este +4 (numărul grupului).
Sarcina nr. 9
- 1. NaNO3
- 2. NaNO2
- 3.NH4CI
- 4.NU
Raspunsul 1
Explicaţie:
În azotatul de sodiu NaNO 3, sodiul are o stare de oxidare de +1 (element din grupa I), există 3 atomi de oxigen în reziduul acid, fiecare dintre care are o stare de oxidare de -2, prin urmare, pentru ca molecula să rămână neutru electric, azotul trebuie să aibă o stare de oxidare de: 0 − (+ 1) − (−2)·3 = +5.
În nitritul de sodiu NaNO 2, atomul de sodiu are, de asemenea, o stare de oxidare de +1 (un element din grupa I), există 2 atomi de oxigen în reziduul acid, fiecare dintre care are o stare de oxidare de -2, prin urmare, pentru pentru ca molecula să rămână neutră din punct de vedere electric, azotul trebuie să aibă o stare de oxidare de: 0 − (+1) − (−2) 2 = +3.
NH 4 Cl – clorură de amoniu. În cloruri, atomii de clor au o stare de oxidare de −1, atomii de hidrogen, dintre care sunt 4 în moleculă, sunt încărcați pozitiv, prin urmare, pentru ca molecula să rămână neutră din punct de vedere electric, starea de oxidare a azotului este: 0 − (−1) − 4 · (+1) = −3. În cationii de amoniac și săruri de amoniu, azotul are o stare de oxidare minimă de -3 (numărul grupului în care se află elementul este 8).
În molecula de oxid azotic NO, oxigenul prezintă o stare de oxidare minimă de -2, ca în toți oxizii, prin urmare, starea de oxidare a azotului este +2.
Sarcina nr. 10
Azotul prezintă cea mai mare stare de oxidare într-un compus a cărui formulă este
- 1. Fe(NO 3) 3
- 2. NaNO2
- 3. (NH4)2S04
- 4. NU 2
Raspunsul 1
Explicaţie:
Azotul este un element al subgrupului principal al grupului V, prin urmare, poate prezenta o stare de oxidare maximă egală cu numărul grupului, adică. +5.
O unitate structurală de azotat de fier Fe(NO 3) 3 constă dintr-un ion Fe 3+ și trei ioni de azotat. În ionii de azot, atomii de azot, indiferent de tipul de contraion, au o stare de oxidare de +5.
În nitritul de sodiu NaNO2, sodiul are o stare de oxidare de +1 (un element al subgrupului principal al grupului I), există 2 atomi de oxigen în reziduul acid, fiecare dintre care are o stare de oxidare de -2, prin urmare, pentru pentru ca molecula să rămână neutră din punct de vedere electric, azotul trebuie să aibă o stare de oxidare de 0 − ( +1) − (−2)⋅2 = +3.
(NH 4) 2 SO 4 – sulfat de amoniu. În sărurile acidului sulfuric, anionul SO 4 2− are o sarcină de 2−, prin urmare, fiecare cation de amoniu are o sarcină de 1+. Hidrogenul are o sarcină de +1, deci azotul are o sarcină de -3 (azotul este mai electronegativ, deci atrage perechea de electroni comună a legăturii N-H). În cationii de amoniac și săruri de amoniu, azotul are o stare de oxidare minimă de -3 (numărul grupului în care se află elementul este 8).
În molecula de oxid de azot NO2, oxigenul prezintă o stare de oxidare minimă de -2, la fel ca în toți oxizii, prin urmare, starea de oxidare a azotului este +4.
Sarcina nr. 11
28910EÎn compușii din compoziția Fe(NO 3) 3 și CF 4, stările de oxidare ale azotului și respectiv carbonului sunt egale
Raspuns: 4
Explicaţie:
O unitate structurală de azotat de fier (III) Fe(NO 3) 3 constă dintr-un ion de fier Fe 3+ și trei ioni de azotat NO 3 -. În ionii de azotat, azotul are întotdeauna o stare de oxidare de +5.
În fluorura de carbon CF 4, fluorul este un element mai electronegativ și atrage perechea de electroni comună a legăturii C-F, prezentând o stare de oxidare de -1. Prin urmare, carbonul C are o stare de oxidare de +4.
Sarcina nr. 12
A32B0BClorul prezintă o stare de oxidare de +7 în fiecare dintre cei doi compuși:
- 1. Ca(OCl)2 și CI2O7
- 2. KClO 3 și ClO 2
- 3. BaCI2 și HCI04
- 4. Mg(Cl04)2 și CI207
Raspuns: 4
Explicaţie:
În prima variantă, atomii de clor au stări de oxidare +1 și, respectiv, +7. O unitate structurală de hipoclorit de calciu Ca(OCl) 2 constă dintr-un ion de calciu Ca 2+ (Ca este un element al subgrupului principal al grupului II) și doi ioni de hipoclorit OCl −, fiecare având o sarcină de 1−. În compușii complecși, cu excepția OF 2 și a diverșilor peroxizi, oxigenul are întotdeauna o stare de oxidare de -2, deci este evident că clorul are o sarcină de +1. În oxidul de clor Cl 2 O 7, ca și în toți oxizii, oxigenul are o stare de oxidare de -2, prin urmare, clorul din acest compus are o stare de oxidare de +7.
În cloratul de potasiu KClO 3, atomul de potasiu are o stare de oxidare de +1, iar oxigenul - -2. Pentru ca molecula să rămână neutră din punct de vedere electric, clorul trebuie să prezinte o stare de oxidare de +5. În oxidul de clor ClO 2, oxigenul, ca și în orice alt oxid, are o stare de oxidare de -2; prin urmare, pentru clor starea sa de oxidare este +4.
În a treia opțiune, cationul de bariu din compusul complex este încărcat cu +2, prin urmare, o sarcină negativă de -1 este concentrată pe fiecare anion de clor din sarea BaCl2. În acidul percloric HClO 4 sarcina totală a 4 atomi de oxigen este −2⋅4 = −8, sarcina pe cationul hidrogen este +1. Pentru ca molecula să rămână neutră din punct de vedere electric, sarcina de clor trebuie să fie +7.
În a patra variantă, în molecula de perclorat de magneziu Mg(ClO 4) 2 sarcina de magneziu este de +2 (în toți compușii complecși, magneziul prezintă o stare de oxidare de +2), prin urmare, pentru fiecare anion ClO 4 − există un taxa de 1−. În total, 4 ioni de oxigen, fiecare prezentând o stare de oxidare de -2, sunt încărcați -8. Prin urmare, pentru ca sarcina totală a anionului să fie 1−, clorul trebuie să aibă o sarcină de +7. În oxidul de clor Cl 2 O 7, așa cum s-a explicat mai sus, sarcina de clor este +7.
DEFINIȚIE
Crom situat în a patra perioadă a grupei VI a subgrupei secundare (B) a Tabelului periodic. Denumirea – Cr. Sub forma unei substanțe simple - un metal strălucitor alb-cenușiu.
Chrome are o structură cu zăbrele cubică centrată pe corp. Densitate - 7,2 g/cm3. Punctele de topire și de fierbere sunt 1890 o C și, respectiv, 2680 o C.
Starea de oxidare a cromului în compuși
Cromul poate exista sub forma unei substanțe simple - un metal, iar starea de oxidare a metalelor în stare elementară este egală cu zero, deoarece distribuția densității electronilor în ele este uniformă.
Stări de oxidare (+2) Și (+3) cromul apare în oxizi (Cr +2 O, Cr +3 2 O 3), hidroxizi (Cr +2 (OH) 2, Cr +3 (OH) 3), halogenuri (Cr +2 Cl 2, Cr +3 Cl 3). ), sulfați (Cr +2SO4, Cr+32(SO4)3) și alți compuși.
Cromul se caracterizează și prin starea sa de oxidare (+6) : Cr +6 O 3, H 2 Cr + 6 O 4, H 2 Cr + 6 2 O 7, K 2 Cr + 6 2 O 7 etc.
Exemple de rezolvare a problemelor
EXEMPLUL 1
EXEMPLUL 2
| Exercițiu | Fosforul are aceeași stare de oxidare în următorii compuși: a) Ca3P2 şi H3PO3; b) KH2PO4 şi KPO3; c) P4O6 şi P4O10; d) H3PO4 şi H3PO3. |
| Soluţie | Pentru a da răspunsul corect la întrebarea pusă, vom determina alternativ gradul de oxidare a fosforului în fiecare pereche de compuși propuși. a) Starea de oxidare a calciului este (+2), oxigen și hidrogen - (-2) și respectiv (+1). Să luăm valoarea stării de oxidare a fosforului ca „x” și „y” în compușii propuși: 3 ×2 + x ×2 = 0; 3 + y + 3×(-2) = 0; Răspunsul este incorect. b) Starea de oxidare a potasiului este (+1), oxigenul și hidrogenul sunt (-2) și respectiv (+1). Să luăm valoarea stării de oxidare a clorului ca „x” și „y” în compușii propuși: 1 + 2×1 +x + (-2)×4 = 0; 1 + y + (-2)×3 = 0; Răspunsul este corect. |
| Răspuns | Opțiunea (b). |
Introducere
Stare de oxidare (CO) - acesta este un simbol în chimie care servește la determinarea sarcinii unui atom al unui element chimic (sau grup de elemente). Fără stări de oxidare, nu poate fi rezolvată o singură problemă, nici o singură ecuație nu poate fi compilată, dar cel mai important, fără ele nu putem determina clar proprietățile unui element și ce rol va juca în diverși compuși.
Este semnificativ faptul că sistemul periodic (PS) al D.I. Mendeleev este grupat în cel mai ingenios mod: toate elementele sunt împărțite în perioade, grupuri, subgrupe, numerele lor de serie corespund și anumitor indicatori. Datorită acestui fapt, nu trebuie să învățăm pe de rost calitățile fiecărui element chimic (CE), deoarece îl putem găsi cu ușurință în tabel și stabilim tot ce este necesar. Cu toate acestea, chiar și în acest caz, unii oameni, uitând de cunoștințele școlare ale cursului de chimie (sau neglijând-o la un moment dat), sunt nevoiți să revină la studiul mai detaliat a acestei teme.
Deci, mai întâi trebuie să vă formați ideile obiective corecte despre crom ( Cr
), înțelegeți poziția sa în PS și apoi puteți trece la partea cea mai importantă - exersați.
Crom - Cr, poziție în tabelul periodic, proprietăți fizice și chimice
Crom - este o culoare solidă, metalică, strălucitoare, alb-argintie (sau albăstruie).. Este destul de fragil, dar in acelasi timp are un avantaj incomparabil fata de multe alte metale - rezistenta la coroziune; Acesta este motivul pentru care este o componentă importantă în producția de oțel inoxidabil și este, de asemenea, utilizat pentru a acoperi suprafața altor metale care sunt mai predispuse la coroziune. Cromul are o conductivitate termică și electrică slabă.
ChE este situat în grupa VI, perioada 4, are numărul de serie 24 și are o masă atomică de 52 g/mol. Datorită pasivării, cromul nu interacționează cu sulful ( H2SO4) și azot ( HNO3) acizi, prezintă stabilitate în aer.
Acest metal amfoter - Aceasta înseamnă că se poate dizolva atât în acizi, cât și în alcali. Elementul se dizolvă în acizi puternici diluați (de exemplu, acid clorhidric acid clorhidric), în condiții normale (n.s.) interacționează numai cu fluorul ( F). Când este încălzit, cromul poate interacționa cu elemente din grupa VII (halogeni), oxigen O 2, bor B, azot N 2, gri S 2, siliciu Si. Daca il incalzesti Cr, atunci este capabil să reacționeze cu vaporii de apă.
Acum să vorbim direct despre ce stări de oxidare are un anumit CE: poate dobândi CO +4, +6, precum și +2 într-un spațiu fără aer, +3 într-un spațiu cu aer. Cromul, ca orice alt metal, este un agent reducător puternic.
Substanțe cu diferite stări de oxidare
- +2. Când Cr dobândește CO+2, substanța demonstrează proprietăți de restaurare de bază și foarte puternice. De exemplu, oxidul de crom (II) - CrO, hidroxid de crom - Cr(OH)2, multe săruri. Compușii acestui element cu fluor sunt sintetizați( CrF 2), clor( CrCl2) și așa mai departe.
- +3. Aceste substanțe au proprietăți amfotere și pot fi de diferite culori (dar mai ales verzi H2O). De exemplu, să luăm oxidul Cr2O3(aceasta este o pulbere verzuie care nu se dizolvă în), Cr(OH)3, cromiți NaCrO2.
- +4. Astfel de compuși sunt foarte rari: nu formează săruri sau acizi și aproape nu se lucrează cu ei. Dar printre substanțele cunoscute există un oxid CrO2, tetrahalogenură CrF 4, CrCl 4.
- +6. Chrome s CO+6, formând săruri, este de natură acidă, foarte otrăvitoare, hidroscopică și are, de asemenea, proprietăți puternice de oxidare. Exemple: CrO3(arata ca niste cristale rosii), K2CrO4, H2CrO4, H2Cr2O7. Elementul este capabil să formeze două tipuri de hidroxizi (deja enumerate).
Cum se determină CO în substanțe complexe
Probabil că ești deja familiarizat cu regula „încrucișării”. Ce se întâmplă dacă conexiunea are, de exemplu, cât trei elemente?
În acest caz, ne uităm la ultimul element al substanței, determinăm starea sa de oxidare și înmulțim cu coeficientul din dreapta (desigur, dacă există). Separăm mental ultimul element (cu o stare de oxidare deja certă) de celelalte două elemente. Noi cerem asta CO primele două și ultimele elemente adunate la zero.
Să ne uităm la un exemplu:
- PbCrO4 - cromat de plumb (II), care arată ca o sare roșie. La sfârșitul formulei se află oxigenul, a cărui stare de oxidare va fi întotdeauna (cu excepția unor cazuri) -2. -2*4=-8. Pb (plumb) are CO+2. Acțiunile ulterioare vor fi similare cu o ecuație algebrică, dar pentru a fi sincer, atunci când o persoană este deja bine versată în determinarea stărilor de oxidare și știe cum să folosească tabelul de solubilitate, este foarte posibil să se evite astfel de calcule. Deci, notăm un element cu o stare de oxidare necunoscută (crom) ca o variabilă de literă. 2+x-8=0;x=8-2;x=6. Variabila este 6, prin urmare starea de oxidare a cromului devine +6.
Încercați să aranjați singur stările de oxidare în următoarele formule:
- Na2CrO4;
- BaCrO4;
- Fe(CrO2)2;
- Cr2O7;
- H2CrO4.
Crom -unul dintre cele mai interesante elemente chimice, compușii cu care sunt un lucru complex, dar necesar de înțeles. Ar fi grozav dacă aceste exemple ajută la înțelegerea unui subiect atât de minuțios.
„site” editorial