Proteinele sunt substanțe organice cu greutate moleculară mare. Ce sunt proteinele. Proteine atât de diferite
"Introducere în biologie generală și ecologie. Clasa a 9-a". A.A. Kamensky (gdz)
Compoziția și structura proteinelor
Întrebarea 1. Ce substanțe se numesc proteine sau proteine?
Proteine (proteine) sunt heteropolimeri formați din 20 de monomeri diferiți – alfa-aminoacizi naturali. Proteinele sunt polimeri neregulați.
Structura generală a unui aminoacid poate fi reprezentată după cum urmează:
R-C (NH2)-COOH. Toți aminoacizii au o grupare amino (-MH2) și o grupare carboxil (-COOH) și diferă în structura și proprietățile radicalilor. Aminoacizii dintr-o proteină sunt legați printr-o peptidă
Legătura -N (H) -C (= O), prin urmare proteinele sunt numite și peptide.
Cazeina pentru proteina din lapte sau cheratina pentru proteina părului. Aranjarea spațială a proteinelor: Lucrul pliabil: Proteinele sunt substanțele naturale cu cea mai mare diversitate chimică. Tripeptide diferite din punct de vedere structural pot fi deja combinate din 3 aminoacizi diferiți 6. Atomul de azot, cu electronegativitatea sa ridicată, atrage un electron de legătură către el; creează o sarcină parțială negativă δ-. Exemplu: Astfel de molecule se numesc molecule dipol, deoarece sarcinile lor dau naștere unor atracții precum cei doi poli ai unui magnet.
Dacă un alt dipol se apropie de forma legăturilor de hidrogen. De exemplu: - rezultatul acţiunii legăturilor de hidrogen între grupările peptidice, şi anume între grupările ceto şi amino deschise. Dimer - Mai multe structuri terțiare se reunesc pentru a forma aceste unități funcționale foarte mari.
Întrebarea 2. Care este structura primară a unei proteine?
Într-o moleculă de proteină, aminoacizii sunt legați între ei printr-o legătură peptidică între atomii de carbon și azot. În structura unei molecule de proteine, se distinge structura primară - secvența reziduurilor de aminoacizi.
Întrebarea 3. Cum se formează structurile proteice secundare, terțiare și cuaternare?
Structura secundară a unei proteine este de obicei o structură elicoidală (alfa helix) care este ținută împreună prin multe legături de hidrogen care apar între grupurile C=O și NH strâns distanțate. Un alt tip de structură secundară este stratul beta, sau stratul pliat; acestea sunt două lanțuri polipeptidice paralele legate prin legături de hidrogen perpendiculare pe lanțuri.
Structura terțiară a unei molecule de proteină este o configurație spațială asemănătoare unui globul compact. Este susținut de legături ionice, de hidrogen și disulfură (S=S), precum și de interacțiuni hidrofobe.
Structura cuaternară este formată prin interacțiunea mai multor globule, care sunt combinate într-un complex (de exemplu, o moleculă de hemoglobină este formată din patru astfel de subunități).
Exemplu: permanente. Agenții reducători descompun legăturile de hidrogen din cheratina. Părul este apoi injectat în forma dorită și creat de oxidanți cu noi legături încrucișate. Precipitarea proteinelor: - formarea unui precipitat, a unei substanțe precipitate, care apoi precipită - ce? Prin adăugarea anumitor substanțe - creșterea concentrației peste punctul de saturație astfel încât substanța să nu se mai poată dizolva - adăugarea unui alt solvent pentru ca substanța să nu se mai poată dizolva. Denatura. O înveliș hidratantă nu se mai poate forma deoarece lanțurile laterale hidrofile nu mai sunt îndreptate spre exterior.
Întrebarea 4. Ce este denaturarea proteinelor?
Pierderea unei molecule proteice a structurii sale se numește denaturare; poate fi cauzată de febră, deshidratare, radiații etc. Dacă în timpul denaturarii structura primară nu este perturbată, atunci când sunt restabilite condițiile normale, structura proteinei este complet recreată. Dacă acțiunea factorului crește, structura primară a proteinei, lanțul polipeptidic, este și ea distrusă. Acesta este un proces ireversibil - proteina nu poate restabili structura. De exemplu, la temperaturi ridicate (peste 42°C) în corpul uman, multe proteine se denaturează ireversibil.
Proteina nu se mai poate dizolva și precipita. Electroforeză. La fel ca aminoacizii, proteinele pot fi, de asemenea, separate unele de altele. Această metodă este foarte utilă în medicină. Procedura: Se aplica un amestec de proteine pe gel si apoi se aplica tensiune. Proteinele încep să migreze în moduri diferite, rata de migrare depinzând de mărimea și încărcătura proteinelor. După un anumit timp, valorile sunt citite. În diferite boli, una sau alta grupă de proteine poate fi acum crescută sau scăzută. Funcția proteinelor: - biocataliză: enzime - proteine; activează reacțiile metabolice ca biocatalizatori.
Întrebarea 5. Pe ce bază sunt împărțite proteinele în simple și complexe?
Proteinele simple (proteinele) constau exclusiv din aminoacizi (albumine, globuline, keratina, colagen, histonă și altele). Proteinele complexe pot conține altele materie organică: carbohidrați (atunci se numesc glicoproteine), grăsimi (lipoproteine), acizi nucleici (nucleoproteine), acid fosforic (fosfoproteine), când o proteină este combinată cu orice substanță colorată se formează așa-numitele cromoproteine. Dintre cromoproteine, hemoglobina este cea mai studiată - materia colorantă a globulelor roșii de sânge (eritrocite).
Comunicare: multe substanțe de semnalizare sunt proteine; ex. transportul insulinei, somatotropinei, eritropoietinei: proteinele globulare sunt solubile în apă și sânge; se poate lega de substanțe care sunt insolubile în apă și prin urmare sunt transportate prin sânge.
Oxigenul se leagă de hemoglobină. Foaie de soluție pentru construirea aminoacizilor. Aminoacizi - proteinele sunt formate din aminoacizi. Aminoacizii formează baza lumii vii. 1 Structura aminoacizilor. Aminoacizii sunt molecule organice care cel puțin.
Activitatea de viață a unei celule se bazează pe procese biochimice care au loc la nivel molecular și servesc ca subiect de studiu al biochimiei. În consecință, fenomenele de ereditate și variabilitate sunt, de asemenea, asociate cu moleculele substanțelor organice și, în primul rând, cu acizi nucleici si proteine.
Compoziția proteinelor
Proteinele sunt molecule mari formate din sute și mii de unități elementare - aminoacizi. Astfel de substanțe, constând din unități elementare repetate - monomeri, se numesc polimeri. În consecință, proteinele pot fi numite polimeri, ai căror monomeri sunt aminoacizi.
Aminoacizi 1 Structura aminoacizilor Aminoacizii constau dintr-un grup acid carboxilicși grupări amino. Cel mai simplu aminoacid este glicina cu 2 atomi de carbon. Biologie farmaceutică Fundamentele biochimiei Prof. Manual Organizarea ierarhică a structurilor biologice Trei etape în evoluția vieții Ce este biochimia? Explorarea vieții la nivel molecular Viața așa cum o cunoaștem noi.
Proteine: începând cu teorie
Aminoacizi și peptide pentru îmbunătățirea plantelor de Dr. Ing. Economia frunzelor. Ziua 1: Concentrația de denaturare și determinarea concentrației sedimentelor în mediile de sedimente. Ziua 2: Cromatografia de gelificare. Aminoacizi. Aminoacizii sunt numiți acizi carboni în care unul sau mai mulți atomi de hidrogen ai grupării alchil sunt înlocuiți cu o grupare amino.
În total, într-o celulă vie sunt cunoscute 20 de tipuri de aminoacizi. Denumirea aminoacidului s-a datorat conținutului din compoziția sa de grupare amino NHy, care are proprietăți bazice, și grupare carboxil COOH, care are proprietăți acide. Toți aminoacizii au aceeași grupă NH2-CH-COOH și diferă unul de celălalt printr-o grupare chimică numită radical - R. Legătura aminoacizilor într-un lanț polimeric are loc datorită formării unei legături peptidice (CO - NH) între gruparea carboxil a unui aminoacid și gruparea amino a altui aminoacid. Aceasta eliberează o moleculă de apă. Dacă lanțul polimeric rezultat este scurt, se numește oligopeptidă, dacă este lung, se numește polipeptidă.
Introducere în biochimie, aminoacizi Prof. Subiecte de curs Albert Dushl Introducere în biochimie; Aminoacizi peptide și proteine enzime funcții proteice carbohidrați lipide nucleotide. Electroliți Electroliții conduc electricitatea în soluție apoasă. Electroliții includ acizi, baze și săruri, deoarece toți sunt prezenți în soluție apoasă, cel puțin parțial, în formă ionică.
Aminoacizi, peptide și proteine. Proteinele îndeplinesc o varietate de funcții în sisteme biologice. Scopul setului de diapozitive este de a explica formarea și structura insulinei cu hormonul proteic. Să explicăm pe scurt cum să producem artificial insulină. Structura: - Aminoacizi - Legatura peptidica - Structura primara - Structura secundara - Structuri tertiare si cuaternare.
Structura proteinelor
Când se ia în considerare structura proteinelor, se disting structurile primare, secundare, terțiare.
Structura primară determinată de ordinea aminoacizilor din lanț. O schimbare în aranjamentul chiar și a unui aminoacid duce la formarea unei molecule proteice complet noi. Numărul de molecule de proteine care se formează prin combinarea a 20 de aminoacizi diferiți atinge o cifră astronomică.
Peptidele și polipeptidele sunt lanțuri de 20 de lanțuri diferite. Ce calitati au? Cum reacţionează ele cu apa? Cum reacționați unul cu celălalt? Cum se determină diferențele de forță? Ajutor: Calculator. Puncte acordate: Total de puncte: Notă: Sarcina 1 Amoniacul este redus astăzi la scară industrială. Derivații de azot sunt baze organice slabe. Grupe funcționale Cea mai simplă amină, metanamina. Amoniacul are trei atomi care pot fi înlocuiți formal cu eteri organici.
Ceea ce este important deoarece dau 3 exemple! Ce este glicopanoza? Structura aminoacizilor Sarcină Citiți cu atenție textul următor și finalizați lucrarea în scris. Încercați să răspundeți la toate întrebările. Ed. Ch. 3 introducere: aminoacizi esențiali, degradarea biosintezei, semnificația metabolică.
Dacă molecule mari (macromolecule) ale proteinei ar fi localizate în celulă într-o stare alungită, ele ar ocupa prea mult spațiu în ea, ceea ce ar îngreuna funcționarea celulei. În acest sens, moleculele de proteine sunt răsucite, îndoite, pliate într-o varietate de configurații. Deci, pe baza structurii primare apare structura secundara - lanțul proteic se încadrează într-o spirală formată din spire uniforme. Virajele învecinate sunt interconectate prin legături slabe de hidrogen, care, atunci când sunt repetate de mai multe ori, dau stabilitate moleculelor de proteine cu această structură.
Structura moleculelor si acizilor nucleici relevante din punct de vedere biologic: - Depozitare informatii genetice. Proteine: - Funcții de reglementare. - Blocuri de construcție din biomembrane. Lipide și lipide: - Blocuri de construcție. Fișă de lucru, notă, figura 1. Clase biologice de substanțe. Cele mai importante trei clase de biologie sunt grăsimile, zaharurile și proteinele. Ele aparțin nutrienților din dieta noastră și vor fi.
Și de ce sunt atât de importante? Fundamente Conceptul de donor-acceptor de protoni. Hidrogen, baze protice și acide. Sunt multe lucruri interesante de spus despre această mare știință care este biologia și, prin urmare, mâinile. Biomoleculele sunt compuși chimici, care sunt în principal ființe vii. Aceste substanțe sunt împărțite în patru tipuri principale: proteine, acizi nucleici, carbohidrați și lipide.
Spirala structurii secundare se potrivește într-o bobină, formând structura tertiara. Forma bobinei în fiecare tip de proteină este strict specifică și depinde complet de structura primară, adică de ordinea aminoacizilor din lanț. Structura terțiară este ținută împreună prin multe legături electrostatice slabe: grupurile de aminoacizi încărcate pozitiv și negativ atrag și reunesc chiar și secțiuni larg distanțate ale lanțului proteic. Alte părți ale moleculei de proteine, purtând, de exemplu, grupări hidrofobe (repelente la apă), se apropie și ele una de cealaltă.
Proteinele sunt biomolecule formate din unul sau mai multe lanțuri de unități mai mici numite aminoacizi. Există 20 de tipuri diferite de aminoacizi și, în funcție de secvența pe care o formează într-un lanț, acesta va fi identic cu o proteină. Aceste lanțuri se pliază în moduri diferite, care sunt ghidate de secvența de aminoacizi care dă proprietăți diferite proteine. Proteinele au o gamă largă de funcții, de la contracția musculară la transportul oxigenului și cataliza proceselor metabolice.
Toate activitățile desfășurate de ființe vii, de la respirația animalelor până la fotosinteza plantelor, sunt reacții chimice, iar marea diferență dintre lumea vie și cea nevie este că, în primul caz, proteine speciale numite enzime facilitează și ele. face aceste reacții mult mai rapide, ceea ce se numește cataliză.
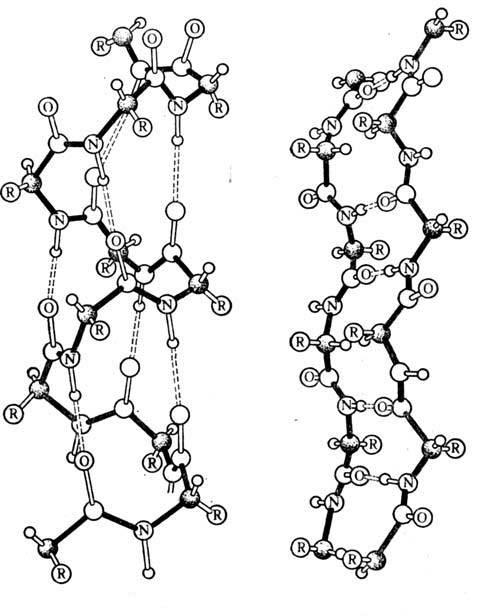
Unele proteine, cum ar fi hemoglobina, constau din mai multe lanțuri care diferă în structura primară. Combinându-se împreună, ele creează o proteină complexă care are nu numai terțiare, ci și structura cuaternară(Fig. 2).
În structurile moleculelor de proteine se observă următorul model: cu cât nivelul structural este mai ridicat, cu atât legăturile chimice care le susțin sunt mai slabe. Legăturile care formează structura cuaternară, terțiară, secundară sunt extrem de sensibile la condițiile fizico-chimice ale mediului, temperatură, radiații etc. Sub influența lor, structurile moleculelor proteice sunt distruse până la structura primară - originală. Se numește o astfel de încălcare a structurii naturale a moleculelor de proteine denaturare. Când agentul de denaturare este îndepărtat, multe proteine sunt capabile să-și restabilească în mod spontan structura inițială. Dacă proteina naturală este supusă acțiunii temperaturii ridicate sau acțiunii intense a altor factori, atunci este denaturată ireversibil. Faptul prezenței denaturarii ireversibile a proteinelor celulare explică imposibilitatea vieții la temperaturi foarte ridicate.
Aceste imagini sunt reprezentări computerizate ale unor proteine. Acizii nucleici sunt formați din lanțuri lungi de unități numite nucleotide, care la rândul lor sunt formate din trei componente principale: o grupă fosfat, un zahăr cu cinci atomi de carbon și o bază azotată. Există două tipuri diferite de acizi nucleici, în funcție de ce zahăr formează nucleotidele; molecula va fi acid ribonucleic dacă zahărul este riboză sau acid dezoxiribonucleic dacă este deoxiriboză.
Bazele Adeninei și Guaninei sunt mai mari și se numesc purine, în timp ce timina, citozină și uracil sunt mai mici și sunt cunoscute sub numele de pirimidine. Aceasta este structura chimică a unei nucleotide. În albastru este grupul fosfat, în negru este zahărul cu cinci atomi de carbon, iar în roșu este baza azotată. Numele compusului este 5 monofosfat-adenozină, deși pentru a ușura lucrurile puteți spune doar „adenină”.


Rolul biologic al proteinelor în celulă
Proteine, numite și proteine(protos grecesc - primul),în celulele animalelor și plantelor îndeplinesc funcții diverse și foarte importante, care includ următoarele.
Lanțurile se leagă prin nucleotidele lor prin interacțiuni electrostatice prin bazele lor azotate. Iată un șir simplu de acid nucleic. Nucleotidele sunt legate prin grupări fosfat și un zahăr cu cinci atomi de carbon, în timp ce bazele azotate sunt expuse. Când sunt un lanț dublu, cele două lanțuri sunt conectate prin bazele lor azotate.
Toate proteinele provin din gene. Celălalt este în plus față de codificare și se numește lanț întărit sau matriță. Ce lanț are forma și care este codificat depinde de genă. Nelson; Cox Lechninger Principiile biochimiei. A fost o piatră de hotar ca Securitate Socială si securitate sociala.
catalitic. catalizatori naturali - enzime sunt în întregime sau aproape în întregime proteine. Datorită enzimelor, procesele chimice din țesuturile vii sunt accelerate de sute de mii sau milioane de ori. Sub acțiunea lor, toate procesele au loc instantaneu în condiții „moale”: la temperatura normală a corpului, într-un mediu neutru pentru țesutul viu. Viteza, acuratețea și selectivitatea enzimelor sunt incomparabile cu oricare dintre catalizatorii artificiali. De exemplu, o moleculă de enzimă într-un minut realizează descompunerea a 5 milioane de molecule de peroxid de hidrogen (H202). Enzimele sunt selective. Deci, grăsimile sunt descompuse de o enzimă specială care nu acționează asupra proteinelor și polizaharidelor (amidon, glicogen). La rândul său, o enzimă care descompune numai amidonul sau glicogenul nu acționează asupra grăsimilor.
Carbohidrați, lipide, acizi nucleici, proteine și biochimia musculară. Postat de: Natalia Pinheiro Mora Custodio. Glucide - Clasificare - Metabolism: Glicoliza - Glicogenoliza - Glicogeneza. Carbohidrații sunt definiți chimic ca polihidroxicetone sau polihidroxi aldehide, adică compuși organici cu cel puțin trei atomi de carbon, în care toți atomii de carbon au un hidroxil, cu excepția unuia care are un carbonil primar sau un carbonil secundar.
Acestea sunt substanțe caracterizate prin solubilitate scăzută în apă și alți solvenți polari și solubilitate ridicată în solvenți nepolari. Sunt cunoscute în mod obișnuit ca grăsimi și sunt proprietăți fizice asociat cu natura hidrofobă a structurilor lor, toate sintetizate din acetil-CoA.
Procesul de scindare sau sinteză a oricărei substanțe din celulă, de regulă, este împărțit într-o serie de operații chimice. Fiecare operație este efectuată de o enzimă separată. Un grup de astfel de enzime constituie o conductă biochimică.
Se crede că funcția catalitică a proteinelor depinde de structura lor terțiară; atunci când este distrusă, activitatea catalitică a enzimei dispare.
Este un polimer biologic, dar este abundent în corpul uman. Sunt formați din monomeri numiți aminoacizi. Cuvântul „proteină” provine din grecescul proteos, ceea ce înseamnă importanța sa. Acizi nucleici: acid dezoxiribonucleic și acid ribonucleic.
Importanța acidului dezoxiribonucleic, a acidului ribonucleic și a adenozin trifosfat. Acizii nucleici sunt molecule organice gigantice care conțin carbon, hidrogen, oxigen, azot și fosfor. Există două tipuri principale: acid dezoxiribonucleic și acid ribonucleic. Principalele structuri ale acizilor nucleici sunt nucleotidele.
De protecţie. Unele tipuri de proteine protejează celula și corpul în ansamblu de pătrunderea agenților patogeni și a corpurilor străine. Astfel de proteine sunt numite anticorpi. Anticorpii se leagă de proteinele bacteriilor și virușilor care sunt străine organismului, ceea ce le inhibă reproducerea. Pentru fiecare proteină străină, organismul produce „anti-proteine” speciale – anticorpi. Acest mecanism de rezistență la agenți patogeni se numește imunitate.
Structura contractilă a unei fibre musculare este formată din lanțuri proteice care alunecă pentru a contracta fibra musculară. Printre acestea se numără miozina și actina, care alcătuiesc filamentele groase și, respectiv, subțiri. Când un impuls trece printr-o fibră nervoasă, mușchii se contractă.
Carbohidrații Cei mai simpli carbohidrați se numesc monozaharide având cel puțin un atom de carbon asimetric, care caracterizează o regiune numită centru chiral deoarece furnizează izomeri optici. Au 3 până la 8 atomi de carbon, care se numesc trios, tetros, pentoze, hexoze, heptoses și, respectiv, octode. Cele mai comune monozaharide naturale, cum ar fi riboza, glucoza, fructoza și manoza, există ca hemiacetali ai lanțului ciclic general, fie ca furanoză, fie ca piranoză. În acești compuși, când carbonul C1 este un hidroxil liber, carbohidratul este reducător atunci când este încălzit. Această caracteristică este adesea folosită în reacțiile de identificare. Monozaharide Acestea sunt cele mai simple carbohidrați din care sunt derivate toate celelalte clase. Dintre acestea, cele mai importante sunt penetozele și hexozele. Astfel de forme se interconversează prin fenomenul murtatării. . Cele mai importante hexuri sunt.
Pentru a preveni bolile, oamenilor și animalelor li se injectează agenți patogeni slăbiți sau uciși (vaccinuri) care nu provoacă boli, dar provoacă celule speciale ale corpului să producă anticorpi împotriva acestor agenți patogeni. Dacă, după ceva timp, virusurile și bacteriile patogene pătrund într-un astfel de organism, ele întâlnesc o puternică barieră de protecție a anticorpilor.
hormonal. Mulți hormoni sunt și proteine. Alături de sistemul nervos, hormonii controlează activitatea diferitelor organe (și a întregului corp) prin intermediul sistemului reacții chimice.
reflectorizant. Proteinele celulare efectuează recepția semnalelor venite din exterior. În același timp, diverși factori de mediu (temperatură, chimici, mecanici etc.) provoacă modificări ale structurii proteinelor - denaturare reversibilă, care, la rândul său, contribuie la apariția reacțiilor chimice care oferă un răspuns celular la iritația externă. Această capacitate a proteinelor stă la baza activității sistemului nervos, a creierului.
Motor. Toate tipurile de mișcări ale celulei și ale corpului: pâlpâirea cililor la protozoare, contracția musculară la animalele superioare și alte procese motorii - sunt produse de un tip special de proteină.
Energie. Proteinele pot servi ca sursă de energie pentru celulă. Cu o lipsă de carbohidrați sau grăsimi, moleculele de aminoacizi sunt oxidate. Energia eliberată în acest proces este folosită pentru a susține procesele vitale ale corpului.
Transport. Hemoglobina proteică din sânge este capabilă să lege oxigenul din aer și să-l transporte în tot corpul. Această funcție importantă este, de asemenea, caracteristică altor proteine.
Plastic. Proteinele sunt principalul material de construcție al celulelor (membranele lor) și al organismelor (vasele lor de sânge, nervii, tractul digestiv etc.). În același timp, proteinele au specificitate individuală, adică în organismele oamenilor individuali există unele proteine care sunt caracteristice numai pentru el -
Astfel, proteinele sunt cea mai importantă componentă a celulei, fără de care manifestarea proprietăților vieții este imposibilă. Cu toate acestea, reproducerea celor vii, fenomenul eredității, așa cum vom vedea mai târziu, este asociată cu structurile moleculare ale acizilor nucleici. Această descoperire este rezultatul celor mai recente progrese în biologie. Acum se știe că celula vie posedă în mod necesar două tipuri de polimeri - proteine și acizi nucleici. Interacțiunea lor conține cele mai profunde aspecte ale fenomenului vieții.













