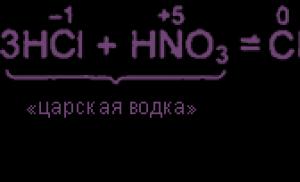Acid percloric cu metal. Clorul și compușii săi. Proprietățile chimice ale acidului clorhidric
CI2 la voi. T - gaz galben-verzui cu miros ascuțit sufocant, de 2,5 ori mai greu decât aerul, ușor solubil în apă (~ 6,5 g/l); X. R. în solvenți organici nepolari. Se găsește sub formă liberă numai în gazele vulcanice.
Metode de obținere
Pe baza procesului de oxidare a anionilor Cl -
2Cl - - 2e - = CI20
Industrial
Electroliza soluțiilor apoase de cloruri, mai des NaCl:
2NaCI + 2H2O = CI2 + 2NaOH + H2
Laborator
Oxidarea conc. HCI cu diverși agenți oxidanți:
4HCI + MnO2 = CI2 + MnCl2 + 2H2O
16HCl + 2KMnO 4 = 5Cl 2 + 2MnCl 2 + 2KCl + 8H 2 O
6HCl + KClO 3 = 3Cl 2 + KCl + 3H 2 O
14HCl + K 2 Cr 2 O 7 = 3Cl 2 + 2CrCl 3 + 2KCl + 7H 2 O
Proprietăți chimice
Clorul este un agent oxidant foarte puternic. Oxidează metalele, nemetalele și substanțele complexe, transformându-se în anioni Cl foarte stabili:
Cl 2 0 + 2e - = 2Cl -
Reacții cu metalele
Metalele active într-o atmosferă de clor gazos uscat se aprind și ard; în acest caz, se formează cloruri metalice.
CI2 + 2Na = 2NaCI
3Cl 2 + 2Fe = 2FeCl 3
Metalele slab active sunt mai ușor oxidate de clorul umed sau de soluțiile sale apoase:
Cl 2 + Cu = CuCl 2
3Cl 2 + 2Au = 2AuCl 3
Reacții cu nemetale
Clorul nu interacționează direct doar cu O 2, N 2, C. Reacțiile cu alte nemetale apar în condiții diferite.
Se formează halogenuri nemetalice. Cea mai importantă reacție este interacțiunea cu hidrogenul.
CI2 + H2 = 2HCI
CI2 + 2S (topită) = S2CI2
ЗCl 2 + 2Р = 2РCl 3 (sau РCl 5 - peste Cl 2)
2Cl2 + Si = SiCl4
3Cl2 + I2 = 2ICl3
Deplasarea nemetalelor libere (Br 2, I 2, N 2, S) din compușii lor
CI2 + 2KBr = Br2 + 2KCI
CI2 + 2KI = I2 + 2KCl
CI2 + 2HI = I2 + 2HCI
CI2 + H2S = S + 2HCI
3CI2 + 2NH3 = N2 + 6HCI
Disproporție de clor în apă și soluții apoase de alcaline
Ca urmare a auto-oxidării-autoreducerii, unii atomi de clor sunt transformați în anioni Cl -, în timp ce alții în stare de oxidare pozitivă sunt incluși în anionii ClO - sau ClO 3 -.
Cl 2 + H 2 O = HCl + HClO acid hipocloros
CI2 + 2KOH = KCI + KClO + H2O
3Cl 2 + 6KOH = 5KCl + KClO 3 + 3H 2 O
3Cl2 + 2Ca(OH)2 = CaCl2 + Ca(ClO)2 + 2H2O
Aceste reacții sunt importante deoarece duc la producerea de compuși ai oxigenului clor:
KClO 3 şi Ca(ClO) 2 - hipocloriţi; KClO 3 - clorat de potasiu (sare Berthollet).
Interacțiunea clorului cu substanțele organice
a) înlocuirea atomilor de hidrogen în moleculele OM
b) atașarea moleculelor de Cl 2 la locul de ruptură a legăturilor multiple carbon-carbon
H 2 C=CH 2 + Cl 2 → ClH 2 C-CH 2 Cl 1,2-dicloretan
HC≡CH + 2Cl 2 → Cl 2 HC-CHCl 2 1,1,2,2-tetracloretan
Acid clorhidric și acid clorhidric
Acid clorhidric gazos
Proprietati fizice si chimice
HCl - acid clorhidric. La rev. T - incolor. un gaz cu miros înțepător, se lichefiază destul de ușor (p.t. -114°C, bp -85°C). HCl anhidru, atât în stare gazoasă, cât și în stare lichidă, este neconductiv electric și inert chimic față de metale, oxizi și hidroxizi de metal, precum și multe alte substanțe. Aceasta înseamnă că, în absența apei, clorura de hidrogen nu prezintă proprietăți acide. Numai la temperaturi foarte ridicate HCl gazos reacționează cu metalele, chiar și cu cele slab active precum Cu și Ag.
Proprietățile reducătoare ale anionului clorură din HCl apar și ele într-o mică măsură: este oxidat de fluor la vol. T și, de asemenea, la T mare (600°C) în prezența catalizatorilor, reacționează reversibil cu oxigenul:
2HCI + F2 = CI2 + 2HF
4HCI + O2 = 2Cl2 + 2H2O
HCl gazos este utilizat pe scară largă în sinteza organică (reacții de clorurare).
Metode de obținere
1. Sinteză din substanțe simple:
H2 + CI2 = 2HCI
2. Se formează ca produs secundar în timpul clorării hidrocarburilor:
R-H + CI2 = R-CI + HCI
3. In laborator se obtine prin actiunea conc. H2SO4 pentru cloruri:
H2SO4 (conc.) + NaCl = 2HCl + NaHSO4 (cu încălzire scăzută)
H 2 SO 4 (conc.) + 2NaCl = 2HCl + Na 2 SO 4 (cu încălzire foarte mare)
Soluție apoasă de HCI - acid puternic (clorhidric sau clorhidric)
HCl este foarte solubil în apă: la vol. În 1 litru de H 2 O se dizolvă ~ 450 de litri de gaz (dizolvarea este însoțită de eliberarea unei cantități semnificative de căldură). Soluția saturată are o fracție de masă de HCI egală cu 36-37%. Această soluție are un miros foarte înțepător, sufocant.
Moleculele de HCI din apă se dezintegrează aproape complet în ioni, adică o soluție apoasă de HCI este un acid puternic.
Proprietățile chimice ale acidului clorhidric
1. HCl dizolvat în apă prezintă toate proprietățile generale ale acizilor datorită prezenței ionilor H +
HCl → H + + Cl -
Interacţiune:
a) cu metale (până la H):
2HCI2 + Zn = ZnCI2 + H2
b) cu oxizi bazici și amfoteri:
2HCl + CuO = CuCl2 + H2O
6HCl + Al2O3 = 2AlCI3 + ZN2O
c) cu baze și hidroxizi amfoteri:
2HCI + Ca(OH)2 = CaCI2 + 2H2O
3HCI + Al(OH)3 = AlCI3 + ZH2O
d) cu săruri ale acizilor mai slabi:
2HCI + CaC03 = CaCI2 + CO2 + H3O
HCI + C6H5ONa = C6H5OH + NaCI
e) cu amoniac:
HCI + NH3 = NH4CI
Reacții cu agenți oxidanți puternici F 2, MnO 2, KMnO 4, KClO 3, K 2 Cr 2 O 7. Anionul Cl - este oxidat la halogen liber:
2Cl - - 2e - = CI20
Pentru ecuațiile de reacție, vezi „Producerea de clor”. O importanță deosebită este ORR între acizii clorhidric și acizii azotic:

Reacții cu compuși organici
Interacţiune:
a) cu amine (ca baze organice)
R-NH 2 + HCl → + Cl -
b) cu aminoacizi (ca compuși amfoteri)

Oxizi de clor și oxoacizi
Oxizi acizi

Acizi

Săruri
Proprietăți chimice
1. Toți oxoacizii de clor și sărurile lor sunt agenți oxidanți puternici.
2. Aproape toți compușii se descompun atunci când sunt încălziți din cauza oxidării-reducerii sau disproporționării intramoleculare.

Pudră de albire
Varul cloric (de albire) este un amestec de hipoclorit și clorură de calciu, are efect de albire și dezinfectare. Uneori considerată ca exemplu de sare mixtă care conține simultan anioni a doi acizi:

apă javel
Soluție apoasă de clorură de potasiu și hapoclorit KCl + KClO + H 2 O
15.1. Caracteristici generale ale halogenilor și calcogenilor
Halogenii („săruri generatoare”) sunt elemente din grupa VIIA. Acestea includ fluor, clor, brom și iod. Acest grup include, de asemenea, astatinul instabil și, prin urmare, nu se găsește în natură. Uneori, hidrogenul este inclus în acest grup.
Calcogenii („producători de cupru”) sunt elemente ale grupului VIA. Acestea includ oxigen, sulf, seleniu, teluriu și poloniu, care practic nu se găsesc în natură.
Din cei opt atomi existenți în natură elemente dintre aceste două grupe, cei mai comuni atomi de oxigen ( w= 49,5%), urmată de atomi de clor din abundență ( w= 0,19%), apoi – sulf ( w= 0,048%), apoi fluor ( w= 0,028%). Atomii altor elemente sunt de sute și de mii de ori mai mici. Ai studiat deja oxigenul în clasa a VIII-a (Capitolul 10); dintre celelalte elemente, cele mai importante sunt clorul și sulful - le vei familiariza în acest capitol.
Razele orbitale ale atomilor de halogeni și calcogeni sunt mici și doar al patrulea atom din fiecare grup se apropie de un angstrom. Acest lucru duce la faptul că toate aceste elemente sunt elemente neformatoare de metal și numai telurul și iodul prezintă unele semne de amfoteritate.
Formula electronică de valență generală a halogenilor este ns 2 n.p. 5 și calcogeni - ns 2 n.p. 4 . Dimensiunea redusă a atomilor nu le permite să renunțe la electroni; dimpotrivă, atomii acestor elemente tind să-i accepte, formând anioni încărcați unic (pentru halogeni) și dublu încărcați (pentru calcogeni). Prin combinarea cu atomi mici, atomii acestor elemente formează legături covalente. Șapte electroni de valență permit atomilor de halogen (cu excepția fluorului) să formeze până la șapte legături covalente și șase electroni de valență ai atomilor de calcogen - până la șase legături covalente.
În compușii cu fluor, elementul cel mai electronegativ, este posibilă o singură stare de oxidare și anume –I. Oxigenul, după cum știți, are o stare de oxidare maximă de +II. Pentru atomii altor elemente, cea mai mare stare de oxidare este egală cu numărul grupului.
Substanțele simple ale elementelor grupei VIIA sunt de același tip ca structură. Ele constau din molecule diatomice. În condiții normale, fluorul și clorul sunt gaze, bromul este un lichid, iar iodul este un solid. După proprietățile lor chimice, aceste substanțe sunt agenți oxidanți puternici. Datorită creșterii dimensiunii atomilor cu creșterea numărului atomic, activitatea lor oxidativă scade.
Dintre substanțele simple ale elementelor grupei VIA, în condiții normale doar oxigenul și ozonul sunt gazoase, constând din molecule diatomice, respectiv triatomice; restul sunt solide. Sulful este format din molecule ciclice de opt atomi S 8, seleniu și teluriu din moleculele polimerice Se nși Te n. În ceea ce privește activitatea lor oxidativă, calcogenii sunt inferiori halogenilor: doar oxigenul este un agent oxidant puternic, în timp ce restul prezintă proprietăți oxidante într-o măsură mult mai mică.
Compus compuși cu hidrogen halogenii (HE) respectă pe deplin regula generală, iar calcogenii, pe lângă compușii obișnuiți cu hidrogen din compoziția H 2 E, pot forma și compuși cu hidrogen mai complecși din compoziția H 2 E n structura lantului. În soluțiile apoase, atât halogenurile de hidrogen, cât și alți hidrogeni de calcogen prezintă proprietăți acide. Moleculele lor sunt particule de acid. Dintre aceștia, doar HCl, HBr și HI sunt acizi puternici.
Pentru formarea halogenului oxizi necaracteristici, majoritatea sunt instabili, dar pentru toți halogenii sunt cunoscuți oxizi superiori ai compoziției E 2 O 7 (cu excepția fluorului, ai căror compuși cu oxigen nu sunt oxizi). Toți oxizii de halogen sunt substanțe moleculare; proprietățile lor chimice sunt oxizi acizi.
În conformitate cu capacitățile lor de valență, calcogenii formează două serii de oxizi: EO 2 și EO 3. Toți acești oxizi sunt acizi.
Hidroxizii de halogeni și calcogeni sunt oxoacizi.
Realizați formule electronice abreviate și diagrame energetice ale atomilor elementelor grupelor VIA și VIIA. Indicați electronii exteriori și de valență.
Clorul este cel mai comun și, prin urmare, cel mai important dintre halogeni.
În scoarța terestră, clorul se găsește în minerale: halit (sare de rocă) NaCl, silvit KCl, carnalit KCl MgCl 2 6H 2 O și multe altele. Principala metodă industrială de producție este electroliza clorurilor de sodiu sau potasiu.
O substanță simplă, clorul, este un gaz verzui cu un miros înțepător, sufocant. La –101 °C se condensează într-un lichid galben-verzui. Clorul este foarte otrăvitor; în timpul Primului Război Mondial chiar au încercat să-l folosească ca agent de război chimic.
Clorul este unul dintre cei mai puternici agenți oxidanți. Reacționează cu majoritatea substanțelor simple (excepții: gaze nobile, oxigen, azot, grafit, diamant și altele). Ca rezultat, se formează halogenuri:
CI2 + H2 = 2HCI (când este încălzit sau expus la lumină);
5Cl 2 + 2P = 2PCl 5 (când este ars în exces de clor);
CI2 + 2Na = 2NaCI (la temperatura camerei);
3Cl2 + 2Sb = 2SbCl3 (la temperatura camerei);
3Cl 2 + 2Fe = 2FeCl 3 (când este încălzit).
În plus, clorul poate oxida multe substanțe complexe, de exemplu:
Cl2 + 2HBr = Br2 + 2HCl (în fază gazoasă și în soluție);
Cl 2 + 2HI = I 2 + 2HCl (în fază gazoasă şi în soluţie);
CI2 + H2S = 2HCI + S (în soluţie);
CI2 + 2KBr = Br2 + 2KCI (în soluţie);
CI2 + 3H2O2 = 2HCI + 2H2O + O2 (în soluţie concentrată);
Cl 2 + CO = CCl 2 O (în fază gazoasă);
Cl 2 + C 2 H 4 = C 2 H 4 Cl 2 (în fază gazoasă).
În apă, clorul este parțial dizolvat (fizic) și reacționează parțial reversibil cu acesta (vezi § 11.4 c). Cu o soluție rece de hidroxid de potasiu (și orice alt alcali), o reacție similară are loc ireversibil:
CI2 + 2OH = CI + ClO + H2O.
Ca rezultat, se formează o soluție de clorură de potasiu și hipoclorit. Când reacţionează cu hidroxid de calciu, se formează un amestec de CaCl2 şi Ca(ClO)2, numit înălbitor.
Cu soluții concentrate fierbinți de alcaline, reacția decurge diferit:
3Cl2 + 6OH = 5CI + ClO3 + 3H2O.
Când reacţionează cu KOH, acesta produce clorat de potasiu, numit sare Berthollet.
Clorura de hidrogen este singura conexiune cu hidrogen clor Acest gaz incolor cu miros sufocant este foarte solubil în apă (reacționează complet cu el, formând ioni de oxoniu și ioni de clorură (vezi § 11.4). Soluția sa în apă se numește acid clorhidric sau acid clorhidric. Acesta este unul dintre cei mai importanți produse de tehnologie chimică, deoarece acidul clorhidric este consumat în multe industrii. De asemenea, este de mare importanță pentru oameni, în special pentru că este conținut în sucul gastric, facilitând digestia alimentelor.
Clorura de hidrogen a fost anterior produsă industrial prin arderea clorului în hidrogen. În prezent, nevoia de acid clorhidric este aproape complet satisfăcută prin utilizarea clorurii de hidrogen, formată ca produs secundar în timpul clorării diferitelor substanțe organice, de exemplu, metanul:
CH4 + CI2 = CH3 + HCI
Iar laboratoarele produc acid clorhidric din clorură de sodiu prin tratarea acesteia cu acid sulfuric concentrat:
NaCI + H2S04 = HCI + NaHS04 (la temperatura camerei);
2NaCI + 2H2S04 = 2HCI + Na2S2O7 + H20 (când este încălzit).
Superior oxid clor Cl 2 O 7 – lichid uleios incolor, substanță moleculară, oxid acid. Ca urmare a reacției cu apa, formează acid percloric HClO 4, singurul oxoacid clor care există ca substanță individuală; oxoacizii de clor rămași sunt cunoscuți numai în soluții apoase. Informațiile despre acești acizi clor sunt date în Tabelul 35.
Tabelul 35. Acizi clorurati si sarurile lor
C/O |
Formulă |
Nume |
Forta |
Nume |
clorhidric |
||||
hipocloros |
hipocloriti |
|||
clorură |
||||
hipocloros |
||||
perclorati |
Majoritatea clorurilor sunt solubile în apă. Excepțiile sunt AgCl, PbCl2, TlCl și Hg2Cl2. Formarea unui precipitat incolor de clorură de argint atunci când soluția de azotat de argint este adăugată la soluția de testare - reacție calitativă pentru ion clorură:
Ag + Cl = AgCl
Clorul poate fi obținut din cloruri de sodiu sau potasiu în laborator:
2NaCl + 3H 2 SO 4 + MnO 2 = 2NaHSO 4 + MnSO 4 + 2H 2 O + Cl 2
Ca agent oxidant atunci când se produce clor folosind această metodă, puteți utiliza nu numai dioxid de mangan, ci și KMnO 4, K 2 Cr 2 O 7, KClO 3.
Hipocloriții de sodiu și potasiu sunt incluși în diferite înălbitori de uz casnic și industrial. Înălbitorul este, de asemenea, folosit ca înălbitor și este folosit și ca dezinfectant.
Cloratul de potasiu este utilizat la producerea de chibrituri, explozivi și compoziții pirotehnice. Când este încălzit, se descompune:
4KCI03 = KCI + 3KCI04;
2KClO 3 = 2KCl + O 2 (în prezenţa MnO 2).
Se descompune și percloratul de potasiu, dar la o temperatură mai mare: KClO 4 = KCl + 2O 2.
1. Compuneți ecuații moleculare pentru reacțiile pentru care ecuații ionice sunt date în textul paragrafului.
2. Notează descriptiv ecuațiile pentru reacțiile date în textul paragrafului.
3. Alcătuiți ecuații de reacție care caracterizează proprietățile chimice ale a) clorului, b) acidului clorhidric (și acidului clorhidric), c) clorurii de potasiu și d) clorurii de bariu.
Proprietățile chimice ale compușilor clorului
Diverse modificări alotropice sunt stabile în diferite condiții element sulf. În condiții normale substanță simplă sulful este o substanță cristalină galbenă, fragilă, constând din opt molecule atomice:

Acesta este așa-numitul sulf ortorombic (sau -sulf) S 8. (Numele provine de la un termen cristalografic care caracterizează simetria cristalelor acestei substanțe). Când este încălzit, se topește (113 ° C), transformându-se într-un lichid galben mobil format din aceleași molecule. Odată cu încălzirea suplimentară, ciclurile sunt întrerupte și se formează molecule de polimer foarte lungi - topitura se întunecă și devine foarte vâscoasă. Acesta este așa-numitul sulf S n. Sulful fierbe (445 °C) sub formă de molecule biatomice S 2, similare ca structură cu moleculele de oxigen. Structura acestor molecule, ca și cea a moleculelor de oxigen, nu poate fi descrisă în cadrul modelului legăturii covalente. În plus, există și alte modificări alotropice ale sulfului.
În natură există zăcăminte de sulf nativ, din care este extras. Majoritatea sulfului extras este folosit pentru a produce acid sulfuric. O parte din sulf este folosit în agricultură pentru a proteja plantele. Sulful purificat este folosit în medicină pentru tratarea bolilor de piele.
Din compuși cu hidrogen sulful, cel mai important este hidrogenul sulfurat (monosulfan) H 2 S. Este un gaz otrăvitor incolor cu miros de ouă putrezite. Este ușor solubil în apă. Dizolvarea este fizică. Într-o mică măsură, protoliza moleculelor de hidrogen sulfurat are loc într-o soluție apoasă și, într-o măsură și mai mică, ionii de hidrosulfură rezultați (a se vedea Anexa 13). Cu toate acestea, o soluție de hidrogen sulfurat în apă se numește acid sulfurat de hidrogen (sau apă cu hidrogen sulfurat).
Hidrogenul sulfurat arde în aer:
2H 2 S + 3O 2 = 2H 2 O + SO 2 (cu exces de oxigen).
O reacție calitativă la prezența hidrogenului sulfurat în aer este formarea sulfurei de plumb negru (înnegrirea hârtiei de filtru umezită cu o soluție de nitrat de plumb:
H2S + Pb2 + 2H20 = PbS + 2H3O
Reacția se desfășoară în această direcție datorită solubilității foarte scăzute a sulfurei de plumb.
Pe lângă hidrogenul sulfurat, sulful formează și alți sulfani H2S n, de exemplu, disulfan H2S2, cu structură similară cu peroxidul de hidrogen. Este, de asemenea, un acid foarte slab; sarea sa este pirita FeS 2.
În conformitate cu capacitățile de valență ale atomilor săi, sulful formează doi oxid: SO 2 şi SO 3 . Dioxidul de sulf (cunoscut în mod obișnuit ca dioxid de sulf) este un gaz incolor cu un miros înțepător care provoacă tuse. Trioxidul de sulf (denumirea veche este anhidrida sulfurica) este o substanta solida, extrem de higroscopica, nemoleculara, care se transforma intr-o substanta moleculara cand este incalzita. Ambii oxizi sunt acizi. Când reacţionează cu apa formează dioxid de sulf, respectiv dioxid de sulf. acizi.
În soluții diluate, acidul sulfuric este un acid puternic tipic, cu toate proprietățile sale caracteristice.
Acidul sulfuric pur, precum și soluțiile sale concentrate, sunt agenți oxidanți foarte puternici, iar atomii de oxidare de aici nu sunt atomi de hidrogen, ci atomi de sulf, trecând din starea de oxidare +VI în starea de oxidare +IV. Ca rezultat, atunci când reacționează cu acid sulfuric concentrat, se formează de obicei dioxid de sulf, de exemplu:
Cu + 2H2S04 = CuS04 + S02 + 2H20;
2KBr + 3H2SO4 = 2KHSO4 + Br2 + SO2 + 2H2O.
Astfel, chiar și metalele care se află în seria de tensiuni la dreapta hidrogenului (Cu, Ag, Hg) reacționează cu acidul sulfuric concentrat. În același timp, unele metale destul de active (Fe, Cr, Al etc.) nu reacționează cu acidul sulfuric concentrat, acest lucru se datorează faptului că pe suprafața acestor metale se formează o peliculă protectoare densă sub influența acid sulfuric, împiedicând oxidarea ulterioară. Acest fenomen se numește pasivare.
Fiind un acid dibazic, acidul sulfuric formează două rânduri săruri: mediu și acru. Sărurile acide sunt izolate doar pentru elementele alcaline și amoniu; existența altor săruri acide este discutabilă.
Majoritatea sulfaților medii sunt solubili în apă și, deoarece ionul sulfat nu este practic o bază anioică, nu suferă hidroliză anionică.
Metodele industriale moderne de producere a acidului sulfuric se bazează pe producerea de dioxid de sulf (etapa 1), oxidarea acestuia în trioxid (etapa a 2-a) și interacțiunea trioxidului de sulf cu apa (etapa a 3-a).
Dioxidul de sulf este produs prin arderea sulfului sau a diferitelor sulfuri din oxigen:
S + O2 = S02;
4FeS 2 + 11O 2 = 2Fe 2 O 3 + 8SO 2.
Procesul de prăjire a minereurilor sulfurate în metalurgia neferoasă este întotdeauna însoțit de formarea dioxidului de sulf, care este folosit pentru a produce acid sulfuric.
În condiții normale, este imposibil să se oxideze dioxidul de sulf cu oxigen. Oxidarea se realizează prin încălzire în prezența unui catalizator - vanadiu (V) sau oxid de platină. Chiar dacă reacția
2SO 2 + O 2 2SO 3 + Q
reversibil, randamentul ajunge la 99%.
Dacă amestecul de gaz rezultat de trioxid de sulf și aer este trecut prin apă curată, cea mai mare parte a trioxidului de sulf nu este absorbită. Pentru a preveni pierderile, amestecul gazos este trecut prin acid sulfuric sau prin soluțiile sale concentrate. Aceasta produce acid disulfuric:
SO3 + H2SO4 = H2S2O7.
O soluție de acid disulfuric în acid sulfuric se numește oleum și este adesea reprezentată ca o soluție de trioxid de sulf în acid sulfuric.
Prin diluarea oleum-ului cu apă, puteți obține atât acid sulfuric pur, cât și soluțiile acestuia.
1.Creați formule structurale
a) dioxid de sulf, b) trioxid de sulf,
c) acid sulfuric, d) acid disulfuric.
Clorul formează patru acizi care conțin oxigen: hipocloros, clor, hipocloros și percloric.
Acid hipocloros HClO se formează prin interacțiunea clorului cu apa, precum și a sărurilor acestuia cu acizi minerali puternici. Este un acid slab și este foarte instabil. Compoziția produselor reacției sale de descompunere depinde de condiții. Cu iluminare puternică a acidului hipocloros, prezența unui agent reducător în soluție și, de asemenea, o stare de lungă durată, se descompune cu eliberarea de oxigen atomic: HClO = HCl + O
În prezența substanțelor de îndepărtare a apei se formează oxid de clor (I): 2 HClO = 2 H2O + Cl2O
Prin urmare, atunci când clorul interacționează cu o soluție alcalină fierbinte, sărurile nu se formează din acizi clorhidric și hipocloros, ci din acizi clorhidric și hipocloros: 6 NaOH + 3 Cl2 = 5 NaCl + NaClO3 + 3 H2O
Săruri de acid hipocloros- agenţi oxidanţi foarte puternici. Ele se formează atunci când clorul reacţionează cu alcalii la rece. În același timp, se formează săruri ale acidului clorhidric. Dintre aceste amestecuri, cele mai utilizate sunt apa de înălbire și javel.
Acid cloros HClO2 se formează prin acțiunea acidului sulfuric concentrat asupra cloriților de metale alcaline, care se obțin ca produse intermediare în timpul electrolizei soluțiilor de cloruri de metale alcaline în absența unei diafragme între spațiile catodice și anodice. Este un acid slab, instabil, un agent oxidant foarte puternic într-un mediu acid. Când interacționează cu acidul clorhidric, se eliberează clor: HClO2 + 3 HCl = Cl2 + 2 H2O
Acidul hipocloros HClO3 se formează prin acțiunea sărurilor sale - clorații- acid sulfuric. Acesta este un acid foarte instabil, un agent oxidant foarte puternic. Poate exista doar în soluții diluate. Prin evaporarea unei soluții de HClO3 la temperatură scăzută în vid, puteți obține o soluție vâscoasă care conține aproximativ 40% acid percloric. La un conținut mai mare de acid, soluția se descompune exploziv. Descompunerea explozivă are loc și la concentrații mai mici în prezența agenților reducători. În soluții diluate, acidul percloric prezintă proprietăți oxidante, iar reacțiile decurg destul de calm:
HClO3 + 6 HBr = HCl + 3 Br2 + 3 H2O
Sărurile acidului percloric - clorații - se formează în timpul electrolizei soluțiilor de clorură în absența unei diafragme între spațiile catodice și anodice, precum și atunci când clorul este dizolvat într-o soluție alcalină fierbinte, așa cum se arată mai sus. Cloratul de potasiu (sare Berthollet) format în timpul electrolizei este ușor solubil în apă și se separă ușor de alte săruri sub formă de precipitat alb. La fel ca acidul, clorații sunt agenți oxidanți destul de puternici:
KClO3 + 6 HCI = KCl + 3 Cl2 + 3 H2O
Clorații sunt utilizați pentru producerea de explozivi, precum și pentru producerea de oxigen în condiții de laborator și săruri ale acidului percloric - perclorați. Când sarea Berthollet este încălzită în prezența dioxidului de mangan MnO2, care joacă rolul de catalizator, se eliberează oxigen. Dacă încălziți cloratul de potasiu fără catalizator, acesta se descompune pentru a forma săruri de potasiu ale acizilor clorhidric și percloric:
2 KClO3 = 2 KCl + 3 O2
4 KClO3 = KCl + 3 KClO4
Prin tratarea percloraților cu acid sulfuric concentrat, se poate obține acid percloric:
KClO4 + H2SO4 = KHSO4 + HClO4
Acesta este cel mai puternic acid. Este cel mai stabil dintre toți acizii clor care conțin oxigen, dar acidul anhidru se poate descompune exploziv atunci când este încălzit, agitat sau în contact cu agenți reducători. Soluțiile diluate de acid percloric sunt destul de stabile și sigure de utilizat. Clorații de potasiu, rubidiu, cesiu, amoniu și majoritatea bazelor organice sunt slab solubili în apă.
În industrie, percloratul de potasiu se obține prin oxidarea electrolitică a sării Berthollet:
2 H+ + 2 e- = H2 (la catod)
ClO3- - 2 e- + H2O = ClO4- + 2 H+ (la anod)
Rolul biologic.
Ea aparține elementelor vitale de neînlocuit. În corpul uman 100 g.
Ionii de clor joacă un rol biologic foarte important. Intrând împreună cu ionii K+, Mg2+, Ca2+, HCO~, H3PO4 și proteine, ele joacă un rol dominant în crearea unui anumit nivel de presiune osmotică (homeostază osmotică) a plasmei sanguine, limfei, lichidului cefalorahidian etc.
Ionul de clor este implicat în reglarea metabolismului apă-sare și a volumului de lichid reținut de țesuturi, menținând pH-ul lichidului intracelular și potențialul de membrană creat de funcționarea pompei de sodiu-potasiu, ceea ce este explicat (ca și în cazul a participării sale la osmoză) prin capacitatea de a difuza prin membranele celulare, așa cum fac ionii Na+ și K+. Ionul de clor este o componentă necesară (împreună cu ionii H2PO4, HSO4, enzimele etc.) a sucului gastric, care face parte din acidul clorhidric.
Prin promovarea digestiei, acidul clorhidric distruge și o varietate de bacterii patogene.
Formula structurala
Formula adevărată, empirică sau brută: C4H4O
Compoziția chimică a acidului percloric
Greutate moleculară: 100,457
Acid percloric HCIO4- acid monobazic, unul dintre cele mai puternice (în soluție apoasă, pK = ~ -10), anhidru - un agent oxidant excepțional de puternic, deoarece conține clor în cea mai mare stare de oxidare de +7.
Proprietăți
Proprietăți fizice
Un lichid volatil incolor care fumează puternic în aer și este monomeric în vapori. Acidul percloric anhidru este foarte reactiv și instabil. HClO 4 lichid este parțial dimerizat și se caracterizează prin autodeshidratare la echilibru: 3HClO 4 ↔ H 3 O + + ClO 4 - + Cl 2 O 7
Proprietăți chimice
Exploziv. Acidul percloric și sărurile sale (perclorații) sunt utilizați ca agenți oxidanți. Acidul percloric, ca unul dintre cele mai puternice, dizolvă metalele de aur și platină, iar în reacție cu argintul formează acid percloric:
3HClO4 + 2Ag = 2AgClO4 + HClO3 + H2O
Nemetale și metalele active reduc acidul percloric la acid clorhidric
8As + 5HClO 4 + 12H 2 O = 8H 3 AsO 4 + 5HCl (această reacție este folosită în metalurgie pentru purificarea minereului)
Percloratul de iod se obține în laborator prin tratarea unei soluții de iod în acid percloric anhidru cu ozon:
I 2 + 6HClO 4 + O 3 = 2I(ClO 4) 3 + 3H 2 O
Fiind extrem de puternic, instabil, acidul percloric se descompune:
4HClO4 = 4ClO2 + 3O2 + 2H2O
Acidul percloric este foarte solubil în fluor și solvenți organoclorați, cum ar fi CF 3 COOH, CHCl 3, CH 2 Cl 2 etc. Amestecarea cu solvenți care prezintă proprietăți reducătoare poate duce la aprindere și explozie. Acidul percloric se amestecă cu apa în orice raport și formează o serie de hidrați HClO 4 × nH 2 O (unde n = 0,25...4). HClO 4 H 2 O monohidrat are un punct de topire de +50 o C. Soluțiile concentrate de acid percloric, spre deosebire de acidul anhidru, au o consistență uleioasă. Soluțiile apoase de acid percloric sunt stabile și au capacitate de oxidare scăzută. Acidul percloric cu apa formează un amestec azeotrop, care fierbe la 203 °C și care conține 72% acid percloric. Soluțiile de acid percloric în hidrocarburi clorurate sunt supraacizi (superacizi). Acidul percloric este unul dintre cei mai puternici acizi anorganici; în mediul său, chiar și compușii acizi se comportă ca baze, adăugând un proton și formând cationi de perclorat de acil: P(OH) 4 + ClO 4 - , NO 2 + ClO 4 - .
Prin încălzirea blândă a unui amestec de acid percloric și anhidridă fosforică sub presiune redusă, se distilă un lichid uleios incolor, anhidrida clorică:
2HClO 4 + P 4 O 10 → Cl 2 O 7 + H 2 P 4 O 11
acidul percloric se numesc perclorati.
Chitanță
- Soluțiile apoase de acid percloric se obțin prin oxidarea electrochimică a acidului clorhidric sau a clorului dizolvat în acid percloric concentrat, precum și prin descompunerea prin schimb a percloraților de sodiu sau de potasiu cu acizii anorganici puternici.
- Acidul percloric anhidru se formează prin interacțiunea percloraților de sodiu sau de potasiu cu acid sulfuric concentrat, precum și a soluțiilor apoase de acid percloric cu oleum: KClO 4 + H 2 SO 4 → KHSO 4 + HClO 4
Aplicație
- Soluțiile apoase concentrate de acid percloric sunt utilizate pe scară largă în chimia analitică, precum și pentru prepararea percloraților.
- Acidul percloric este utilizat în descompunerea minereurilor complexe, în analiza mineralelor și, de asemenea, ca catalizator.
- Săruri ale acidului percloric: percloratul de potasiu este ușor solubil în apă, utilizat în producția de explozivi, percloratul de magneziu (anhidrona) este un desicant.
Acid percloric H C l O 4 (\displaystyle ((HClO)_(4)))- acid monobazic, unul dintre cele mai puternice (în soluție apoasă, pK = ~ -10), anhidru - un agent oxidant excepțional de puternic, deoarece conține clor în cea mai mare stare de oxidare de +7.
YouTube enciclopedic
1 / 1
✪ SINTEZA ACIDULUI PRANIC
Subtitrări
Proprietăți
Proprietăți fizice
Un lichid volatil incolor care fumează puternic în aer și este monomeric în vapori. Acidul percloric anhidru este foarte reactiv și instabil. HClO4 lichid este parțial dimerizat și se caracterizează prin autodeshidratare la echilibru:
3 H C l O 4 ⇄ H 3 O + + C l O 4 − + C l 2 O 7 (\displaystyle (\mathsf (3HClO_(4))\rightleftarrows H_(3)O^(+)+ClO_(4))^ (-)+Cl_(2)O_(7))))Proprietăți chimice
Exploziv. Acidul percloric și sărurile sale (perclorații) sunt utilizați ca agenți oxidanți. Acidul percloric, ca unul dintre cei mai puternici acizi, dizolvă metalele de aur și platină, iar în reacție cu argintul formează acid percloric:
3 H C l O 4 + 2 A g = 2 A g C l O 4 + H C l O 3 + H 2 O (\displaystyle (\mathsf (3HClO_(4))+2Ag=2AgClO_(4)+HClO_(3)+ H_(2)O)))
8 A s + 5 H C l O 4 + 12 H 2 O = 8 H 3 A s O 4 + 5 H C l (\displaystyle (\mathsf (8As+5HClO_(4)+12H_(2)O=8H_(3))) AsO_(4)+5HCl)))(această reacție este folosită în metalurgie pentru purificarea minereurilor)
Percloratul de iod se obține în laborator prin tratarea unei soluții de iod în acid percloric anhidru cu ozon:
I 2 + 6 H C l O 4 + O 3 = 2 I (C l O 4) 3 + 3 H 2 O (\displaystyle (\mathsf (I_(2))+6HClO_(4)+O_(3)=2I( ClO_(4))_(3)+3H_(2)O)))
Fiind un acid extrem de puternic instabil, acidul percloric se descompune:
4 H C l O 4 = 4 C l O 2 + 3 O 2 + 2 H 2 O (\displaystyle (\mathsf (4HClO_(4)=4ClO_(2)+3O_(2)+2H_(2)O)))
Acidul percloric este foarte solubil în fluor și solvenți organoclorați, cum ar fi CF 3 (\displaystyle ((\mbox(CF))_(3)))C O O H (\displaystyle COOH), CHCl 3 (\displaystyle ((\mbox(CHCl))_(3))), CH 2 Cl 2 (\displaystyle ((\mbox(CH))_(2)(\mbox(Cl))_(2))) etc. Amestecarea cu solvenți care prezintă proprietăți reducătoare poate duce la aprindere și explozie. Acidul percloric se amestecă cu apa în orice raport și formează o serie de hidrați HClO 4 ×nH 2 (\displaystyle ((\mbox(HClO))_(4)(\mbox(×nH))_(2)))O (\displaystyle O)(unde n = 0,25...4). Monohidrat HClO 4 H 2 (\displaystyle ((\mbox(HClO))_(4)(\mbox(H))_(2)))O (\displaystyle O) are un punct de topire de +50 o C. Soluţiile concentrate de acid percloric, spre deosebire de acidul anhidru, au o consistenţă uleioasă. Soluțiile apoase de acid percloric sunt stabile și au capacitate de oxidare scăzută. Acidul percloric cu apa formează un amestec azeotrop, care fierbe la 203 °C și care conține 72% acid percloric. Soluțiile de acid percloric în hidrocarburi clorurate sunt supraacizi (superacizi). Acidul percloric este unul dintre cei mai puternici acizi anorganici; în mediul său, chiar și compușii acizi se comportă ca baze, adăugând un proton și formând cationi de perclorat de acil: P(OH) 4 (\displaystyle ((\mbox(P(OH)))_(4))) + − , NU 2 (\displaystyle ((\mbox(NU))_(2))) + ClO 4 (\displaystyle ((\mbox(ClO))_(4))) − .
Când un amestec de acid percloric și anhidridă fosforică este ușor încălzit sub presiune redusă, un lichid uleios incolor, anhidridă percloric, este distilat:
2 H C l O 4 + P 4 O 10 → C l 2 O 7 + H 2 P 4 O 11 (\displaystyle (\mathsf (2HClO_(4)+P_(4)O_(10))\rightarrow Cl_(2)O_) (7)+H_(2)P_(4)O_(11))))Sărurile acidului percloric se numesc perclorati.
Chitanță
- Soluțiile apoase de acid percloric se obțin prin oxidarea electrochimică a acidului clorhidric sau a clorului dizolvat în acid percloric concentrat, precum și prin descompunerea prin schimb a percloraților de sodiu sau de potasiu cu acizii anorganici puternici.
- Acidul percloric anhidru se formează prin reacția percloraților de sodiu sau de potasiu cu acid sulfuric concentrat, precum și soluții apoase de acid percloric cu oleum:
Aplicație
- Soluțiile apoase concentrate de acid percloric sunt utilizate pe scară largă în chimia analitică, precum și pentru prepararea percloraților.
- Acidul percloric este utilizat în descompunerea minereurilor complexe, în analiza mineralelor și, de asemenea, ca catalizator.
- Săruri ale acidului percloric: percloratul de potasiu este ușor solubil în apă, utilizat în producția de explozivi, percloratul de magneziu (anhidrona) este un desicant.
Acidul percloric anhidru nu poate fi depozitat și transportat o perioadă lungă de timp, deoarece atunci când este depozitat în condiții normale se descompune lent, este colorat de oxizii de clor formați în timpul descompunerii sale și poate exploda spontan. Dar soluțiile sale apoase sunt destul de stabile.