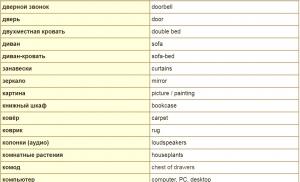
Semne în chimie și semnificația lor. Ce înseamnă „semne chimice”? Derivarea formulelor substanțelor prin produse de ardere
Cuvinte cheie abstracte: elemente chimice, semne elemente chimice.
În chimie, conceptul este foarte important. "element chimic"(Cuvântul „element” în greacă înseamnă „componentă”). Pentru a-i înțelege esența, amintiți-vă cum diferă amestecurile și compușii chimici.
De exemplu, fierul și sulful își păstrează proprietățile în amestec. Prin urmare, se poate argumenta că un amestec de pulbere de fier cu pulbere de sulf este format din două substanțe simple - fier și sulf. Deoarece compusul chimic sulfura de fier este format din substanțe simple - fier și sulf, aș dori să susțin că sulfura de fier este formată și din fier și sulf. Dar, după ce ne-am familiarizat cu proprietățile sulfurei de fier, înțelegem că acest lucru nu poate fi argumentat. Acesta, format ca urmare a interacțiunii chimice, are proprietăți complet diferite față de substanțele originale. Pentru că compoziția substanțe complexe nu substanţe simple, ci atomi de un anumit tip.
UN ELEMENT CHIMIC este un anumit tip de atom.
Deci, de exemplu, toți atomii de oxigen, indiferent dacă fac parte din moleculele de oxigen sau moleculele de apă, sunt elementul chimic oxigen. Toți atomii de hidrogen, fier, sulf sunt, respectiv, elementele chimice hidrogen, fier, sulf etc.
În prezent, sunt cunoscute 118 tipuri diferite de atomi, adică. 118 elemente chimice. Din atomii acestui număr relativ mic de elemente se formează o mare varietate de substanțe. (Conceptul de „element chimic” va fi clarificat și extins în notele viitoare).
Folosind conceptul de „element chimic”, putem clarifica definițiile: SIMPLE sunt substanțe care constau din atomi ai unui element chimic. COMPLEXE sunt substanțe care constau din atomi de diferite elemente chimice.
Este necesar să se facă distincția între concepte „substanță simplă” și "element chimic" , deși numele lor sunt în majoritatea cazurilor aceleași. Prin urmare, de fiecare dată când întâlnim cuvintele „oxigen”, „hidrogen”, „fier”, „sulf” etc., trebuie să înțelegem despre ce vorbim - o substanță simplă sau un element chimic. Dacă, de exemplu, se spune: „Peștii respiră oxigen dizolvat în apă”, „Fierul este un metal care este atras de un magnet”, aceasta înseamnă că vorbim despre substanțe simple - oxigen și fier. Dacă ei spun că oxigenul sau fierul face parte dintr-o substanță, atunci înseamnă oxigen și fier ca elemente chimice.
Elementele chimice și substanțele simple pe care le formează pot fi împărțite în două grupe mari: metale și nemetale. Exemple de metale sunt fierul, aluminiul, cuprul, aurul, argintul etc. Metalele sunt din plastic, au un luciu metalic și conduc bine curentul electric. Exemple de nemetale sunt sulful, fosforul, hidrogenul, oxigenul, azotul etc. Proprietățile nemetalelor sunt variate.
Semne ale elementelor chimice
Fiecare element chimic are propriul nume. Pentru o desemnare simplificată a elementelor chimice, utilizați simbolism chimic. Un element chimic este notat prin inițiala sau inițiala și una dintre literele ulterioare ale numelui latin al acestui element. Deci, hidrogenul (lat. hidrogeniu - hidrogeniu) este notat cu literă H, mercur (lat. hydrargyrum - hydrargyrum) - cu litere hg etc.Chimistul suedez J. J. Berzelius a propus simbolismul chimic modern în 1814
Abrevierile pentru elementele chimice sunt semne(sau personaje) elemente chimice. Simbolul chimic (semnul chimic) denotă un atom al unui element chimic dat .

Dicţionar Ushakov
Chimie
chi mia, chimie, pl. Nu, Femeie (greacă chimie). Știința compoziției, structurii, modificărilor și transformărilor, precum și a formării de noi substanțe simple și complexe. Chimia, spune Engels, poate fi numită știința modificărilor calitative ale corpurilor care apar sub influența modificărilor compoziției cantitative. Chimie organica. Chimie anorganică. Chimie aplicată. Chimie teoretică. curs de chimie.
| ce. proprietățile chimice ale ceva științific). Chimia uleiului.
Dicţionar enciclopedic
Chimie
(poate din greacă. Chemia - Chemia, una dintre cele mai vechi denumiri pentru Egipt), știință care studiază transformarea substanțelor, însoțită de modificarea compoziției și (sau) structurii acestora. Procesele chimice (obținerea metalelor din minereuri, vopsirea țesăturilor, îmbrăcarea pielii etc.) au fost folosite de omenire deja în zorii ei. viata culturala. În secolele 3-4. s-a născut alchimia, a cărei sarcină era să transforme metalele comune în metale nobile. Încă din Renaștere, cercetarea chimică a fost folosită din ce în ce mai mult în scopuri practice (metalurgie, sticlă, ceramică, vopsele); exista şi o direcţie medicală specială de alchimie – iatrochimie. La etajul 2. secolul al 17-lea R. Boyle a dat prima definiție științifică a conceptului "element chimic". Perioada de transformare a chimiei într-o adevărată știință s-a încheiat în a doua jumătate. al XVIII-lea, când a fost formulată legea conservării masei în reacțiile chimice (vezi și M. V. Lomonosov, A. Lavoisier). La început. secolul al 19-lea J. Dalton a pus bazele atomisticii chimice, A. Avogardo a introdus conceptul "moleculă". Aceste concepte atomice și moleculare au fost stabilite abia în anii 1960. secolul al 19-lea În același timp, A. M. Butlerov a creat teoria structurii compușilor chimici, iar D. I. Mendeleev a descoperit legea periodică (vezi Sistemul periodic al elementelor lui Mendeleev). Din con. 19 - cers. Secolului 20 cea mai importantă direcție Chimia a fost studiul legilor proceselor chimice. În chimia modernă, domeniile sale individuale - chimia anorganică, chimia organică, chimia fizică, chimia analitică, chimia polimerilor - au devenit în mare măsură științe independente. La intersecția dintre chimie și alte domenii de cunoaștere, de exemplu, au apărut biochimia, agrochimia și geochimia. Legile chimiei se bazează pe Știința tehnică precum tehnologia chimică, metalurgia.
Dicționarul lui Ozhegov
X Și MIA,și, bine.
1. Știința compoziției, structurii, proprietăților substanțelor și transformărilor lor. anorganic x. x organic. x fizic. (pe baza principiilor generale ale fizicii).
2. ce. Compoziția în sine, proprietățile substanțelor și transformările lor. H. glucide. H. ulei.
3. colectate chimicale. Gospodărie x.
4. Un mod de a influența pe cineva. cu ajutorul chimicalelor (colocviale). Faceți chimie (perm folosind astfel de mijloace). Faceți un curs de chimie (adică un curs de tratament cu astfel de agenți, chimioterapie). Aterizări tratate cu chimie (produse chimice).
| adj. chimic, oh, oh.
Dicţionar al lui Efremova
Chimie
- bine.
- :
- O disciplină științifică care studiază substanțele, compoziția, structura, proprietățile și transformările reciproce ale acestora.
- O materie academică care conține bazele teoretice ale acestei științe.
- se desfășoară Un manual care stabilește conținutul unei anumite discipline academice.
- Aplicarea practică a acestei științe și a legilor ei în producție, industrie etc.
- Compoziția calitativă a smth.
- se desfășoară Preparate, substanțe chimice, soluții etc utilizate în producție și viața de zi cu zi.
- se desfășoară Produse alimentare care nu conțin aproape niciun ingrediente naturale.
- trans. se desfășoară Permanent.
- :
Enciclopedia lui Brockhaus și Efron
Chimie
Sensul original și originea acestui cuvânt sunt necunoscute; este posibil să fie pur și simplu un nume vechi pentru nordul Egiptului, iar atunci știința chimică înseamnă știință egipteană; dar din moment ce Chemi, pe lângă Egipt, a notat și negru, iar μελάνοσις (înnegrirea) era considerată o operație inevitabilă în transformările metalelor, se poate ca τέχνη τής χημείας - Olympiodorus, să fie arta de a prepara această substanță de înnegrire (cf. H. Kopp , „Geschichte der Chemie”, II, 1844, 4 - 6, și M. Berthelot, „Introduction a l” é tude de la chimie des anciens et du moyen вge ", 1889). „Din majoritatea celorlalte științe. X. în dezvoltarea sa se distinge prin faptul că scopul său a fost înțeles diferit în diferite momente... În timp ce în alte domenii de activitate spirituală, indiferent de atitudinea față de ele în alte perioade, scopul a fost întotdeauna clar recunoscut și a fost constant. adică în istoria lui X. acest lucru nu se observă deloc. Această știință schimbă nu numai alegerea mijloacelor și aplicațiilor auxiliare, ci și întreaga sarcină și condițiile de existență a acesteia (cf. Alchimie, Iatrochimiști, Phlogiston)... În prezent, - continuă G. Kopp (" Geschichte der Chemie", I , 1843, 5), sarcina lui X., luată de la sine (an und f ü r sich), este descompunerea compuşilor în părţile lor constitutive şi formarea de părțile constitutive conexiuni din nou [Această definiție datează de la mijlocul secolului al XVII-lea, când Lemery, în „Cours de Chymie”, spune că „La Chymie est un art, qui enseigne a sé parer les différentes substances qui se rencontrent dans un mixte” (Corr. „Geschich.”. II, 8), iar Stahl a adăugat la aceasta „și arta de a reforma amestecuri din părți constitutive” (Corr., l. c.). Conceptul de părți constitutive ale amestecurilor s-a schimbat; contemporanul a fost deja conturat de Boyle, dar a fost în general acceptat numai după Lavoisier (vezi Lavoisier și Phlogiston).]. Sarcina, deci, este de a cunoaște compoziția tuturor corpurilor și cu exactitate cum se formează și cum se pot forma.istoria naturală, al cărei subiect cel mai apropiat este „studiul substanțelor omogene, din a cărui adăugare toate corpurile. ale lumii sunt compuse, transformările lor și fenomenele care însoțesc astfel de transformări.” Potrivit lui Ostwald (W. Ostwald, „Grundlinien der anorg. Ch.”, 1900, 1), „aceste transformări pot fi împărțite în două mari, nu tocmai grupuri strict izolate. Uneori transformările privesc doar una, sau câteva relații și proprietăți ale corpului studiat; uneori sunt de așa natură încât corpul studiat dispare ca atare, iar în locul lui apar corpuri noi cu proprietăți noi. Fenomenele de primul fel sunt incluse în domeniul fizicii, al doilea - în domeniul lui X. ", iar, de exemplu, Ostwald ia în considerare raportul dintre sulf și șocurile mecanice (poziția relativă a corpului se modifică, dar nu nu se schimbă: culoarea, greutatea etc., așa-numitele proprietăți fizice ale acesteia), la încălzire slabă (se modifică - temperatura, greutatea și volumul specific, presiunea vaporilor, alte (?) proprietăți rămân neschimbate), la electrificare și constată că fenomenele de acest fel ar trebui considerate fizice. Dar „dacă aduci (l. s., 2) o bucată de sulf în contact cu focul, ia foc și arde cu o flacără albastră. În același timp, se simte binecunoscutul miros de sulf ars, iar după ce arderea a durat de ceva vreme, sulful, ca atare, dispare: s-a ars. În acest proces, nu numai proprietățile individuale ale sulfului se schimbă, dar... în loc de acesta, s-a format altceva; putem judeca acest lucru după mirosul care a apărut concomitent cu debutul fenomenului, dar nu a fost remarcat înainte. În acest caz, sulful a participat la procesul chimic ... Știința lui X are sarcina de a stabili legile tuturor acestor transformări. „În alte manuale, transformările fizice sunt definite ca acelea în care proprietățile materiei rămân neschimbate, restabilind starea sa inițială; în plus, în timpul procesului, este imposibil să divizăm o anumită parte omogenă a unui sistem de transformare în părți eterogene prin orice mijloace mecanice, cel puțin dacă pornim de la un corp omogen fizic; , încălzirea gheții, topirea acesteia, transformarea apei lichide formate în timpul fierberii în abur sunt procese fizice, deoarece la restabilirea temperaturii (și presiunii) inițiale, gheața se dovedește a fi în aceeași cantitate cu toate cele fizice. proprietățile inerente acestuia în condiții date. proprietăți; și deși la punctul de topire al gheții putem avea substanța apei simultan în trei stări - solid (gheață), lichid (apă) și gazos (abur) și le putem separa mecanic (gheața poate fi, de exemplu, filtrată din apă lichidă), dar nici gheața, apa și aburul nu pot fi împărțite în continuare în substanțe eterogene din punct de vedere fizic prin orice mijloace mecanice cunoscute de noi. Dacă, totuși, gheața este evaporată și vaporii rezultați sunt încălziți la o temperatură de 1500 ° - 2000 °, atunci printr-un proces mecanic (folosind difuzie, vezi Disocierea) este posibil să izolați din masa vaporilor supraîncălziți un gaz care diferă de ele prin proprietăți (un amestec de hidrogen și oxigen). Prin răcire, apa singură se va transforma în gheață, iar corpul gazos, colectat separat și răcit rapid, își va păstra natura gazoasă; va fi deci un exemplu de transformare chimică a gheţii. În ciuda faptului că este ușor să găsești mai multe astfel de exemple în manuale și în ciuda faptului că împărțirea transformărilor materiei în cele fizice și chimice a fost consacrată de timp, este, fără îndoială, brusc unilateral și, prin urmare, incorectă. Ostwald greșește, fie și numai pentru că în exemplul său compară transformări complet incomparabile. Modificările în proprietățile sulfului care apar în el atunci când „energia de poziție” sa este schimbată pot fi lăsate deoparte; teoretic sunt necesare, dar în orice caz sunt atât de neînsemnate încât sunt evazive nu numai cu ajutorul simțurilor noastre, ci și cu ajutorul simțurilor rafinate de cele mai sensibile instrumente moderne. Când încălzim slab sulful, avem de-a face cu următoarele fenomene. Sistemul studiat, pe care Ostwald îl numește sulf, ar trebui considerat compus din doi termeni independenți (vezi Regula fazei): din sulf și oxigen atmosferic [Azotul și toți ceilalți constituenți gazoși ai acestuia iau o parte prea neglijabilă în transformare, cu excepția poate umiditatea - vezi Fenomene de contact - și de aceea prezența lor poate fi ignorată]; este în astfel de condiții de temperatură (suprarăcită), când, din cauza rezistențelor pasive, interacțiunea dintre aceste corpuri este aproape imposibilă sau, dacă se întâmplă, atunci la o viteză atât de nesemnificativă, aproape de zero, încât să fim complet incapabili să o facem. prinde-l. Putem, așadar, să considerăm întregul sistem în agregat ca fiind într-o stare de fals echilibru (fals echilibru) a lui Duhem, altfel instabil (cf. A. Gorbov, „Legea fazelor”, în „Anuarul fizico-matematic” , II), capabil să modifice cu o mică schimbare condițiile de echilibru până la transformarea completă; sulful, considerat separat, adică - neglijând reacția sa infinit lentă cu oxigenul, putem considera un sistem monovariant de un termen (sulf solid + abur în prezența a doi factori externi de echilibru: temperatura și presiunea), și se știe că legile la care este supus un astfel de sistem (vezi Regula fazei, l.c.) nu sunt diferite de legile la care este supus orice sistem monovariant cu orice număr de termeni independenți, sistemul de combinare a CaO + CO 2 (sau disocierea CaCO 3), de exemplu.; în sens mecanic, sulful solid cu vaporii săi formează un sistem indiferent de stabil. Dar haideți să încălzim sulful + oxigen până la 500° aproximativ; imediat, interacțiunea lor începe de-a lungul suprafeței de contact, însoțită de apariția luminii și a căldurii (sistemul a fost suprarăcit): sulful, așa cum se spune de obicei, arde, dar oxigenul arde în mod egal, întâlnindu-se cu vaporii de sulf; pentru ambii termeni, măsura stabilității la contactul reciproc a fost depășită prin încălzire, iar sistemul a devenit instabil și este evident că este ilegal să adunăm starea indiferent de stabilă a sulfului cu starea instabilă a propriei + oxigen; iar în timp ce sulful a rămas într-o stare indiferent de stabilă, atunci, repetăm încă o dată, modificările fizice ale proprietăților sale au respectat aceeași lege ca și transformarea „chimică” în sistemul CaO + CO 2 . Cu o foarte ușoară modificare, ceea ce s-a spus este aplicabil și sistemului de încălzire: gheață, apă lichidă și vapori ai acesteia. Atâta timp cât gheața și apa lichidă sunt încălzite singure, până atunci, pentru un anumit volum al sistemului, este posibil (la o întreagă gamă de temperaturi și presiuni) să coexiste între două faze: gheață + abur, gheață + apă lichidă, apă lichidă + abur; toate aceste sisteme sunt monovariante și, ca atare, nu diferă în niciun fel de creta de disociere, de triclorura de iod formată (de disociere) (vezi Regula fazei, l.c.), adică de sistemele pentru care se presupune de obicei că apar în transformări. dintre ele nu sunt de natură fizică, ci chimică. Dar am supraîncălzit vaporii de apă, cu ajutorul unei tehnici speciale (difuzia) [În acest fel, se introduce un nou factor în condițiile de echilibru ale sistemului și anume tensiunea capilară, și este foarte posibil ca aceasta să schimbe natura. a echilibrului (cf. următoarea notă).] am reușit să separăm o parte dintr-un astfel de sistem, iar noi presupunem că masa de abur rămasă, neseparată, diferă în proprietăți fizice față de partea separată, că diferă de aburul obișnuit doar într-un conținut diferit de energie mai mare; dar, evident, aceasta este doar o presupunere, deși poate cea mai simplă și mai probabilă; în ceea ce privește „amestecul exploziv” suprarăcit, acesta nu poate fi comparat cu apa, deoarece o astfel de comparație ar fi la fel de nefericită ca și apa suprarăcită cu gheața de aceeași temperatură; un sistem (apa suprarăcită) este instabil, cu rezistențe pasive (după Gibbs), celălalt este indiferent de stabil, cel puțin în prezența a doi factori externi de echilibru: temperatura și presiunea [Vom aranja o baterie cu gaz Grove din hidrogen, oxigen. și apă, adică vom introduce mai mulți factori de echilibru suplimentari în el și va deveni echilibru, iar transformările sale vor fi reversibile chiar și la temperatura obișnuită.]. Rezumând cele de mai sus, ajungem la concluzia că definițiile obișnuite ale lui X. sunt oarecum înguste, iar cea mai generală este: X. este o știință exactă a istoriei naturale care studiază legile schimbărilor în starea materiei [Acest lucru nu nu prejudecă problema unității sau complexității acestei probleme.] ; îi clasifică în jurul compușilor „chimici”, iar aceștia din urmă – în jurul unor varietăți speciale, stabile de materie, numite „elemente” (pentru sensul expresiilor „compus chimic” și „element” – vezi mai jos legea constanței compoziției) . Este posibil, în acest studiu, să numim modificări reversibile ale stării materiei fizice și să le distingem de acele transformări „chimice” care, în condițiile noastre, sunt ireversibile și au loc unilateral, dar trebuie să ne amintim că până de curând și între aceste transformări, o parte este recunoscută ca fizică, cum ar fi, de exemplu, trecerea lichidelor suprarăcite la starea solidă, cristalizarea soluțiilor suprasaturate [Dacă astfel de soluții sunt considerate nu din punctul de vedere al concentrației de termeni independenți. , dar din punctul de vedere al influenței temperaturii asupra lor, ca factor de echilibru extern, atunci ar trebui recunoscute și ca sisteme suprarăcite.], deși nu sunt nimic, nu diferă de fenomenele „chimice”, care sunt: explozie de peroxid de hidrogen lichid, ozon lichid, un amestec exploziv (hidrogen cu oxigen, clor cu hidrogen [Observațiile au arătat că amestecul de oxigen cu hidrogen este afectat și de lumină, care accelerează transformarea.]), etc. e. Din din punctul de vedere de mai sus, este clar că informaţia raportată de obicei în chimie este unilaterală şi schiță și că ar trebui să li se atașeze numeroase date, de obicei incluse în cursurile de fizică, cursurile de cristalografie etc. etc., și care sunt doar cele mai multe timpuri recente incluse în așa-numitele manuale. Chimie Fizica. Evoluția planificată a început relativ recent și este imposibil de prevăzut volumul lui X. chiar și în viitorul apropiat, dar într-o anumită măsură Mach are dreptate când spune că „în ultima vreme au fost descoperite multe relații între fizică și X. Vechea idee conform căreia X. poate fi considerat fizică aplicată, în special mecanică aplicată, a primit o nouă încurajare în acest sens... În absența unei opinii cu prejudecăți, pare mai probabil ca X. al viitorului să îmbrățișeze fizica și nu invers „(Prinzipien der Wärmelehre”, 1900, 5, 354); Fără îndoială, ambele științe vor câștiga în omogenitate dacă toate acele departamente în care sunt studiate modificările stării materiei, în funcție de modificările aprovizionării sale cu energie, sunt transferate din fizică în X.
Legi și ipoteze X. Legile de bază ale lui X. pot fi împărțite în general calitativ și general cantitativ. legi de calitate.
I. Între ele ar trebui să fie plasate în prim-plan legea fazelor Gibbs; a fost deja afirmat mai devreme (vezi Regula fazelor, l.c.) și aici ne putem limita la a indica că expresia sa cea mai generală este:
v = n + e - r,
Unde v- numărul de variaţii independente ale factorilor externi şi interni ai echilibrului sistemului sau numărul gradelor sale de libertate; n- numărul termenilor săi independenți (factori de echilibru intern), sau numărul acelor corpuri a căror concentrație poate fi modificată independent; e- numărul factorilor externi de echilibru (aceștia sunt: temperatura, presiunea, tensiunea capilară, forța electroexcitatorie, diverse solicitări gravitaționale etc.); r- numărul de faze, adică stări fizic diferite ale materiei, separate (r - 1) după numărul de interfețe. Această expresie decurge din articolele lui Gibbs însuși, dar a fost scrisă mai întâi de Wald („Zeitschrift f. Ph. Ch.” 18, 1895, 346) și, prin urmare, în cuvinte (cf. A. Gorbov, „Legea fazelor” , „Fizician. Mat . Anual”, II) că fiecare corp nou care intră în sistem, și fiecare nou factor extern al echilibrului său, măresc cu unul gradul de libertate al sistemului (numărul de faze posibile, posibile variații independente de temperatură). , presiunea etc.), iar fiecare nouă fază sau interfață nou formată scade acest grad de libertate cu 1. Legea fazelor este un fir de ghidare neprețuit în studiul transformărilor materiei.
II. A doua lege calitativă generală care determină direcția transformării este Legea lui Gibbs-Le Chatelier , afirmând că „orice modificare a oricărui factor de echilibru atrage după sine o transformare în sistem, care tinde să provoace în acest factor o schimbare de semn opusă celei care îi este comunicată”. Această lege este menționată și mai devreme (vezi Reversibilitatea reacțiilor chimice).
Legi cantitative, de greutate.
eu. Legea conservării masei materiei exprimat de Lavoisier într-o formă a priori: „Putem recunoaște ca o axiomă”, spune el, „că cu toate transformările, atât artificiale, cât și naturale, nimic nu este creat din nou: aceeași cantitate de materie există înaintea experienței și după aceasta [Debus („U é ber einige Fundamentalsatze der Chemie etc.”, 1894, 6) consideră că Democrit de Abdera este întemeietorul unei astfel de convingeri, care a învățat că nimic nu poate ieși decât din nimic și nimic din ceea ce există se poate transforma în nimic. ; citat de Aristotel în Fizica sa (I, 4)]. Pe acest principiu se bazează posibilitatea tuturor experimentelor chimice și suntem obligați de el să ne așteptăm întotdeauna la o identitate reală, sau egalitate, între esențe ale corpurilor studiate și cele care pot fi extrase din ele prin analiză” (Lavoisier, „Oeuvres etc." I , 101); nu există totuși nicio îndoială că această poziție a fost rezultatul numeroaselor observații experimentale ale lui Lavoisier (vezi Phlogiston, Formule și Nomenclatură chimică). Deoarece pentru un punct dat globul masele oricăror corpuri sunt strict proporționale cu greutățile lor, atunci putem spune că, conform legii lui Lavoisier: în orice transformare, greutatea corpurilor care se transformă este strict egală cu greutatea celor formate și este ușor de observat. că această lege „chimică” este un caz special al unei alte, mai generale, la care se află toate mișcările materiei și constând în faptul că de fiecare dată când masa unui corp dat se modifică (crește sau scade), atunci masa unuia sau mai multor corpuri înconjurătoare suferă o modificare simultană, egală ca mărime, dar de semn opus (screște sau crește)[Gaultier și Charpy „Le ç ons de Chimie”, 1900, 14] [Legea conservării masei materiei este destul de paralelă cu legea conservării energiei în fizică (cf. B. Stevarta. P. G. Tait, „Universul nevăzut”. ", 1890).]. Când Stas a sintetizat iodură și bromură de argint din cantități cântărite de argint, iod și brom, greutatea compușilor halogen s-a dovedit a fi, totuși, ceva mai mică decât argint și iod, argint și brom, cântăriți separat; în plus, L. Meyer („Moderne Theorien d. Ch.”, 1884, 135) a indicat posibilitatea ca particulele materiei noastre ponderabile să fie conectate cu o cantitate mai mare sau mai mică de eter de lumină nu tocmai lipsit de greutate, a cărui cantitate, poate, modificări cu transformări chimice; având în vedere aceasta, mai întâi Landolt, iar după el Heidweiler, au supus legea lui Lavoisier unui test experimental amănunțit; ambii au studiat modificările de greutate ale diferitelor sisteme închise în vase de sticlă sigilate. Landolt a constatat că greutatea sistemului: o soluție apoasă de sulfat de argint + o soluție de sulfat feros acidificat cu acid sulfuric scade în timpul reacției:
Ag 2 SO 4 + 2FeSO 4 + H 2 SO 4 = 2Ag + Fe 2 (SO 4) 3 + H 2 O
la 0,130 mg - 0,167 mg; această scădere depășește eroarea de cântărire de 6 - 12 ori, dar este disproporționată față de masele de reacție, întrucât a fost de = 0,130 mg la 171,3 g și 0,167 mg la 114,2 g din sistemul de reacție; în reacția acidului iod. cu iodură de hidrogen în prezență de acid sulfuric:
HJO3 + 5H2SO4 + 5KJ \u003d 3J 2 + 5KHSO 4 + 3H 2 O
s-a observat și o scădere a greutății, dar diferența (0,011 mg - 0,047 mg) a stat în eroarea experimentală; în timpul reacției iodului cu o soluție apoasă de sare de sulfură de sodiu (interacțiunea poate merge în două direcții:
J 2 + 2Na 2 SO 3 \u003d 2NaJ + Na 2 S 2 O 6
J 2 + Na 2 SO 3 + Η 2 Ο \u003d 2HJ + Na 2 SO 4,
hidrat de cloral cu potasiu caustic
[CCl 3 .CH (OH) 2 + KOH \u003d CCl 3 H + SNKO 2 + H 2 O]
iar când hidratul de cloral a fost dizolvat în apă, nu a fost observată nicio modificare a greutății care să nu se încadreze în eroarea experimentală. Heidweiler a studiat următoarele transformări: deplasarea cuprului de către fier în soluții acide, bazice (?) și neutre de sulfat de cupru, dizolvarea sulfatului de cupru în apă, dizolvarea celui acidulat în apă și a celui mijlociu în acid sulfuric, precipitarea hidratului de oxid de cupru cu potasiu caustic dintr-o soluție de vitriol de cupru, interacțiunea amoniacului cu acidul acetic și precipitarea clorurii de bariu cu acid sulfuric. Cu un număr total de corpuri de reacție de aproximativ 200 g (160 - 280) și cu o eroare de cântărire care nu depășește 0,04 mg, în două cazuri a observat o creștere în greutate de 0,014 și 0,019, iar în restul de 21 scăderi în greutate; în 13 experimente a fost mai mare decât eroarea posibilă și a ajuns odată la 0,217 mg; fără îndoială, s-a stabilit o scădere la precipitarea cuprului într-o soluție acidă și alcalină (dar nu într-una neutră), la dizolvarea sulfatului de cupru acidificat în apă și la precipitarea hidratului de oxid de cupru [În 2 experimente, totuși, o scădere a fost prea nesemnificativă și anume 0,037 și 0,032 mg]. Heidweiler nu a putut să-și dea seama de motivul modificării greutății și, în plus, pierderea în greutate nu a fost proporțională cu masa corpurilor care reacţionează. Astfel, rezultă că, în timpul anumitor transformări, masa materiei transformate pare să scadă, iar această scădere se află în afara limitelor erorilor de cântărire; nu se poate explica (Landolt) prin tensiuni diferite gravitatieîn raport cu mase egale ale unor corpuri diferite, deoarece experimentele lui Bessel cu pendulele din diferite metale și minerale și Eötvös (E ötvö s) cu greutăți de torsiune au arătat că o astfel de diferență nu poate fi surprinsă; pe de altă parte, retragerile par a fi disproporţionate cu masele care reacţionează, iar acest lucru face probabilă o eroare întâmplătoare; atâta timp cât se poate, se pare, continua să calculeze legea lui Lavoisier, în limitele exactității metode moderne observație, perfect exactă. În orice caz, erori ca cele de mai sus nu pot fi luate în considerare în experimentele obișnuite [Pentru ca un sistem de sulfat de cupru bazic cu fier să piardă 1 pud în greutate după reacție, este necesar, judecând după datele lui Heidweiler, să se ia în considerare cel mai favorabil caz un pic mai mult de 1.000.000 puds. . amestecuri. Cel mai recent, Heidweiler a raportat (Physikalische Zeitschiift, 1902) că greutatea radiului dintr-un tub etanș scade cu 0,02 mg pe zi și este remarcabil că scăderea energiei potențiale datorită acestui fapt. (= K×[(M Δt)/r 2 ]×r, Unde K rapid., M masa pământului, r- raza sa, Δt modificarea masei unui corp atras de Pământ) = 0,02,600000000 mg cm = cca. 12,10 ergi, adică doar energia emisă, conform lui Becquerel, de radiu pe zi. Raportul lui Heidweiler este preliminar.].
II. Legea constanței compoziției compușilor chimici care poate fi formulat astfel: masele de corpuri care, prin combinarea lor, formează un nou corp care are o sumă dată de fizice şi proprietăți chimice, sunt în relație constantă atât între ele, cât și cu masa corpului format, este de obicei considerată cea mai caracteristică a chimiei; este definită uneori chiar ca o știință care studiază compoziția și transformările doar ale corpurilor omogene, adică acelea care se caracterizează printr-o compoziție constantă, care reprezintă indivizi chimici reali și cărora li se dă, în contrast, denumirea anumitor compuși chimici. la amestecuri mecanice și compuși chimici nedefiniti (?) (vezi Tikhvinsky, „Metoda și sistemul chimiei moderne”, Sankt Petersburg, 1900, 3 și 6). Pe de altă parte, se poate găsi un comentariu despre această lege (Gautier et Charpy, l.c., p. 14) că „nu reprezintă altceva decât o tautologie. Într-adevăr, nu există altă definiție a unei „anumite” conexiuni, în afară de cea care se deduce din această așa-numită lege Proprietățile fizice nu sunt suficiente pentru a caracteriza un compus, așa că observăm proprietăți destul de definite pentru un amestec de apă și alcool, luat într-un anumit raport (în greutate), deși nimeni nu a avut vreodată așadar, acolo nu este o lege reală aici, ci o afirmație a unui fapt, totuși, unul foarte remarcabil, și anume, multe elemente pot forma corpuri complexe numai prin combinarea în anumite proporții, care rămân neschimbate, indiferent de modalitatea de obținere a unui corp complex; a elementelor este în exces, atunci va rămâne ca atare după actul de unire. Wald spune și mai ascuțit (Zeitsch. f. ph. Ch., 1897, 22, 256): „Legea constanței compoziției trebuie privită ca o lege empirică. Dar nici aceasta nu este în întregime corectă. dacă o substanță, care a fost considerat un compus chimic - și acest lucru nu este atât de rar - se dovedește a-și schimba compoziția cu condițiile în schimbare? Se va îndoi de corectitudinea legii? Evident că nu; el va elimina doar substanța de pe lista compușilor chimici... Ideea este că nu există alte semne care să recunoască o substanță ca un compus chimic... Deci, s-a învățat din experiență că unele corpuri complexe au o compoziție constantă. Recunoașterea faptului că toate aceste substanțe, și numai ele, ar trebui să fie considerate compuși chimici, este arbitrară.De aceea, compușii chimici au o compoziție constantă în virtutea definiției și, prin definiție, acele corpuri care nu îndeplinesc această condiție nu sunt recunoscuți ca compuși chimici. Având în vedere cele de mai sus, pare interesant să aflăm în ce relație este legea constanței compoziției cu legea lui Lavoisier, istoria apariției acesteia și ce ar trebui să considerăm în prezent un amestec mecanic, compuși chimici nedeterminați și definiți. Legea lui Lavoisier cere ca masa corpurilor care reacţionează să fie egală cu masa noului corp format din ele, dar nu prejudecă deloc numărul corpurilor care reacţionează; orice număr dintre ele, atâta timp cât sunt mai mari decât zero, îl satisface; Legea lui Lavoisier nu prejudecă întrebarea dacă corpurile nu pot reacționa în nenumărate moduri; legea constanței compoziției spune că o reacție este posibilă numai la un anumit raport specific al maselor de reacție, dar nici nu oferă indicații cu privire la numărul de compuși posibili. Este remarcabil că chimiștii au fost mult timp convinși instinctiv de constanța compoziției corpurilor pe care le studiază; este suficient să subliniem că compoziția sărurilor a fost determinată de: Bergman (între 1775-1784); Wenzel (1777), Kirwan și Richter (1790-1800); că Lavoisier, după ce a determinat compoziția dioxidului de carbon și a apei, a început să studieze compoziția compușilor organici pe care i-a ars pentru aceasta, a colectat apa și dioxidul de carbon rezultat și, din cantitatea lor, a calculat conținutul de carbon și hidrogen din arderea. substanță etc.; iar acest lucru, evident, ar fi imposibil dacă ar permite ca compoziția apei și a dioxidului de carbon să se poată schimba. Astfel, credința în constanța compoziției corpurilor complexe a existat de mult timp, sau mai bine zis, nimeni nu bănuia posibilitatea de altceva, dar „legea” a rămas nespusă. Adversarul său decisiv a fost Berthollet („Recherches sur les lois de l” afnnt é”, 1801 și 1802 și „Essai de statique chimique”, 1803). Era convins că corpurile pot fi uneori legate în tot felul de moduri, alteori cunoscute. limite; el a văzut motivul acestei limitări în faptul că forța cu care părțile constitutive sunt ținute într-un corp complex trebuie să scadă odată cu creșterea masei unuia dintre corpurile care reacţionează (pe măsură ce se apropie de o stare de saturație și o scăderea relativă a masei celuilalt) și, în al doilea rând, a influenței temperaturii asupra coeziunii și asupra elasticității naturale a corpurilor care reacţionează. Datorită înaltei autorităţi a lui Berthollet, datorită inteligenței cu care au fost exprimate aceste opinii, au câștigat multe susținători, mai ales că datele analitice disponibile atunci erau în multe privințe o confirmare directă a corectitudinii unor astfel de opinii.Proust (Proust, vezi articolul corespunzător) a fost un oponent al ideilor lui Berthollet [Proust este creditat în acest articol cu ideea de originea elementelor chimice din aproximativ materia primară de fund, și anume hidrogenul, dar această idee a fost exprimată de medicul englez Prout (Prout) (vezi) și Greutatea atomilor (vezi).]; într-o serie de lucrări (1801-1808) a arătat că formarea de oxizi, compuși ai sulfului și săruri, în general, este asociată cu relații certe și invariabile între masele elementelor găsite în ei, dar ceea ce este vizibil numai dacă distinge amestecuri mecanice și alte amestecuri eterogene din punct de vedere fizic și chimic de compuși chimici. Legea constanței compoziției acestora din urmă, și anume oxizi, a fost exprimată de Proulx în 1801 în următoarele cuvinte (Corr, „Geschichte d. Ch.”, II, 368): „Proporții mereu neschimbate, aceste atribute constante, caracterizează compuși reali, atât artificiali, cât și naturali, într-un cuvânt, acest pondus naturae, pe care Stahl îl vede atât de clar; toate acestea, zic eu, nu sunt mai mult în puterea chimistului decât legea electorală la care sunt supuși toți compușii. Compușii „determinați” se pot amesteca, potrivit lui Proulx, între ei în cei nedeterminați. relații, dar produsul unei astfel de amestecări nu este un compus chimic, ci o soluție. Berthollet considera (în „Statique chimique”) că punctele de vedere ale lui Proulx aveau prea puține temei și între ele a izbucnit o dispută, care s-a încheiat în 1808, când majoritatea contemporanilor săi s-au aplecat de partea lui Proulx, după care un studiu intensiv al anumitor compuși chimici a început. În prezent, este cert că problema ar trebui revizuită. Pentru a ne da o idee despre punctul de vedere modern, să ne oprim asupra celui mai simplu caz de interacțiune a oricăror două corpuri care nu formează între ele ceea ce se numește o combinație definită, dar sunt capabile, în anumite condiții, de formare a sistemelor lichide si omogene in toate directiile. După cum se știe (cf. Regula fazei, Aliaje, Evaporare Fracționată), adăugarea unui corp LA la corp DAR DAR,și adăugarea corpului DAR la corp LA determină scăderea temperaturii. topirea corpului LA, si de aceea, la aplicarea tot felul de amestecuri formate din aceste doua corpuri, pe o diagrama de temperaturi si concentratii, obtinem doua curbe care se intersecteaza in punctul eutectic, emanate din temperatura de topire. DARși LA(vezi poza):
Un studiu detaliat al diagramei arată următoarele. Peste curbe CEși ED avem zona sistemelor lichide, numită de obicei soluție LAîn DAR (DAR se topește mult mai jos B) dar care, evident, sunt și soluții DARîn ÎN. Deasupra liniei punctate orizontale pornind de la punct D, ambele corpuri se amestecă ca lichide în toate felurile (de la 100% DAR pana la 100% LA);între această linie și linia punctată orizontală care începe în punct CU, corp DAR, lichid în aceste condiții, poate fi adăugat la soluție într-o cantitate nedeterminată fără a încălca omogenitatea acesteia și adăugarea unui corp. LA limitat de curba sa de solubilitate DE; soluția datorită acestui fapt este, parcă, unilaterală. Sub linia punctată orizontală care începe în punctul respectiv CU, ambii solide dar au o capacitate limitată de a se topi reciproc; solutia este simetrica. Sub linia punctată ab ambele corpuri pot fi luate în orice relație, dar nu au nicio influență unul asupra celuilalt; sunt absolut indiferenți chiar și cu o scădere suplimentară a temperaturii și nu suntem capabili să-i aducem în interacțiune în aceste condiții (se presupune că factorii externi de echilibru ai sistemului sunt temperatura și presiunea vaporilor A + B).Într-un triunghi CaE precipită în stare solidă în exces de solid A,în contact şi echilibru cu corpul saturat cu acesta A, soluţie; într-un triunghi DbE precipită în stare solidă b, tot în contact şi în echilibru cu o soluţie saturată cu aceasta. Ce se află în dreptunghi AaBb sunăm de obicei amestec mecanic, deși de fapt nu există amestecarea corpurilor luate aici [Prin negarea amestecării corpurilor, înțelegem relația lor indiferentă între ele și izolarea lor spațială completă. Nu există nicio îndoială că un conglomerat metalic eutectic (vezi Aliaje) dă impresia unui corp omogen cu ochiul liber la microscop.]; sunt la fel de amestecate ca și cum ar fi în dispozitive separate; prin urmare, este mai corect să numim un astfel de amestec „mecanic” împreună cu B. Rooseboom (vezi Stereoizomerie) un conglomerat; părțile constitutive ale unui conglomerat pot fi separate unele de altele prin diverse metode și, printre altele, cu ajutorul lichidelor grele (metoda lui Church și Thule în mineralogie). Compoziția unui astfel de conglomerat poate varia de la aproape 100% DAR pana la 100% b, dar este evident că pentru orice amestec dat acesta va rămâne constant, sub o serie întreagă de schimbări de temperatură; și dacă îl considerăm un compus definit sau nu va depinde de ușurința mai mare sau mai mică cu care putem demonstra neomogenitatea sa fizică în diferite puncte ale sistemului și de disponibilitatea mai mare sau mai mică a punctului eutectic pentru noi. E, peste care eterogenitatea conglomeratului va avea un efect mai clar (în stare solidă vor fi corpul DAR sau corp LA), cu excepția cazului în care concentrația sa corespunde accidental punctului eutectic, când și mai sus substanța sa va fi tratată ca fiind complet omogenă, pentru care temperatura eutectică va fi punctul de topire [Că un astfel de conglomerat se topește la temperatura eutectică într-un lichid omogen este dovedit de experimentele lui Gallock (1888), care a descoperit că un conglomerat de rumeguș de cadmiu (1 oră), staniu (1 oră), plumb (2 ore) și bismut (4 ore), corespunzând ca compoziție aliajului Wood, se topește într-un baie de apă (cu o încălzire suficient de lungă), adică sub 100°, în timp ce metalele individuale se topesc: Cd la 320°, Sn la 32°, Pb la 320° și Bi la 269,2°; a constatat, de asemenea, că era suficient să presați potasiu (pl. la 62,5 °) și sodiu (pl. la 97,6 °) unul pe altul cu suprafețe proaspete pentru a le face lichide la obișnuit. ritm. și un aliaj asemănător mercurului (soluție).]. Apoi corpuri DARși LA, precipitate sub formă solidă din soluție vor avea, de asemenea, o compoziție nemodificată, deoarece se presupune că se pot topi fără descompunere (modificări de compoziție) și, în plus, se presupune că avem un astfel de caz de interacțiune a lor atunci când se modifică doar concentrația lor. când intră în soluție pe unitatea de volum, dar nu compoziția [De fapt, un astfel de caz ideal nu are loc de fapt: și cristalele corpului DAR,și cristalele corpului LA cad, umezit cu o soluție saturată, a cărei compoziție se modifică în funcție de temperatură și poate chiar să difere din cauza capilarității, ca compoziție de restul masei lichide. O astfel de soluție este însă relativ ușor de înlăturat, iar acesta este motivul reprezentării prezentate în text. Că cristalele de gheață care cad din „slab” solutii apoase, nu reprezintă soluții solide, este clar din datele lui Regnault privind presiunea de vapori a unor astfel de soluții și din unele dintre observațiile lui Rüdorf asupra soluțiilor apoase slabe de săruri pleocroice.]. În cele din urmă, soluția va avea o concentrație variabilă atâta timp cât compoziția sa corespunde zonei situate deasupra liniilor CEși ed,și atâta timp cât unul dintre factorii externi de echilibru, temperatura (la presiune constantă) sau presiunea (la temperatură constantă), sistemul se va schimba; dar cât de curând avem o soluție corespunzătoare uneia dintre curbele limită GE. sau ed, adică unul dintre cele două sisteme monovariante posibile, iar valoarea temperaturii sau presiunii sistemului este dată în avans sau imediat pentru soluțiile de mai sus CEși EDși reprezentând sisteme divariante, valorile temperaturii și presiunii sunt fixe, astfel încât compozițiile unor astfel de soluții se dovedesc a fi complet fixe, definite și se știe de mult timp că compoziția soluțiilor saturate este determinată de temperatură și natura și starea corpului solid în contact cu acestea, și că pentru a avea o soluție nesaturată a unor corpuri având la o anumită temperatură o anumită presiune a vaporilor, o greutate specifică dorită și posibilă, un coeficient de refracție dorit, etc., că pentru toate acestea corpurile care reacţionează trebuie luate într-un „raport constant de greutate” strict definit. Astfel, ajungem la concluzia că toate sistemele invariante (nevariante) au o anumită compoziție [Raționamentul aplicat în text unui sistem cu două corpuri poate fi ușor extins la un sistem de orice complexitate. Conglomeratul situat sub temperatura eutectică nu va consta întotdeauna din corpuri pure. DARși LA; Ultimul caz apare când DARși LA da legături. Dar nu este greu de înțeles astfel de cazuri, ghidându-te după cele de mai sus și cunoscând diagrama corespunzătoare; vezi, de exemplu, diagrama de solubilitate Fe 2 Cl 4 dată de V. Rooseboom în art. Evaporare fracționată.]; constanța sa nu reprezintă, așadar, privilegiul unor compuși „anumiți, chimici” și, prin urmare, este urgent necesar să se găsească pentru „anumiți, compuși chimici”, a căror descriere până acum constituie aproape întregul conținut de X., unele alt semn decât constanța compoziției, care ar permite să le caracterizeze. Acest semn a fost dat de Wald, care a definit un compus chimic permanent, ca o fază de compoziție neschimbată într-un sistem monovariant. În cazul discutat mai sus, aceste faze sunt solide DARși LAîn contact cu soluțiile sale saturate: odată cu creșterea temperaturii acestora din urmă, cu modificarea presiunii acestora, compoziția soluției este în continuă schimbare, iar faza solidă, deși se modifică constant în cantitate [Masa întregul sistem este presupus a fi constant.], dar își păstrează compoziția neschimbată, individualitatea sa. Nu există nicio îndoială că semnul indicat de Wald este cunoscut de multă vreme chimiștilor și l-au folosit constant atunci când au descoperit compuși „permanenți, chimici”, dar înainte de Wald nu a fost formulat clar de nimeni, iar definiția compușilor „chimici” în manuale era deci incompletă. În experiment însă, pentru a stabili „omogenitatea” unei substanțe, a fost întotdeauna necesară cristalizarea acesteia din diferiți „solvenți” și la temperaturi diferite, adică forțarea acesteia să joace rolul unui corp. LA exemplul nostru; trebuia să determine greutatea vaporilor săi și comparați compoziția vaporilor cu compoziția corpului lichid (solid) etc. Ce explică, sau, mai corect, ce înseamnă împrejurarea că corpurile DARși LAîși păstrează compoziția neschimbată într-un interval de schimbări de temperatură și presiune? Ideea este că dacă corpurile DARși LA exotermice, își păstrează compoziția atâta timp cât le studiem la temperaturi sub acele temperaturi la care pot începe reacțiile de disociere în ele. DAR pe A 1 și A 2, V pe b 1și b2; dacă DARși LAîn condițiile experimentului, compușii sunt endotermici, apoi își păstrează individualitatea atâta timp cât îi aducem în contact reciproc peste o anumită temperatură limită, sub care cu greu pot exista, gata să se dezintegreze în părțile lor componente [În asemenea condiții , există de obicei toți compușii „endotermici”, dintre care unii sunt enumerați mai sus. Amintiți-vă că peroxidul de hidrogen, un „compus endotermic”, se formează într-o flacără de gaz detonant, că Si 2 Cl 6 (Troost și Hautefeuille) se formează din SiCl 4 și Si peste 1300 °:
începe să se descompună sub această temperatură și este complet disociat deja la 800°. Dar dacă un gaz încălzit la 1300° este răcit brusc, atunci se obține un lichid, kip. la 140° și începe să se descompună abia la aproximativ 350°C; dedesubt se pastreaza datorita rezistentelor pasive. mier Fosfor - pe cercetările lui Tamman privind condițiile transformărilor sistemelor suprarăcite (endoterme).] Apoi își păstrează individualitatea atâta timp cât îi aducem în interacțiune la presiuni mai mari decât presiunile de disociere inerente reacțiilor lor de descompunere; sau, în fine, cu sisteme endoterme, când le studiem la un asemenea grad de suprarăcire, când transformarea care se petrece în ele (dacă are loc) este practic insesizabilă pentru noi. În consecință, constanța compoziției este stabilită de condițiile alese pentru experiment. Dar de ce nu se formează compușii în toate proporțiile posibile, ci în cea mai mare parte (cf. Hidrocarburi) într-un număr foarte limitat dintre ei? Wald răspunde la aceasta subliniind solubilitatea reciprocă limitată a solidelor [Pentru a înțelege acest lucru pentru dvs., este suficient să studiați curbele de solubilitate ale hidraților de clorură de calciu (vezi Regula fazelor l. c.) sau clorurii ferice (vezi Evaporarea fracționată l. c. ), unde se vede că solubilitatea apei în sărurile halogenuri luate în stare solidă corespunde doar unui număr foarte limitat de proporții.] și derivă (l.c.) din această poziție chiar legea rapoartelor multiple (vezi mai jos), dar este fără îndoială că, pe lângă În plus, un număr limitat de compuși se datorează și așa-numitei naturi chimice a corpurilor, ceea ce face, de exemplu, că pentru hidrogenul cu oxigen, singurul compus stabil (exotermic) sub condițiile noastre sunt doar apă, iar restul sistemelor (H 2 O 2 , H 2 O 4 ?), care conțin mai mult oxigen la temperaturile și presiunile noastre, nu sunt foarte stabile (suprarăcite) și cu greu pot fi stocate pentru o perioadă scurtă de timp. . Apoi, după cum se poate observa din exemplele prezentate, această limitare este evidentă, datorită condițiilor limitate aleatoriu („obișnuite”) în care studiem interacțiunile diferitelor corpuri. Dar dacă se observă cazuri de solubilitate limitată, atunci trebuie de așteptat și fenomenul opus, adică cazuri de amestecare completă a corpurilor în stare solidă în toate privințele posibile, în caz contrar, formarea unor astfel de sisteme care, având caracteristicile obișnuite ale compușilor „chimici”, vor diferi de acestea prin incertitudinea completă a compoziției. Unele dintre fenomenele legate de aceasta sunt de obicei descrise ca amestecuri izomorfe (cf. resp. articol), unele sunt descrise în general sub denumirea de soluții solide (van "t Hoff, Mallard, Klein, Runne, Buxhoevden u. Tammann). Având în vedere interacțiunea corpurilor de mai sus DARși LA din punctul de vedere al legii fazelor nu am hotărât dacă aceste corpuri sunt elemente, sau dacă sunt complexe „chimic”. Cert este că legea nu face nicio diferență între elemente și compușii acestora și este în egală măsură aplicabilă atât fenomenelor de dizolvare a hidraților de clorură de calciu în apă (vezi Regula fazelor), cât și interacțiunii a două elemente, clor și iod (l. c .). Singura diferență cunoscută până acum între elemente și corpuri compuse este că ele nu au fost descompuse în mod tangibil în nicio formă de materie diferită de ele și, prin urmare, încă aderăm la definiția lui Lavoisier (vezi Nomenclatura chimică); singura diferență este că, având în vedere legea lui Dulong și Petit (vezi Căldura) și legea periodică a lui D. I. Mendeleev (vezi Legea periodică a elementelor chimice), putem afirma cu un grad mare de probabilitate că toate elementele moderne, dacă acestea sunt complexe, atunci complexitatea lor este de aceeași ordine [„Zi de zi transformăm materia în toate felurile posibile. Dar, în același timp, am stabilit cu precizie granițele unde se opresc astfel de transformări: nu au trecut niciodată atât de mult dincolo de .. .elementele chimice.Această limită nu ne este indicată de nicio teorie filozofică, acesta este un obstacol de fapt pe care noi, cu metodele noastre de realizare a experimentelor, nu am fost capabili să-l depășim... Înseamnă, totuși, că mental îl vedem aici limita finală Nu, fără îndoială, de fapt, chimiștii au privit întotdeauna această graniță ca pe un fapt incontestabil, dar întotdeauna cu speranța de a o depăși. M. Berthelot, „Les origines de l” Alchimie „(1885).] Recent, mulți și-au exprimat deja convingerea că s-a realizat o simplificare a elementelor noastre; de exemplu, J. J. Thomson consideră că această presupunere nu poate fi decât fenomenele observate. în timpul trecerii razelor catodice în gazele rarefiate se explică: „Deoarece razele catodice poartă sarcini negative; deviate de forțele electrostatice ca și cum ar fi încărcate negativ; sunt supuse acțiunii unei forțe magnetice exact în același mod ca și când această forță ar acționa asupra unui corp încărcat negativ care se mișcă pe calea acestor raze, atunci nu văd nicio modalitate de a evita concluzia că ele reprezintă negativ sarcini electrice transportate de particule de materie. Întrebarea este, ce sunt aceste particule? Reprezintă atomi, molecule sau materie într-o stare de mare separare? Pentru a face un pic de lumină asupra acestei circumstanțe, am făcut o serie de măsurători ale raportului dintre masa acestor particule și sarcina pe care o poartă”; ca urmare, s-a dovedit că m/e(m- greutate, e- sarcina) nu depinde de natura gazului si este foarte mica (= 10 -7) fata de cea mai mica astfel de valoare cunoscuta pana acum, si anume - 10 -4, care corespundea ionului de hidrogen in timpul electrolizei solutiilor apoase. de acizi, de ce Thomson a concluzionat că în condiții catodice „avem de-a face cu o nouă stare a materiei, o astfel de stare când diviziunea ei este avansată mult mai mult decât în starea gazoasă; o astfel de stare când diferite tipuri de materie, adică provin din hidrogenul, oxigenul etc., devin identice”, etc. În ciuda numeroaselor lucrări în acest domeniu, problema a avansat relativ puțin din cauza dificultăților experimentale; prin urmare, se cuvine doar să o subliniem aici și, de altfel, să cităm recenzia lui Ostwald, conform căreia „legea de bază a electrolizei, legea lui Faraday, s-a dovedit a fi complet inaplicabilă materiei sau corpurilor care transportă curent în gaze. Această contradicție. este exprimată într-o asemenea formă încât, se presupune că, cercetările asupra conductivității gazelor au demonstrat existența unor particule materiale de câteva sute de ori mai mici decât o moleculă de hidrogen (de 200 de ori); dar natura ipotetică a unei astfel de concluzii este evidentă, iar denumirea de ioni pentru aceste fenomene, urmând legi complet diferite, este inadecvată” (1901). Trebuie să așteptăm o explicație experimentală ulterioară a subiectului.
III. Legea echivalentelor (cf. Sistem unitar). Bergman observase deja că atunci când se amestecă soluții de două săruri neutre, neutralitatea soluției nu este perturbată, dar nu a acordat suficientă atenție acestei circumstanțe. Primul sa angajat într-un studiu amănunțit al fenomenului lui Wenzel (1740-43), care a pus bazele stoichiometriei cu lucrarea sa „Vorlesungen über die chemische Verwandtschaft der Kö rper” (1777) (vezi). Confirmând corectitudinea observațiilor lui Bergmann, Wenzel a dat o explicație a acestora, care a constat în faptul că diferite cantități de alcalii și pământuri diferite, neutralizând aceeași cantitate de orice acid, ar trebui să neutralizeze cantități egale de orice alți acizi; cu alte cuvinte, că raportul dintre masele a două pământuri care neutralizează o anumită cantitate de acid rămâne constant chiar și atunci când neutralizează toți ceilalți acizi, iar acest lucru a făcut posibilă verificarea analizelor și chiar calcularea cantității de bază necesară pentru formează o sare medie cu un acid dat, dacă se cunoaște cantitatea de o singură bază necesară în acest scop; Wenzel însuși, însă, nu a acordat o importanță deosebită acestei împrejurări, iar opera sa nu a fost apreciată de contemporani, deși era foarte exactă pentru acea vreme. Nu a fost mai fericit și cel mai apropiat adept al lui Wenzel - Richter. Richter a început (1789-1802) prin aranjarea în serie a greutăților relative în care acizii se combină cu bazele pentru a forma săruri neutre. Numărul de baze necesare pentru a neutraliza 1000 de ore de acid sulfuric, el a numit seria neutră (Neutralit ä tsreihe) de baze; în același mod, a determinat seria neutră a diverșilor acizi necesari neutralizării unor cantități date de diverse baze. În ciuda acurateței relativ scăzute a cifrelor sale, Richter a observat că numerele serii neutre de baze sunt proporționale între ele și că același lucru este valabil și pentru seria neutră de acizi. În legătură cu aceste lucrări, există o altă „descoperire” a lui Richter, și anume, el deține observații extinse asupra cantităților în care metalele se deplasează (vezi. Deplasarea) unele pe altele din sărurile neutre, adică determinarea acelor cantități în care acestea se combină cu o cantitate constantă de oxigen, iar în cazul în care metalele sunt deplasate din sărurile unui acid și acele cantități în care acestea, sub formă de oxizi, sunt combinate cu o cantitate constantă de anhidridă acidă [Pentru a clarifica acest lucru, este suficient să prezinți sulfatul de cupru ca un oxid de cupru compus cu anhidridă sulfurică și să scrieți ecuația pentru deplasarea cuprului de către fier:
CuO.SO3 + Fe = FeO.SO3 + Cu;
arată: de la 16 gr. unitati oxigenul sunt combinate 63 wt. unitati cupru și 56 wt. unitati fier (Cu = 63 și Fe = 56 în numere rotunde), și că (63 + 16) greutate. unitati oxid de cupru și (56 + 16) în greutate. unitati oxizii de fier sunt combinați cu 80 wt. unitati anhidrida sulfurica (S = 32 in numere rotunde)]. Anterior, Bergman a studiat deplasarea reciprocă a metalelor și și-a publicat observațiile în articolul: „De div e rsa phlogisti quantate in metallis”. El a descoperit că, pentru a înlocui argintul din sarea sa de acid azotic, sunt necesare cantități destul de precise și constante de alte metale; apoi a studiat deplasarea reciprocă a metalelor din alte săruri; s-au observat diferenţe mari în cantităţile de metale precipitante, dar supuse unor legi constante. Ca susținător al teoriei flogistului, Bergman și-a privit figurile astfel: fiecare metal, atunci când este dizolvat, se transformă în „var”, adică pierde flogistonul conținut în el (vezi); si de vreme ce, precipitat de un alt metal, precipiteaza in stare metalica, este fara indoiala ca este redus, se recombineaza cu cantitatea de flogiston necesara acestuia, in detrimentul metalului care il precipita, iar Bergman, pe baza din experimentele sale, a concluzionat că diferite metale 1) sunt conectate cu cantități diferite de flogiston și 2) că cifrele pe care le-a obținut dau acele cantități de metale care conțin cantități egale de flogiston. 20 dec 1783 Lavoisier a prezentat Academiei un memoriu Sur la précipitation des substances mé talliques les unes par les autres (Oeuvres etc., II, 528), unde, arătând la rezultatele lui Bergmann, spune că, „în opinia sa, absența sau prezența de flogiston în metale nu este altceva decât o presupunere. În realitate, și se poate recunoaște cu greutăți și măsuri în mână, că, cu orice calcinare a unui metal, fie că are loc uscat sau umed, cu ajutorul aerului, apei sau acizilor, se observă o creștere a greutății unui metal cauzată de adăugarea acestuia de ... oxigen (princip e oxygè ne) ... prin urmare, dacă 31 lb. de cupru sunt suficiente pentru a precipita 100 lb. de argint în stare metalică [Cifra reală este de 29,46 unități de greutate de cupru la 100 de unități de greutate de argint; experimentele lui Bergman în acest caz au fost eronate cu aproximativ 4%.], ceea ce înseamnă că această cantitate de cupru este capabilă să se combine complet cu tot oxigenul conținut în 100 fn. argint ... în stare de var "; Mai mult, Lavoisier nu ține cont de remarca corectă tocmai făcută și, bazându-și calculele pe datele incorecte ale lui Bergman, ajunge la concluzii complet incorecte. Câțiva ani mai târziu, opera lui Richter apare cu date mai exacte și cu o explicație lipsită de contradicțiile din memoria lui Lavoisier. Richter stabilește, de altfel, că mercurul și fierul formează mai mulți compuși definiți cu oxigenul, dar el expune rezultatele lucrării sale în limbajul cel mai complicat, în plus, ele conțin numeroase calcule referitoare la o serie de legi imaginare, despre care Richter le credea că el deschis. Aproape toate aceste lucrări trec neobservate, iar egalitatea cantității de oxigen este apoi descoperită din nou de Gay-Lussac (în 1808), iar existența diferitelor compoziții constante de oxizi de fier și mercur - de Proulx în timpul disputei sale (vezi articol corespunzător) cu Berthollet. În 1782, Fischer a atras atenția asupra lucrării lui Richter și a constatat că toate tabelele sale de serii neutre pot fi reduse la unul singur, format din două rânduri: unul conține numărul de baze exprimat în numere, iar celălalt conține cantitățile necesare de acizi. pentru formarea sărurilor neutre cu numărul indicat de baze. „Aceste numere exprimau, în consecință, relațiile de neutralitate dintre baze și acizi, iar tabelul care le-a încheiat a rezumat într-o formă clară și convenabilă compoziția un numar mare săruri neutre". Datorită lui Fischer, rezultatele lucrării lui Richter au devenit bine cunoscute, dar totuși influența lor a fost foarte nesemnificativă, iar ceea ce a găsit a fost redescoperit ulterior. Între timp, Wenzel și Richter au descoperit faptul că dacă două corpuri sunt legate de un al treilea. într-o oarecare privință A:B atunci ele se pot înlocui între ele în același raport într-o serie întreagă de corpuri complexe și, într-un caz anume, pot fi, în consecință, în același raport sau într-un multiplu al acestuia (vezi mai jos) să fie combinate între ele. Aceste numere caracteristice au fost numite de Wollaston - echivalente; în modern echivalentele manuale sunt definite ca (proporționale) numere care arată în ce cantități de greutate sunt combinate elementele cu o singură greutate. unitati hidrogen sau înlocuiți-l.
IV. Legea rapoartelor multiple deținut de Dalton; istoria originii sale nu poate fi acum reconstruită cu acuratețe; este de obicei formulat astfel: dacă două corpuri A și B sunt conectate în mai multe rapoarte, atunci masele corpului B pentru aceeași masă a corpului A sunt în rapoarte multiple simple între ele și în același timp într-un raport simplu și multiplu cu echivalentul corpului B; o formulare mai generală se datorează lui Duhem (Le mixte et la combinaison chimique, 1902, 73): „Să C 1 , C 2 , C 3 ... vor exista diverse elemente; pentru fiecare dintre ele, putem alege un număr caracteristic pentru acesta, numit număr proporțional (greutate „atomică”) și obținem, în continuare, un tabel cu numere proporționale (greutăți „atomice”): p 1 , p 2 , p 3 ... Dacă corpurile C 1 , C 2 , C 3 ... sunt interconectate, atunci masele corpurilor de legătură sunt în relația: λр l , μр m , νр n ... Unde λ, μ, ν sunt numere întregi... Dalton și contemporanii săi nu s-ar mulțumi cu expresia „numere întregi”, ci ar spune „numere prime întregi”; dar această limitare, corectă la începutul chimiei, devine din ce în ce mai puțin adevărată pe măsură ce se dezvoltă; mai ales succesele Chimie organica obligat în multe cazuri să atribuie numerelor întregi λ, μ, ν... valori mari; caracterul simplității, care le-a fost atribuit la început, a dispărut astfel; cum, de exemplu, să o găsim în formula parafinei, unde masele combinate de carbon și hidrogen sunt legate ca λ odată luată greutate proporţională („atomică”) a carbonului şi μ odată luată greutatea proporțională a hidrogenului și unde λ și μ au semnificatii: λ = 27, μ \u003d 56?" Într-adevăr, formularea obișnuită a legii nu este aplicabilă nu numai parafinelor (vezi), unde raportul dintre indicatorii din formulele pentru „greutățile proporționale” de hidrogen și carbon este transmis printr-o fracțiune. 2+2/n, dar în general tuturor serii nelimitate hidrocarburi, începând cu seria acetilenei, deoarece este succesiv egală cu: 2 - 2/n, 2 - 4/n, 2 - 6/n etc., unde n- numere întregi. Dar trebuie să fim atenți la faptul că în astfel de comparații aplicăm „legea” cazurilor care nu corespund exemplelor din care a fost derivată, iar dezacordul ei cu observația nu este atunci deloc surprinzător. „Legea” a fost stabilită de Dalton la compararea gazului de mlaștină cu etilena și la studierea oxizilor de azot și nu trebuie decât să acordați atenție formulelor moderne ale acestor compuși pentru a vedea că au fost comparați compuși de diferite serii și diferite grade de oxidare. , într-un cuvânt - de diverse limite, dar cu o constantă masa unuia dintre elementele din ele; iar cu această restricție, „legea” este valabilă și acum, așa cum se vede chiar și în formulele hidrocarburilor, în comparație între ele, seria: C 2 H 2, C 3 H 2, C 4 H 2 .. ., CH4, C2H4, C3H4..., C2H6, C3H6, C4H6... etc.; într-o astfel de comparație, găsim atât numere întregi relativ simple, cât și regula că „masele corporale LA, pe greutate corporală constantă DAR, sunt în raporturi multiple între ele, exprimate ca rapoarte ale numerelor întregi; aceleași exemple pot servi și la ilustrarea împrejurării care i-a atras în special atenția lui Dalton și care constă în faptul că compușii „chimici” apar în salturi; este cu adevărat clar că pe H 2 are o masă de carbon egală cu 24, 36, 48, H 4 - 12, 24, 36 ..., H 6 - 24, 36, 48 etc., adică se repetă un număr foarte mic de numere și nu există continuitate.Pentru a explica acest lucru, Dalton și-a propus ipoteza „atomică” [Vezi „Alembic Club Reprints”, nr.2, 1893, „Foundations of Atomic Theory” de J. Dalton a. Wollaston (1802-1808) și Ostwald" s "Klassiker etc.", nr. 3.1889: "Die Grundtagen der Atomthéorie" von J. Dalton u. W H. Wollaston (1803-08). mier pe langa art. Debus "a (l. c.) Dahem" a (l. c.) și A. Hannequin, "Essai critique sur l" hypothese des atomes dans la science contemporaine "(P. 1899)]. Conceptul de structură atomică a materiei este, fără îndoială, de foarte origine antică (vezi Substanța), dar Dalton pare să o aibă (Roscoe a. Harden, „A New Wiew of the Origin of Daltons Atomic Theory, 1896; de exemplu, de asemenea, în Zeit. f. Ch., 1896), dezvoltat sub influența lui Newton, care avea nevoie de atomi pentru a-și construi teoria despre fluxul de lumină. Newton și-a dezvoltat punctul de vedere în întrebările care i-au pus capăt Opticii; Astfel, la Întrebarea XXXI, Newton întreabă: „Nu au cele mai mici particule ale corpurilor anumite proprietăți, abilități sau forțe care să le permită să influențeze la distanță nu numai razele de lumină pentru a le reflecta, refracta și devia, ci și unul asupra celuilalt și provoacă în acest fel majoritatea fenomenelor naturale? Când două corpuri sunt conectate, Newton consideră legătura ca o consecință a atracției reciproce a celor mai mici particule ale ambelor corpuri la distanțe mici. „Când potasa se estompează, nu se datorează atracției reciproce dintre particulele sale și particulele de apă, care se repetă peste ele sub formă de abur, particule de apă? Motivul imediat pentru adoptarea vederilor atomice pentru Dalton a fost, se pare (eronată, după cum știm acum), observația că oxidul de azot poate reacționa complet cu oxigenul atmosferic sau în raport cu 36 voi. NU la 100 rpm aer, sau în raport cu 72 vol. NU pentru aceeași 100 rpm. aer, iar în primul caz se formează acid azotic, iar în al doilea acid azotic; „Aceste fapte”, spune el, „indică în mod clar teoria procesului: elementele de oxigen se pot combina cu o anumită cantitate de oxid nitric, sau dubla, dar nu cu oricare dintre cantitățile intermediare”. El a fost adus la vederi atomice prin studiul solubilităților diferitelor gaze în lichide și a presiunii gazului în amestecuri. Cel puțin, vedem că la mai mult de un an după experimentul menționat (6 septembrie 1803), el este ocupat „să observe particulele finale (particulele finale) ale corpurilor și combinația lor”, și la mesajul său „Despre absorbția de Gaze prin apă și alte lichide, citit pe 21 oct. 1803 („On the Absorption of Gases by Water and other Liquids”, retipărit prescurtat în „Klassiker” al lui Ostwal, vezi mai sus) este atașat primul tabel al greutăților relative (foarte inexact), intitulat: „Tabelul greutăților relative ale ultimei particule de gaze și alte corpuri”; în el sunt enumerate elementele: hidrogen, azot, carbon, oxigen, fosfor, sulf intercalate cu diverși compuși, între care se află unele substanțe organice, iar cu fiecare nume o figură de greutate relativă primește particule finite fără a explica cum a fost obținut de către autor În 1804, el i-a comunicat părerile profesorului Thomson (din Edinburgh), care l-a vizitat la Manchester, iar acesta din urmă le-a publicat (cu acordul lui Dalton) în volumul al 3-lea. din manualul său X., publicat în 1807. În cele din urmă, în 1808, ele au fost expuse chiar de Dalton în „A New System of Chemical Philosophy” (vezi „Klassiker” l. p. a lui Oslwald). Următoarele pasaje caracterizează punctele cele mai semnificative ale opiniilor lui Dalton. „Asemenea observații (vorbim despre observații asupra celor trei stări ale corpurilor: gazos, lichid și solid) au condus pe toată lumea la un acord tacit că corpurile de dimensiuni apreciabile, fie ele lichide sau solide, constau dintr-un număr enorm de particule neobișnuit de mici, sau atomi, materie ținută împreună printr-o forță de atracție, mai mult sau mai puțin semnificativă, în funcție de circumstanțe, o numim coeziune atunci când împiedică particulele să se separe, sau... afinitate când le colectează dintr-o stare dispersată (de exemplu, când aburul se transformă în apă) ... O întrebare destul de importantă este dacă particulele finale (ultimele) ale unei substanțe date, de exemplu apa, sunt aceleași, adică au același aspect, aceeași greutate etc. Pe baza faptului că știm că nu avem niciun motiv să presupunem vreo diferență între ele... este greu de imaginat că agregatele de particule neidentice ar putea fi atât de omogene. mai grele decât altele și dacă, întâmplător, o parte din acest lichid consta în principal (? ) dintre ele, aceasta ar trebui să afecteze greutatea specifică a apei, care nu a fost respectată. Aceleași considerații se aplică și altor organisme. Trebuie, în consecință, să concluzionăm că particulele finale ale oricărui corp omogen sunt complet identice între ele în ceea ce privește greutatea, forma lor etc. Cu alte cuvinte, fiecare particulă de apă este identică cu orice altă particulă a acesteia, fiecare particulă de apă. hidrogenul este complet identic cu cealaltă particulă de hidrogen etc.". „Una dintre sarcinile principale ale acestei lucrări este de a indica importanța și beneficiul determinării greutății relative a particulelor finale, atât corpuri simple, cât și complexe, numărul de particule simple ale unui element care alcătuiesc o particulă complexă... Dacă sunt date două corpuri, DARși b, predispuse la conectare, atunci sunt posibile următoarele combinații ale acestora, începând cu cea mai simplă, și anume:
1 atom de corp A+ 1 atom B= 1 atom CU, binar
1 atom A+ 2 atomi LA= 1 atom D, triplu
2 atomi DAR+ 1 atom B= 1 atom E, triplu
1 atom A+ 3 atomi LA= 1 atom F, cvadruplu
3 atomi A+ 1 atom LA= 1 atom g, cvadruplu
etc Următoarele reguli generale pot fi luate drept călăuzitori în cercetările legate de sinteza chimică. 1) Dacă se poate obține un singur compus pentru două corpuri care reacţionează, atunci trebuie să presupunem că este binar, cu excepția cazului în care un motiv ne obligă să se pronunțe în favoarea opiniei opuse. 2) Dacă se observă doi compuși (pentru 2 elemente), atunci trebuie să ne gândim că unul dintre ei este binar, iar celălalt este triplu. 3) Când se cunosc trei compuși, ar trebui să ne așteptăm ca unul dintre ei să fie binar și doi dintre ei să fie ternari. 4) Când se cunosc patru compuși, trebuie să ne așteptăm ca unul dintre ei să fie binar, doi să fie ternari, unul cuaternar etc. 5) Un compus binar trebuie să fie întotdeauna mai greu specific decât un simplu amestec al ambelor corpuri constitutive. 6) Compusul triplu trebuie să fie mai specific decât un amestec dintr-un compus dublu cu unul simplu, care, combinat, ar putea forma un compus complex etc. 7) Regulile și observațiile indicate sunt la fel de aplicabile atunci când corpuri precum Cuși D, Dși E... Din aplicarea acestor reguli, deducem următoarele concluzii: 1) că apa este un compus binar de hidrogen și oxigen, iar greutățile relative ale ambilor atomi elementari sunt de aproximativ 1:7; 2) că amoniacul este un compus binar de hidrogen și azot și că greutățile relative ale ambilor atomi elementari sunt aproximativ 1:5; 3) că oxidul de azot este un compus binar de azot și oxigen, a căror atomi cântăresc 5:7, respectiv... În toate cazurile, greutățile sunt exprimate în atomi de hidrogen, fiecare fiind egal cu unul... În Având în vedere noutatea, precum și importanța ideilor, s-a găsit potrivit să se ofere tabele care ilustrează metoda de conectare în unele dintre cele mai simple cazuri... Elementele sau atomii unor astfel de corpuri, care sunt considerate în prezent elementare, sunt indicate prin cercuri mici cu unele semne convenționale (vezi Formule); compusul constă în juxtapunerea a doi sau mai mulți atomi „... În prezent, totalul arbitrar al acestor reguli de ghidare este involuntar izbitor. Este evident că compoziția compusului nu depinde în niciun caz de faptul că știm sau nu. , condițiile pentru formarea a 2 elemente ale mai multor compuși, iar dezacordul nostru în acest sens cu Dalton este cel mai bine ilustrat prin faptul că dăm apei formula H 2 O și amoniac H 3 N, adică considerăm că primul nu este un binar. , ci un corp triplu, iar al doilea - cuaternar.Atunci, nu este clar de ce, în prezența a doi compuși, unul ar trebui să fie binar, iar celălalt ternar, în timp ce pentru hidrogen cu oxigen, doi compuși sunt cunoscuți cu siguranță, dar acum considerăm că unul este ternar - H 2 O, iar celălalt cvadruplu - H 2 O 2 (peroxid de hidrogen). Reacția clasică de formare a clorurii de hidrogen:
H 2 + Cl 2 \u003d 2HCl,
când, după cum știți, ud. greutatea amestecului de hidrogen cu clor este, în limitele exactității observațiilor, sp. greutatea clorurii de hidrogen etc. Între timp, influența opiniilor lui Dalton asupra dezvoltării lui X. a fost enormă și continuă până în zilele noastre; Întrebarea este, ce a cauzat-o, când însăși ideea structurii atomice a materiei nu îi aparține lui Dalton? Din câte se poate aprecia, această influență se datorează următoarelor împrejurări: 1) Discontinuitatea materiei care ne înconjoară, lipsa de continuitate în ea ne afectează atât de mult încât nu ne putem imagina în mod figurat că este continuă și toate încercările de această direcție s-a dovedit până acum a fi extrem de greu de înțeles și inutilă; este evident că, din aceleași împrejurări, ideile atomice au apărut chiar și printre antici. 2) Dalton a arătat aplicabilitatea practică a vederilor atomice la chimie; acceptând că atomii diferitelor elemente diferă în greutate relativă [În acest sens, el s-a diferențiat de Higgins" (1790), care credea că atomii de bază sunt identici între ei și atribuie toate diferențele observate în materie mai mari sau mai mari. ciorchini mai mici. Vederile lui Higgins „a au fost înviate mai întâi de Praut” th, iar acum de J. J. Thomson „th]; a dat o schemă neobișnuit de simplă și ușor accesibilă, în care existența atât a compușilor de compoziție constantă, cât și a compușilor supuși legii „raților multiple” se potrivește cu o ușurință surprinzătoare. Claritatea și aplicabilitatea schemei în ochii mai multor generații de chimiști au servit chiar drept „explicație” a acestor legi și abia acum se dovedește că „constanța compoziției” este posibilă mult mai des decât se credea anterior, că factorul ceea ce o determină este relația cunoscută dintre corpurile care reacţionează „naturii” încă nedeterminate, tipul de energie externă care acționează asupra sistemului și complexele fizice eterogene (fazele) din care este compus. Cât despre legea „raților multiple”, ea încă nu are o explicație general acceptată; comparația dată de Wald cu legea parametrilor raționali în cristalografie este nesatisfăcătoare din cauza vizibilității reduse și a insuficientei clarități a prevederilor principale; N. S. Kurnakov este de acord cu punctul de vedere al lui Wald în raportul său „Despre fuzibilitatea aliajelor metalice” la cel de-al XI-lea Congres Est. și vr. în Sankt Petersburg. în 1901; paralelismul ambelor propoziții nu poate fi pus la îndoială; dar, dacă în cristalografie legea menționată are chiar o demonstrație matematică, care pare să se bazeze pe imposibilitatea existenței cristalelor sferice, atunci încă nu este clar ce poziție paralelă trebuie luată X. Pe de altă parte, Duhem spune: „Este evident că răspunsul (al teoriei atomice la fenomenele de raporturi multiple) este satisfăcător și poate fi considerat chiar o victorie pentru teoria atomică, o victorie cu atât mai vizibilă cu cât această explicație. a legii raporturilor multiple nu a fost ulterior ajustată, care, dimpotrivă, este coevală cu legea, și poate a precedat descoperirea ei.Este această victorie definitivă?Pentru ca aceasta să fie așa, este necesar nu numai ca explicaţia relaţiilor multiple dată de teoria atomică să fie un curent probabil, dar şi singurele posibile.Dar cine va îndrăzni să-şi asume garanţia acestei interpretări şi să îndrăznească să afirme că nu va fi niciodată posibil să găsească un alt cuvânt? , dar și însăși ideea de atomi [Duhem se referă la prezentarea dată de acesta în lucrarea citată („Le mixte et la comb. chim.”, 1902).]; Noi, dacă suntem atenți la contradicțiile care apar imediat de îndată ce explicăm aceste principii din punct de vedere atomic [Cf. Stallo, „La Mati ère et la Physique moderne”.], este greu de apărat de ideea că singurul succes al teoriei atomice reprezintă o victorie aparentă pentru care ziua de mâine nu este asigurată; că această teorie nu ne familiarizează cu cauza adevărată, obiectivă, a legii raporturilor multiple; că acest motiv trebuie încă descoperit și, în sfârșit, că X. modern nu vorbește în favoarea doctrinei lui Epicur. „Oricât ar răspunde viitorul, ideea este aceasta: Dalton a observat existența „relațiilor multiple” și a considerat că aceste fenomene decurg din reprezentările atomice, deoarece corespund celor mai simple combinații posibile de atomi; acum cunoaștem un număr imens de sisteme cu o compoziție nedefinită, și nu numai în stare gazoasă și lichidă, cum era cazul pe vremea lui Dalton, dar și în solid (începând cu amestecuri izomorfe Mitcherlich și terminând cu soluție solidă „t Hoff”); nu se poate spune că aceste fenomene contrazic direct structura atomică a materiei, ci în schimb necesită o explicație de ce nu sunt observate în mod constant și este evident că nu ne putem liniști doar în această explicație. 3) În sfârșit, legea raporturilor multiple a lui Dalton le-a oferit chimiștilor un criteriu ușor accesibil pentru a judeca dacă au de-a face cu un singur corp individual sau cu sistem complex format prin interacțiunea a două sau mai multe corpuri care sunt stabile în condiții experimentale. Această latură a subiectului nu a fost formulată clar de contemporani, dar importanța legii în sine nu le-a scăpat atenției, iar Thomson în curând (14 ianuarie 1808) constată că sarea acidă oxalic-potasică conține aproape dublul cantității de acid în comparație. la sarea medie, iar Wollaston descoperă (28 ianuarie 1808) rapoarte simple, multiple pentru unele săruri de acid, carbonic și oxalic, apoi Berzelius este luat pentru a determina greutățile atomice și le dedică câțiva ani de muncă grea și neobișnuit de atentă. [Cp. Ostwald "s, "Klassiker", No. 35, "Versuch die bestimmten und einfachen Verhältnisse autzufinden, nach velchen die Bestandtheile der unorganischen Natur mit einander verbunden sind, von J. Berzelius" - 1818-19; Aici Berzelius nu a dat apoi mai multe locul să ne oprim asupra dificultăților pe care chimiștii le-au întâmpinat în stabilirea cu precizie a greutăților atomice și asupra modului în care regulile lui Dalton au fost eliminate treptat, iar Berzelius sa bazat pe legile capacității termice a elementelor solide, Dulong și Petit, izomorfismul lui Mitcherlich (1819); ne limităm; pentru a sublinia că toate acestea s-au dovedit a fi insuficiente, iar greutățile atomice moderne au fost stabilite abia după ce așa-numita „teorie moleculară” a lui Avogadro-Ampere a devenit general acceptată.
Legile volumetrice ale lui Gay-Lussac. Lavoisier (Oeuvres etc., I, 73 și 75) a observat că pentru ca oxigenul să se combine cu hidrogenul pentru a forma apă, este necesar să se ia de două ori volumul de hidrogen pe volum al acesteia; această împrejurare a fost contestată mai târziu (Dalton, de exemplu, a crezut că pentru 185 de ore de hidrogen ar trebui să existe 100 de volume de oxigen), și de aceea era important ca A.F. Humboldt și Gay-Lussac, cu experimente extrem de amănunțite pentru acea vreme, să stabilească [ „Exp ériences sur les moyens endiométriques et sur la proportion des principes constituants de l” atmosphè re”, 1805; vezi Ostwald, „Klassiker” No. 42.] că Lavoisier avea dreptate și că, într-adevăr, 200 rpm. hidrogenul este necesar pentru formarea apei 100 vol. oxigen. În acest moment, a existat deja o dispută între Proulx și Berthollet cu privire la constanța compoziției compușilor chimici, pe de altă parte, Dalton, în noul său sistem de filozofie chimică, a vorbit în favoarea unui sistem neschimbat. compozitia atomica compuși „chimici” și, prin urmare, Gay-Lussac în 1808 (memoria „Sur la combinaison des substances gazeuses, les unes avec les autres” [Vezi Ostw. „Klas.” Nr. 42.] a întreprins un studiu lung asupra interacțiunii diferitelor gaze; rezultatele s-au dovedit a fi favorabile opiniilor lui Proulx și Dalton, și anume, Gay-Lussac a constatat că „combinațiile de corpuri gazoase între ele apar întotdeauna în relații foarte simple, astfel încât 1, 2 și, cel mult, Se combină 3 volume cu un volum dintr-un gaz Aceste rapoarte de volum nu se respectă pentru corpurile lichide și solide, ci în egală măsură pentru greutățile corpurilor care reacţionează, ceea ce constituie o nouă dovadă că numai în stare gazoasă corpurile se află în aceleași circumstanțe și se supun. legile corecte. suferite de gaze atunci când sunt combinate este, de asemenea, într-un raport simplu la volumul unuia dintre ele, iar acest lucru este, de asemenea, caracteristic stării gazoase. „De obicei, în manualele moderne ale observațiilor lui Gay-Lussac. rezumat sub forma a doua legi: 1) Volumele corpurilor care reacţionează în stare de gaz şi vapori sunt fie egale, fie sunt în rapoarte simple exprimate prin rapoarte ale numerelor întregi mici simpleși 2) Volumul corpului format în stare de gaz și vapori este întotdeauna într-un raport simplu față de volum (gaz-vapori) a fiecăreia dintre părțile constitutive incluse în acesta. Experimentele lui Gay-Lussac par să fi pus capăt disputei lui Berthollet cu Proulx. Oricât de ciudat ar părea la prima vedere, Dalton a reacționat negativ la ele, și anume, pe lângă „Noul său sistem de filosofie chimică” el critică observațiile lui Gay-Lussac privind interacțiunea oxidului nitric și oxigenul (într-adevăr, eronate) și adaugă: „De fapt, ceea ce spune el despre volume este analog cu ceea ce spun eu despre atomi; și dacă s-ar putea dovedi că toate gazele (fluidele elastice) conțin în volume egale un număr egal de atomi, sau numere înrudite ca 1, 2, 3 etc., atunci ambele ipoteze ar coincide, cu excepția faptului că a mea este universală, iar a lui este aplicabilă doar gazelor. Gay-Lussac nu a putut însă să nu vadă că o astfel de ipoteză a fost considerată de mine și aruncată ca lipsită de valoare [Dalton se referă la un pasaj din cartea sa în care spune că a avut odată o credință vagă, pe care a împărtășit-o cu mulți alții, că în volume egale de orice gaz (simple și complexe din punct de vedere chimic) există un număr egal de atomi, dar ar trebui să aibă renuntat la el în primul rând, pe baza observațiilor privind interacțiunea oxigenului cu oxidul nitric, când un amestec de volume egale de gaze se reduce uneori la jumătate, ceea ce indică faptul că în corpul final există mai puțini atomi pe unitatea de volum decât în cei inițiali ( această observaţie este incorectă), iar în al doilea rând, pentru că ud. greutatea vaporilor de apă este mai mică decât sp. greutatea oxigenului care o formează, ceea ce ar fi imposibil dacă s-ar forma prin combinarea a 2 atomi de hidrogen (2 vol.) cu 1 atom de oxigen (1 vol.), dar a reînviat această idee, și voi face o puține lucruri despre el remarcă, deși nu am nicio îndoială că el însuși va vedea în curând inconsecvența părerii sale.” Dalton termină astfel: „Adevărul, sunt convins, este că gazele nu se combină niciodată în volume egale sau simple... ; nicăieri nu există o aproximare mai apropiată a acurateței matematice decât în cazul hidrogenului cu oxigen și, între timp, cel mai precis dintre experimentele mele arată: aici la 1,97 vol. hidrogenul reprezintă 1 vol. Acum știm că Gay-Lussac a fost, fără îndoială, mai aproape de adevăr decât Dalton și tocmai în cazul hidrogenului cu oxigen Morley și Scott au arătat că raportul adevărat era de 2,002 la 1.
Poziția Avogadro. În iunie 1811, fizicianul italian A. Avogadro s-a angajat să împace opiniile lui Dalton cu observațiile lui Gay-Lussac într-un articol intitulat: „Essai d” une mani ère de déterminer les masses relatives des molécules élémentaires des corps, et les proportions selon elles entrent. dans le s combinaison" [Nomenclatura pe care o urmează Avogardo în acest articol diferă de a noastră; după cum notează J. Walker, molecula lui = atom, moleculă (nu contează), molecule inté grante = moleculă (în primul rând corpuri complexe), mol é cule constituante - o moleculă a unui corp elementar și mol écule élé mentaire - un atom al unui corp elementar, dar unul dintre locurile din articol face să se creadă că mol écule inté grante înseamnă și atom (cf. Ostwald "s ," Klassiker ", nr. 8).]. „Gay-Lussac a arătat într-un memoriu interesant”, scrie Avogadro, „că combinațiile de corpuri gazoase apar întotdeauna în rapoarte volumetrice foarte simple și că, în cazul unui produs de reacție gazoasă, volumul acestuia este, de asemenea, în raporturi simple față de volume. a corpurilor care reacţionează.Dar raporturile dintre constituenţii maselor dintr-un compus par să depindă doar de numărul relativ de molecule care reacţionează (şi masele acestora) şi de numărul de molecule complexe formate.De aceea, trebuie concluzionat că există foarte multe relații simple între volumele corpurilor gazoase și numărul de molecule care le compun. , aparent, singura ipoteză acceptabilă ar trebui recunoscută că numărul de molecule ale oricăror gaze este același în volume egale, sau este întotdeauna proporțional cu volumul. , dacă numărul de molecule în volume egale a fost diferit pentru diferite gaze, atunci este greu de înțeles că legea care guvernează distanța moleculelor duce în toate cazurile la o legătură atât de simplă precum cea de mai sus, la pe care suntem nevoiți să-l recunoaștem între volum și numărul de molecule... Pe baza acestei ipoteze, se pare că avem mijloacele de a determina cu ușurință masele relative de molecule pentru corpurile capabile să existe în stare gazoasă, precum și relativul numărul de molecule necesare reacției; și anume, rapoartele maselor de molecule din această ipoteză sunt aceleași cu rapoartele dintre greutățile specifice ale diferitelor gaze (la temperaturi și presiuni egale), iar numărul relativ de molecule care reacţionează este dat direct de raportul dintre volumele de gaze care formează un compus dat. De exemplu, deoarece numerele 1,10359 și 0,07321 exprimă greutatea specifică a gazelor de oxigen și hidrogen (greutatea unui volum egal de aer \u003d greutăți specifice unității [Aceste numere sunt incorecte.], apoi raportul lor, în caz contrar, raportul între masele de volum egal ale ambelor gaze, reprezintă, conform ipotezei noastre, raportul dintre masele moleculelor acestora, din care rezultă că molecula de oxigen este de aproape 15 ori mai grea decât molecula de hidrogen, sau, mai precis, sunt legate de 15.074 la 1. .. [Raportul dat aici este incorect (vezi Formulele chimice). Pentru a înțelege raționamentul lui Avogadro, să notăm greutatea moleculei de oxigen ca M, greutatea unei molecule de hidrogen prin 1, apoi greutatea unui anumit volum de oxigen va fi - xM, Unde X numărul de molecule de oxigen din acest volum și greutatea aceluiași volum de hidrogen = x 1(după poziție). Cunoscut ud. greutăţile ambelor gaze în raport cu la aer, adică valorile: (xM)/pși (x 1)/p, Unde R - greutatea unui volum egal de aer; este evident că [(xM)/p]:[(x 1)/p] = M/1, adică egal cu raportul dintre greutățile moleculelor de oxigen și hidrogen, dintre care acesta din urmă este luat ca unitate de măsură convențională.]. Pe de altă parte, deoarece știm că raportul dintre volumele de hidrogen și oxigen în timpul formării apei = 2:1, atunci, prin urmare, știm că apa se formează în timpul interacțiunii fiecărei molecule de oxigen cu două molecule de hidrogen. .. Dar există un argument, care, la prima vedere, vorbește împotriva presupunerii ipotezei noastre pentru corpurile complexe. Pare necesar ca o moleculă complexă formată prin interacțiunea a două sau mai multe molecule de corpuri simple să aibă o masă egală cu suma maselor acestor din urmă; sau în special, când un corp complex este obţinut prin interacţiunea a 1 mol. un corp cu 2 sau mai mulți moli. alt corp la numărul de mol complexe. a rămas egal cu numărul de primul corp. În limbajul ipotezei noastre, acest lucru este echivalent cu faptul că, atunci când un gaz este combinat cu două sau mai multe volume dintr-un alt gaz, volumul compusului în stare gazoasă trebuie să fie egal cu volumul primului gaz. Și totuși, într-un număr mare de cazuri, acest lucru nu este observat. De exemplu, volumul de apă în stare gazoasă, așa cum arată Gay-Lussac, este de două ori volumul de oxigen utilizat pentru a o forma sau, ceea ce este același, egal cu volumul de hidrogen, în loc să fie egal cu volumul de oxigen. Dar se prezintă și modul de interpretare a acestor fapte în conformitate cu ipoteza noastră; și anume, presupunem: 1) că moleculele oricăror corpuri elementare... nu sunt formate din molecule elementare individuale (atomi), ci sunt compuse dintr-un anumit număr dintre ele, legate între ele prin atracție reciprocă și 2) că atunci când moleculele unui alt corp sunt combinate cu moleculele primului, formând o moleculă complexă, apoi molecula integrală, care ar trebui să fie formată, se descompune în două sau mai multe părți, formate din jumătate, un sfert etc. din numărul de molecule de primul corp intrând în combinație, legat de o jumătate, un sfert din moleculele celui de-al doilea corp..., astfel încât numărul de molecule finale devine dublu, cvadruplu etc., în comparație cu ceea ce ar fi fără dezintegrare, și exact așa cum este cerut de raportul de volum observat al gazului rezultat [„Astfel, de exemplu, molecula finală de apă trebuie să fie compusă dintr-o jumătate de moleculă de oxigen combinată cu o moleculă sau două jumătate de molecule de hidrogen. " (aprox. Avogadro). Actul de conectare 2 despre. hidrogen cu 1 vol. oxigenul Avogadro își imaginează, în continuare, ca un compus 2x ei spun hidrogen din 1 x ei spun oxigenul să se formeze inițial 1x mol complex. apă conţinând fiecare câte 2 mol. hidrogen și 1 mol. oxigen, dar apoi se descompune în 2x digurile mai simple, a căror masă este deja
(2x mol. hidrogen + x mol. acid) / 2x = (2 mol. hidrogen) / 2 + (mol. acru) / 2 = mol. hidrogen. + (mol. acru)/2;
fiecare volum de vapori de apă conține de 2 ori mai puțin oxigen decât un volum egal de oxigen gazos, în acesta din urmă a fost X ei spun acru și un volum egal de abur conține
x mol. apă \u003d x (mol. hidrogen + mol. acid / 2).].
Trecând în revistă diferiții, cei mai bine studiati, compuși gazoși, găsesc doar exemple de dublare a volumului unuia dintre termeni, conectarea cu două sau mai multe volume ale altui corp [Expresia este incorectă, dar, din păcate, des folosită. Fără îndoială, aici nu se observă o dublare a volumului, dimpotrivă, are loc reducerea acestuia; Avogadro, pe de altă parte, vorbește despre dublare, deoarece, conform presupunerii sale, volumul corpurilor care reacţionează este iniţial redus la un volum. În prezent, sunt mult mai multe exemple complexeși ecuația pentru formarea hidrogenului sulfurat la temp. sulf la fierbere:
S 8 + 8H 2 \u003d 8SH 2
Avogadro ar trebui să explice prin formarea moleculei inițial complexe S 8 Η 16 și octalizarea ulterioară a volumului său: S 8 H 16 \u003d 8SH 2 .]. Am văzut deja asta pentru apă. În mod similar, știm că volumul de amoniac este de două ori mai mare decât volumul de azot (liber) din acesta. Dar este posibil ca în alte cazuri moleculele să fie împărțite în 4, 8 etc. Posibilitatea unei astfel de împărțiri ar trebui așteptată și a priori... volume și neschimbate, mai mult, ca, de exemplu, în cazul de oxid nitric [Compoziție și sp. greutatea oxidului de azot este dată în formula NO, a cărui formare din azot și oxigen poate fi reprezentată doar prin ecuație
N 2 + O 2 \u003d 2NO.
De fapt, această reacție nu a fost încă realizată. Exemple bune sunt reacțiile:
H 2 + Cl 2 \u003d 2HCl,
H 2 + Br 2 \u003d 2HBr,
care apar fără modificarea volumului.]. Sub ipoteza divizibilității moleculelor, este ușor de observat că combinația de aici transformă de fapt două tipuri de molecule într-una și că o reducere cu cel puțin volumul unuia dintre gaze ar trebui să aștepte dacă fiecare moleculă complexă (vezi nota de mai sus) nu era divizibil în alte două, de natură identică... Pe baza unor presupuneri arbitrare despre cel mai probabil număr de molecule (atomi) din compuși, Dalton a încercat să stabilească relații între moleculele corpurilor simple. Ipoteza noastră... face posibilă corectarea datelor sale... Astfel, de exemplu, Dalton presupune că apa este formată prin combinarea hidrogenului și oxigenului moleculă cu moleculă (atom cu atom). Pe baza acestui fapt, și pe baza greutăților relative ale ambelor corpuri conținute în apă, rezultă că masa moleculei de oxigen trebuie să fie raportată la masa moleculei de hidrogen ca aproximativ 7½ la 1 sau, conform Dalton însuși, ca 6 la 1. Conform ipotezei noastre, acest raport este doar de două ori mai mare, și anume = 15:1. În ceea ce privește molecula de apă, ar trebui să fie egală în numere rotunde 15 + 2 = 17 (luând molecula de hidrogen ca 1) dacă nu ar fi divizibil cu 2; dar, în virtutea acestei împărțiri, devine jumătate, adică 8½, sau, mai precis, 8.537, așa cum poate fi găsit direct prin împărțirea bătăilor. greutatea vaporilor de apă, adică 0,625 (Gay-Lussac; greutatea specifică este dată în raport cu aerul) per sp. greutatea hidrogenului este de 0,0732. Această masă diferă de cele 7 atribuite de Dalton moleculei de apă, doar din cauza diferenței de numere pentru compoziția apei adoptate de Dalton etc. Faptul că opiniile lui Avogadro au fost puțin apreciate de contemporanii săi nu este surprinzător.Dalton nu a putut fi de acord. cu ei pentru că se îndoia în general de corectitudinea observațiilor lui Gay-Lussac și, în plus, părerile lui Avogadro erau împotriva convingerilor sale despre indivizibilitatea atomilor; mai ciudat este că articolul de mai târziu Avogadro a rămas complet uitat și că și acum se pot găsi multe neînțelegeri în manuale despre aceasta Trebuie să se vadă clar că propoziția lui Avogadro: „Volume egale ale oricăror gaze la temperaturi și presiuni egale conțin un număr egal de molecule”, sau invers: „Un număr egal de molecule de gaze luate la temperaturi și presiuni egale corespunde. la volume egale”, reprezintă, strict vorbind, nu o „ipoteză”, ci o definiție pur condiționată și nimic mai mult [Ostwald în „Grundlinien” al său îl numește postulatul lui Avogadro .]; acceptând-o, suntem de acord să descriem compușii noștri în așa fel încât reacțiile lor să se supună legilor lui Gay-Lussac, adică adică, astfel încât fiecare formulă în stare gazoasă să corespundă unui volum normal convențional în condiții normale și este clar că putem exprima astfel toate transformările de care se ocupă X., deoarece toate sunt de imaginat ca având loc în stare gazoasă; că formulele noastre sunt de acord cu realitatea nu numai la temperatura și presiunea experienței, ci și la altele - rezultă pur și simplu din aplicabilitatea relativ largă a legilor lui Boyle-Mariotte și Charles-Gay-Lussac (vezi Gaze). Când datele experimentale despre beat. greutățile unui vapor dat nu sunt de acord cu formula pe care o așteptăm, atunci de obicei căutăm o astfel de temperatură și o astfel de presiune la care se observă un astfel de acord, sau altfel lăsăm deoparte datele experimentale și scriem formule „moleculare” care nu corespund „legii” lui Avogadro; deci, în orice X. organic puteți găsi că molecula de acid acetic. are formula: C 2 H 3 O (OH), că existența a 3 atomi de hidrogen în acidul acetic, nu sub formă de reziduu apos, reiese clar din faptul că, atunci când acidul este tratat cu clor, putem înlocuiți succesiv 1/3, 2/3 și, în final, 3/3, adică tot hidrogenul este clor; între timp, nu există nicio îndoială că la o temperatură. fierbere, formula vaporilor de acid acetic corespunde îndeaproape - C 4 H 8 O 4, iar formula acidului monocloroacetic este mai apropiată de C 4 H 6 Cl 2 O 4 decât de C 2 H 3 ClO 2. Mai multe astfel de exemple ar putea fi citate, dar chiar și cel citat deja arată destul de clar că nu avem de-a face cu „legea lui Avogadro”, adică nu cu un asemenea raport numeric, care este obiectiv și care nu depinde de arbitrariul nostru, ci cu un mod de exprimare, calcul al datelor experimentale. Este posibil ca numărul real de molecule conținute într-un anumit volum al unui gaz (cu excepția cazului în care moleculele reprezintă ficțiunea noastră) să nu aibă nimic de-a face cu numărul de molecule stabilit de propoziția lui Avogadro și este de imaginat ca în volume egale a două gaze (la temperaturi și presiuni egale) este de fapt un număr complet diferit dintre ele [Deoarece legea lui Boyle și Charles - PV = RT nu este exactă din punct de vedere matematic, atunci, chiar și luând în considerare poziția lui Avogadro ca fiind strict în concordanță cu realitatea, trebuie să admitem că egalitatea matematică a moleculelor în volume egale a două gaze este posibilă numai la un anumit punct de temperatură specific și la o anumită presiune specifică (sau cu unele rapoarte specifice şi artificiale între masele de gaze şi volumele ocupate de acestea).]; Legile lui Gay-Lussac, care se regăsesc empiric și sunt complet independente de ideile noastre despre structura materiei, o astfel de presupunere nu le va afecta câtuși de puțin: vor rămâne la fel de inexplicabile precum „legea raporturilor multiple”, pe care o reprezintă pt. corpuri gazoase, este inexplicabilă. Este foarte regretabil pentru că în unele manuale X. se găsește o dovadă matematică a exactității „legii”, și mai mult, demonstrația inițiată de Maxwell („Theor y of Heat”, L., 1894, 325; „Law a lui Gay-Lussac"). „Luați în considerare”, spune el, „cazul în care două gaze sunt în echilibru termic. Am arătat deja că dacă Μ 1 și M 2 reprezintă masele moleculelor individuale ale acestor gaze, a V 1, și V 2 viteze de agitare corespunzatoare acestora, este necesar ca, conform ecuatiei (1), la echilibru termic
M 1 V 1 2 = M 2 V 2 2 .
Dacă presiunile ambelor gaze p 1 și p 2 și numărul de molecule pe unitatea de volum N 1 și N2, apoi conform ecuației (2)
p 1 = 1/3 M 1 N 1 V 1 2
R 2 = 1/3 M 2 N 2 V 2 2 ;
dacă presiunile sunt egale, atunci
M 1 N 1 V 1 2 \u003d M 2 N 2 V 2 2,
iar dacă temperaturile sunt egale, atunci
M 1 V 1 2 = M 2 V 2 2 ;
împărțind ultimele două ecuații termen cu termen, aflăm că Ν 1 = N 2(6), sau că atunci când două gaze sunt la aceeași temperatură și aceeași presiune, atunci numărul de molecule pe unitatea de volum este același pentru ambele gaze. „Se pare evident pentru scriitor că chiar și atunci când presiunile a două gaze diferite. sunt egale , care sunt la echilibru termic, expresiile pentru R 1 și R 2 nu poate fi echivalat până când nu s-a dovedit că aceasta trebuie să implice volume egale ale ambelor gaze; acest lucru este presupus de Maxwell, deoarece N 1 și N 2 se referă la ele ca „unități de volum”, dar necesitatea unei astfel de presupuneri nu poate fi considerată evidentă, deoarece presiunea gazului, odată stabilită, nu are nicio legătură cu volumul ocupat de gaz. Datorită acestei alegeri arbitrare, o problemă nedefinită în sine a căpătat o soluție definitivă. Clausius (1857) a fost mai precaut în această privință; a presupus că în volume egale de gaze există un număr egal de molecule și deja din aceasta a dedus cu ajutorul teoriei cinetice a gazelor că și forțele lor vii trebuie să fie egale. Astfel, nu putem avea o dovadă a propoziției lui Avogadro, dar este cert că odată ce vom accepta definiția sa, vom putea stabili cu ușurință greutățile relative ale moleculelor (greutățile relative ale volumelor egale de gaze); totul se rezumă la două definiții ale bătăilor. greutățile gazelor comparate și, așa cum am văzut mai sus, este complet indiferent în raport cu ce gaz sp. greutate. Avogadro a considerat molecula de hidrogen ca fiind unitatea de greutate moleculară (vezi mai sus); acum foarte adesea o astfel de unitate este considerată a fi un atom de hidrogen. Următoarea întrebare este câți atomi de hidrogen sunt în molecula sa și ce definiție a cuvântului „atom” poate fi dată, urmând terminologia lui Avogadro. Din experiență s-a constatat că în timpul interacțiunii chimice a corpurilor gazoase, adesea unul dintre ele după transformare este într-un volum mai mare decât înainte de experiment; deci, de exemplu, s-a indicat mai sus că o masă dată de oxigen sub formă de vapori de apă ocupă de două ori volumul decât aceeași masă de oxigen pur luată în aceleași condiții de temperatură și presiune; împreună cu Avogadro, exprimăm acest lucru spunând că în formarea apei molecula de oxigen este împărțită în două jumătăți absolut identice și de aceea recunoaștem că reacțiile chimice pot fi însoțite de divizarea moleculelor; experiența arată, de altfel, că această împărțire merge adesea atât de departe încât ne este inaccesibilă în orice alt mod; deci, de exemplu, dacă rămânem cu exemplul tocmai menționat, indiferent cât de ridicate am compara temperaturile vaporii de apă cu oxigenul, va exista întotdeauna de două ori mai mult oxigen într-un anumit volum de oxigen gazos decât va fi conținut într-un volum egal. de vapori de apă. Pe de altă parte, cuvântul „atom”, derivat din gr. sl. άτομος - indivizibil, ne obligă să desemnăm prin ea o astfel de masă de materie pe care să o recunoaștem ca fiind incapabilă de simplificare ulterioară prin divizare. De aici definiția modernă a unui atom: este - cea mai mică masă a unui element dat cu care acesta intră în compoziția moleculelor complexe din punct de vedere chimic, adică moleculele unor astfel de corpuri în care, pe lângă acest element, există cel puțin un alt element. Pentru a rezolva întrebarea de mai sus, este necesar, în continuare, să se determine ud-ul. greutățile hidrogenului diverșilor compuși cu hidrogen, se determină prin analiză ce proporție dintre acești sp. greutățile, exprimate în molecule de hidrogen, cad pe hidrogen și o iau pe cea mai mică pentru atomul său; conform legii Gay-Lussac, raportul dintre masa găsită și masa moleculei de hidrogen trebuie exprimat ca un întreg simplu, adică relativ mic. Puteți face altfel; se pot compara volumele de compuși gazoși cu volumul de hidrogen conținut în ei; raportul, exprimat ca cel mai mare număr întreg, ne oferă o măsură a divizibilității moleculei de hidrogen. Pentru clarificare, să luăm, ca exemple, compușii cu hidrogen: gazul de mlaștină (un compus de carbon și hidrogen), amoniacul (un compus de azot și hidrogen), apa (un compus de oxigen și hidrogen) și clorura de hidrogen (compoziția elementară este dat de numele însuși); bate greutatea hidrogenului primului = 8, adică greutatea X ei spun gaz de mlaștină: greutate X ei spun hidrogen \u003d 8, de unde se spune. gaz de mlaștină = în greutate 8 mol. hidrogen; analiza arată că ¼ din această cantitate cade pe hidrogen, apoi, mol. gazul de mlaștină este format din carbon (cu o greutate de 6 mol. hidrogen) și 2 moli. hidrogen; bate greutatea amoniacului = 8½ și 1½, greutate. unitati din această cantitate se încadrează în ponderea hidrogenului; în continuare, argumentând în modul precedent, ajungem la concluzia că 1 mol. amoniacul constă din azot (cu greutatea de 7 mol. hidrogen) și 1½ = 3/2 mol. hidrogen; compoziția moleculei de apă este oxigen (în cantitate = 8 mol. hidrogen) și 1 mol. hidrogen; în cele din urmă, ud. greutatea acidului clorhidric = 18,25, din care doar 0,5 este hidrogen; în continuare, molecula de acid clorhidric constă din clor (= 17,75 mol. hidrogen) și ½ mol. hidrogen; ultima valoare este cea mai mică dintre cele găsite de noi; în consecință, putem presupune că molecula de hidrogen este divizibilă în jumătate, iar această jumătate poate fi luată provizoriu drept „greutatea atomică” a hidrogenului. De înțeles, luarea în considerare a acestor compuși din perspectiva compoziției lor în vrac duce, de asemenea, la aceeași concluzie; cifrele date mai sus spun exact că 1 vol. gazul de mlaștină este egal cu ½ vol. hidrogenul din el, 1 vol. amoniac = 2/3 vol. hidrogen conținut în el, 1 vol. vapori de apă = 1 vol. hidrogen, disponibil în el și, în final, 1 vol. clorura de hidrogen este de două ori volumul hidrogenului din ea; cea mai mare creștere a avut loc în formarea clorurii de hidrogen și, conform lui Avogadro, trebuie să recunoaștem că molecula de hidrogen este divizibilă la jumătate. Numeroase determinări ale compoziţiei unei mari varietăţi de compuşi au arătat că nu există compuşi complecşi din punct de vedere chimic în a căror moleculă ar fi mai puţin de jumătate de moleculă de hidrogen; putem, așadar, să numim în sfârșit această cantitate atomul de hidrogen [Compară, totuși, experimentele lui J. J. Thomson.] și, notând-o cu litera h, scrie molecula de hidrogen H 2 . Pentru a găsi ud. greutatea gazului în raport cu hidrogenul, trebuie să luăm raportul dintre greutățile volumelor egale de gaz și hidrogen (la o anumită temperatură și presiune), conținând, prin definiție, un număr egal de molecule, și deci acest sp. greutatea
D \u003d (xM) / (xH 2),
Unde X- necunoscut pentru noi numărul de molecule ale ambelor gaze, M este greutatea unei molecule de gaz date și H 2 - greutatea unei molecule de hidrogen, sau în cuvinte: greutatea moleculară a unui gaz este D odată luată greutatea moleculară a hidrogenului; când îl exprimăm în atomi de hidrogen (în jumătăți dintr-o moleculă de hidrogen), atunci este egal cu 2D de ori greutatea atomică a hidrogenului. De obicei, aceasta din urmă este luată ca unitate de măsură; apoi
M=2D,
dar trebuie amintit că în această expresie D este un număr abstract și se numește 2, deoarece stă în loc de 2 atomi de hidrogen și s-a indicat deja mai devreme (a se vedea Formulele) că, în cazul în care luăm în considerare oxigen \u003d 16, atunci greutatea atomică a hidrogenului \u003d 1.008, și așa mai departe., apoi
M" \u003d 2 1.008D,
Unde M" reprezintă o formulă în care toate greutățile atomice sunt raportate la O = 16, a D bate greutatea aburului (gazului) prin hidrogen. Despre volumul moleculelor gram la H 2 = 2 și O 2 = 32 - vezi Formulele chimice. În concluzie, trebuie subliniat că, pe lângă Avogadro, au scris despre aceeași problemă: Ampère („Ann. de chim.” 90, 1814, traducere germană, în „Klassik.”, nr. 8) de Ostwald, Godin (Gandin, „Ann. chim. phys.”, 35, 1833: „Recherches sur la structure intime dos corps inorganiques d é finis etc.” volume egale de gaze în pătrate egale - un dispozitiv mnemonic pe care Hoffmann l-a introdus ulterior.], Gerard (vezi Sistemul unitar) și, mai ales, Cannizzaro (Sf. Cannizzaro, „Nuovo Cimento”, 7, 1858: „Sunto di un corso di filosofi a chimica fatto nella Reale Universita di Genova"; în germană în „Klassiker” de Ostwald, Nr. 30), care a redescoperit Avogadro. Toate obiecțiile la adresa „legii, Avogadro” nici măcar nu pot fi enumerate aici. Este suficient, ca exemplu de neînțelegeri, să indice că greutatea specifică a vaporilor de amoniac în raport cu hidrogenul sa dovedit a fi să fie egală nu cu jumătate din formulă, ci cu un sfert din aceasta, adică
NH 4 Cl / 4 \u003d NH 4 Cl / 2H 2,
de unde a rezultat că molecula de hidrogen corespunde
NH4CI/2 \u003d N/2 + H4/2 + CI/2;
întrucât în condițiile evaporării NH 4 Cl era imposibil să se permită divizarea „atomilor” de azot și clor, adică modificări ale acestor elemente, G. St. Clair Deville a considerat densitatea anormală a vaporilor de NH 4 Cl. să fie dovada inexactității „legii lui Avogadro”. S. Cannizzaro cel dintâi [Cf. E. Mitscherlich, „Ueber das Verh ältniss des spec. Gewichts de r Gasarten zu den chem. Proportionen”, „Ann. Ch. Ph.”, 12, 1834 și „Gesamm. Abhandl.”.] a indicat că dezacordul ar putea fi explicat prin dezintegrarea NH 4 Cl în NH 3 şi HCl, care ar trebui să ocupe volumul a 2 „molecule” de hidrogen. Experiența directă a lui Pebal a confirmat ulterior această considerație. Trebuie remarcat faptul că în multe cazuri de bătăi anormale. Nu există încă un studiu experimental al produselor rezultate și, prin urmare, este posibil ca interpretarea acceptată acum să se dovedească mai târziu a fi incorectă. Deci, de exemplu, o scădere cu creșterea temperaturii sp. greutatea unei perechi de acid acetic, ajungând la C 4 H 8 O 4 /2H 2, se explică de obicei prin expresia:
dar este posibilă următoarea reacție:
(anhidridă acetică) + H 2 O, etc. Toate greutățile atomice moderne sunt derivate în conformitate cu definiția lui Avogadro și, prin urmare, toate substanțele chimice moderne. eq. (în special pentru corpurile gazoase) poate servi ca ilustrații ale legilor volumetrice ale lui Gay-Lussac.
Alte legi care servesc la determinarea greutăților moleculelor, atomilor și echivalenților. Nu toți compușii și elementele sunt capabili să treacă în stare gazoasă. Suntem lipsiți de posibilitatea în astfel de cazuri de a stabili greutatea relativă a moleculei în bătăi. greutatea vaporilor (vezi Determinarea densității vaporilor) și, prin urmare, nu putem determina direct greutatea atomică (cea mai mică) cu care un anumit element face parte din moleculele acestor corpuri. Ultima valoare poate fi, totuși, stabilită indirect în astfel de cazuri, folosind unele proprietăți ale soluțiilor (vezi Soluții, Crioscopie și Ebulioskopiya) sau pe baza izomorfismului (vezi); putem stabili valoarea greutății atomice folosind legea lui Dulong și Petit sau legea periodică a lui D. I. Mendeleev (vezi Legea periodică și Greutățile atomilor); în cele din urmă, valoarea echivalentului poate fi stabilită folosind legea electrolitică a lui Faraday (vezi Electroliza și disocierea electrolitică). - Despre legile cantitative care guvernează transformările chimice, legea acțiunii masei și legea fan "t Hoff - vezi Afinitatea chimică, Echilibrul chimic, Reversibilitatea reacțiilor chimice.
Istoria dezvoltării vederilor chimice, pe lângă acest articol, a fost atinsă în mod repetat în acest Dicționar. Vezi: Alchimie, Substanță, Aer, Greutăți ale atomilor, Glicoli, Glicerină, Dualism, Substituție, Izomerie, Acizi, Metale și metaloizi, Acid lactic, Reversibilitate chimică. Reacții, Parafine, Legea periodică a elementelor chimice, Limita acizilor organici, Pseudomerism, Radicali, Sare, Stereochimie, Termochimie, Acid acetic. (structură), Sistem unitar, Flogiston, Formule chimice, Nomenclatură chimică, Structura chimică, afinitate chimică, tipuri chimice teorie, electrochimie, electroliză, disociere electrolitică, etil, teoria eterenă, teoria nucleară și biografii ale tuturor chimiștilor de seamă. Istoric informații despre elemente și compuși chimici principali - vezi articolele speciale dedicate acestora.
A. I. Gorbov. Δ.
Dicționare în limba rusă
Cunoașteți deja simbolurile unor elemente chimice.
Ce arată simbolul chimic?
1) Indică un element chimic (dați un nume);
2) un atom al acestui element;
3) prin simbol, puteți determina locul elementului în sistem periodic DI. Mendeleev;
4) sistemul periodic poate fi folosit pentru a determina masa atomică relativă a unui element.
Să luăm un exemplu.
Simbol element chimic - Cu
1) Elementul chimic este cuprul.
2) un atom de cupru;
3) Cuprul este în sistemul periodic de elemente din perioada 4, grupa 1, număr de serie - 29.
4) Ar(Cu)=64
Să rezumăm informațiile cunoscute de noi, care conțin o formulă chimică.
Masa. Informații conținute într-o formulă chimică.
Exemplu: HNO3 - acid azotic
| 1. Compoziția calitativă | 1. O moleculă este formată din atomi a trei elemente chimice: H, N, O |
| 2. Compoziția cantitativă | 2. Molecula este formată din cinci atomi: un atom de hidrogen, un atom de azot, trei atomi de oxigen |
| 3. Greutatea moleculară relativă | 3.Mr(HNO3)= 1 1+14 1+16 3=63 |
| 4. Masa moleculei | 4. mm(HNO3)= 1a.u.m. 1+ 14 amu 1+ 16 amu 3=63 amu |
| 5. Fracții de masă ale elementelor | 5.ω(H) = Ar(H) 1 / Mr(HNO3)= 1 1/63=0,016 sau 1,6% ω(N)= Ar(N)1 /Mr(HNO3)= ω(O)= Ar(O)3 /Mr(HNO3)= |
Efectuați aceeași sarcină în registru de lucru
Rezumând
Felicitări, ai trecut testul până la capăt!
Acum faceți clic pe butonul Trimiteți testul pentru a vă salva permanent răspunsurile și a obține o notă.
Atenţie! După ce faceți clic pe butonul, nu veți putea face modificări.
Chimia, ca orice știință, necesită precizie. Sistemul de reprezentare a datelor în acest domeniu de cunoaștere a fost dezvoltat de secole, iar standardul actual este o structură optimizată care conține toate informațiile necesare pentru continuarea lucrărilor teoretice cu fiecare element specific.
Când scrieți formule și ecuații, este extrem de incomod să folosiți numere întregi, iar astăzi sunt folosite una sau două litere în acest scop - simbolurile chimice ale elementelor.
Poveste
În lumea antică, precum și în Evul Mediu, oamenii de știință foloseau imagini simbolice pentru a desemna diferite elemente, dar aceste semne nu erau standardizate. Numai să secolul al XIII-lea se încearcă sistematizarea simbolurilor substanțelor și elementelor, iar din secolul al XV-lea, metalele nou descoperite au început să fie desemnate prin primele litere ale numelui lor. O strategie similară de denumire este folosită în chimie până în prezent.
Starea actuală a sistemului de denumire
Până în prezent, sunt cunoscute peste o sută douăzeci de elemente chimice, dintre care unele sunt extrem de problematice de găsit în natură. Nu este de mirare că, chiar și la mijlocul secolului al XIX-lea, știința știa despre existența a doar 63 dintre ele și nu exista nici un singur sistem de denumire, nici un sistem integral de prezentare a datelor chimice.
Ultima problemă a fost rezolvată în a doua jumătate a aceluiași secol de omul de știință rus D. I. Mendeleev, bazându-se pe încercările nereușite ale predecesorilor săi. Procesul de denumire continuă și astăzi - există mai multe elemente cu numere de la 119 și mai sus, indicate în mod convențional în tabel prin abrevierea latină a numărului lor de serie. Pronunțarea simbolurilor elementelor chimice din această categorie se efectuează conform regulilor latine pentru citirea numerelor: 119 - ununenny (lit. „o sută nouăsprezece”), 120 - unbinilium („o sută douăzeci”) și așadar pe.
Majoritatea elementelor au nume proprii, derivate din rădăcinile latină, greacă, arabă, germană, în unele cazuri reflectând caracteristicile obiective ale substanțelor, iar în altele acționând ca simboluri nemotivate.
Etimologia unor elemente
După cum sa menționat mai sus, unele nume și simboluri ale elementelor chimice se bazează pe caracteristici observabile în mod obiectiv.
Numele de fosfor, care strălucește în întuneric, provine din sintagma greacă „aduce lumină”. Când sunt traduse în rusă, se găsesc destul de multe nume „vorbitoare”: clor - „verzui”, brom - „miros urât”, rubidiu - „roșu închis”, indiu - „culoare indigo”. Deoarece simbolurile chimice ale elementelor sunt date cu litere latine, legătura directă a numelui cu substanța pentru un vorbitor de rusă trece de obicei neobservată.
Există, de asemenea, asociații de denumire mai subtile. Deci, numele de seleniu provine din cuvântul grecesc care înseamnă „Lună”. Acest lucru s-a întâmplat pentru că în natură acest element este un satelit de telur, al cărui nume în aceeași greacă înseamnă „Pământ”.

Niobiul este numit în mod similar. Conform mitologiei grecești, Niobe este fiica lui Tantalus. Elementul chimic tantal a fost descoperit mai devreme și este similar în proprietăți cu niobiul - astfel, legătura logică „tată-fiică” a fost proiectată pe „relația” elementelor chimice.
Mai mult, tantalul și-a primit numele în onoarea celebrului personaj mitologic nu întâmplător. Faptul este că obținerea acestui element în forma sa pură a fost plină de mari dificultăți, din cauza cărora oamenii de știință au apelat la unitatea frazeologică „făină de tantal”.
Un alt fapt istoric curios este că numele de platină se traduce literalmente prin „argint”, adică ceva similar, dar nu la fel de valoros ca argintul. Motivul este că acest metal se topește mult mai greu decât argintul și, prin urmare, pentru o lungă perioadă de timp nu a fost folosit și nu a avut o valoare deosebită.
Principiul general al denumirii elementelor
Când vă uitați la tabelul periodic, primul lucru care vă atrage atenția sunt numele și simbolurile elementelor chimice. Este întotdeauna una sau două litere latine, dintre care prima este majusculă. Alegerea literelor se datorează numelui latin al elementului. În ciuda faptului că rădăcinile cuvintelor provin din greaca veche și din latină și din alte limbi, conform standardului de denumire, li se adaugă terminații latine.
Este interesant că majoritatea personajelor vor fi ușor de înțeles pentru un vorbitor nativ rus: un student își amintește cu ușurință de aluminiu, zinc, calciu sau magneziu de la prima dată. Situația este mai complicată cu acele nume care diferă în versiunile rusă și latină. Este posibil ca elevul să nu-și amintească imediat că siliciul este siliciu, iar mercurul este hidrargyrum. Cu toate acestea, va trebui să rețineți acest lucru - reprezentarea grafică a fiecărui element este concentrată pe numele latin al substanței, care va apărea în formule și reacții chimice ca Si și, respectiv, Hg.

Pentru a reține astfel de nume, este util ca elevii să efectueze exerciții de genul: „Faceți o corespondență între simbolul unui element chimic și numele acestuia”.
Alte moduri de a numi
Numele unor elemente provin din limba arabă și au fost „stilizate” în latină. De exemplu, sodiul își ia numele de la o tulpină de rădăcină care înseamnă „substanță care barbote”. Rădăcinile arabe pot fi urmărite și la numele de potasiu și zirconiu.

A influențat și limba germana. De la el provin denumirile unor elemente precum mangan, cobalt, nichel, zinc, wolfram. Legătura logică nu este întotdeauna evidentă: de exemplu, nichelul este o abreviere pentru cuvântul care înseamnă „diavolul de cupru”.
În cazuri rare, denumirile au fost traduse în rusă sub formă de hârtie de calc: hidrogeniul (literal „da naștere apei”) transformat în hidrogen, iar carboneul în carbon.
Nume și toponime
Peste o duzină de elemente poartă numele diverșilor oameni de știință, printre care Albert Einstein, Dmitri Mendeleev, Enrico Fermi, Ernest Rutherford, Niels Bohr, Marie Curie și alții.
Unele nume provin din alte nume proprii: numele de orașe, state, țări. De exemplu: moscovium, dubnium, europium, tennessine. Nu toate toponimele vor părea familiare unui vorbitor nativ al limbii ruse: este puțin probabil ca o persoană fără pregătire culturală să recunoască numele de sine al Japoniei în cuvântul nihonium - Nihon (literal: Țară soarele răsare), iar în hafnium, versiunea latină a Copenhaga. A afla chiar și numele țării tale natale în cuvântul ruteniu nu este o sarcină ușoară. Cu toate acestea, Rusia în latină se numește Rutenia și, în onoarea ei, este numit al 44-lea element chimic.

În tabelul periodic apar și numele corpurilor cosmice: planetele Uranus, Neptun, Pluto, Ceres Pe lângă denumirile personajelor mitologiei antice grecești (tantal, niobiu), există și cele scandinave: toriu, vanadiu.
Tabelul periodic
În tabelul periodic cunoscut astăzi, care poartă numele lui Dmitri Ivanovici Mendeleev, elementele sunt prezentate în serii și perioade. În fiecare celulă, un element chimic este indicat printr-un simbol chimic, alături de care sunt prezentate alte date: numele complet, numărul de serie, distribuția electronilor pe straturi, masa atomică relativă. Fiecare celulă are propria sa culoare, care depinde dacă elementul s-, p-, d- sau f- este evidențiat.
Principii de înregistrare
Când scrieți izotopi și izobare, în partea din stânga sus a simbolului elementului este plasat un număr de masă - numărul total de protoni și neutroni din nucleu. În acest caz, numărul atomic este plasat în stânga jos, care este numărul de protoni.

Sarcina ionului este scrisă în dreapta sus, iar numărul de atomi este indicat pe aceeași parte mai jos. Simbolurile pentru elementele chimice încep întotdeauna cu o literă mare.
Opțiuni naționale de ortografie
Regiunea Asia-Pacific are propriile ortografii ale simbolurilor elementelor chimice, bazate pe metodele locale de scriere. Sistemul de notație chinezesc folosește semne radicale urmate de caractere în sensul lor fonetic. Simbolurile metalelor sunt precedate de semnul „metal” sau „aur”, gazele – de radicalul „abur”, nemetale – de hieroglifa „piatră”.
LA tari europene există şi situaţii când semnele elementelor în timpul înregistrării diferă de cele înregistrate în tabelele internaţionale. De exemplu, în Franța, azotul, wolframul și beriliul au propriile nume în limba națională și sunt notate prin simbolurile corespunzătoare.
In cele din urma
Studiind la școală sau chiar mai sus instituție educațională memorează conținutul întregului tabelul periodic deloc necesar. În memorie, ar trebui să păstrați simbolurile chimice ale elementelor care se găsesc cel mai des în formule și ecuații și să vă uitați la cele puțin utilizate din când în când pe internet sau într-un manual.

Cu toate acestea, pentru a evita erorile și confuziile, este necesar să știți cum sunt structurate datele în tabel, în ce sursă să găsiți datele necesare și să vă amintiți clar ce nume de elemente diferă în versiunile rusă și latină. În caz contrar, puteți confunda accidental Mg cu mangan și N cu sodiu.
Pentru a face antrenament stadiul inițial faceți exercițiile. De exemplu, specificați simbolurile pentru elemente chimice pentru o secvență de nume selectată aleatoriu din tabelul periodic. Pe măsură ce dobândiți experiență, totul va cădea la locul lor și problema amintirii acestor informații de bază va dispărea de la sine.