Funcția principală a reticulului endoplasmatic neted. Organele de importanță generală. Reticulul endoplasmatic
Închiderea se referă la conexiune strânsă(zona de inchidere - zonu-la occuludens). Această conexiune implică proteine integrale speciale situate pe suprafața celulelor învecinate, formând o aparență de rețea de plasă (Fig. 4.6).
Această rețea celulară înconjoară întregul perimetru al celulei sub forma unei centuri, conectându-se cu aceeași rețea pe suprafața celulelor învecinate. Această zonă este impenetrabilă pentru macromolecule și ioni și, prin urmare, se închide, delimitează golurile intercelulare (și, împreună cu acestea, mediul intern al organismului) de mediul extern. Acest tip de conexiuni este tipic pentru celulele epiteliului cu un singur strat și endoteliul unor vase.
Conexiunile de aderență sau ancorare includ bandă adezivă(breaua de aderenta) si desmozom. Comun acestui grup de compuși este faptul că elementele fibrilare ale citoscheletului (filamente de actină,
Orez. 4.6. Conexiune strânsă (zona de închidere):
dar- localizarea joncțiunii strânse (placă de inserție) pe celulele epiteliului intestinal; b - diagrama tridimensională a unei zone dense de îmbinare. 1 - microvilozități
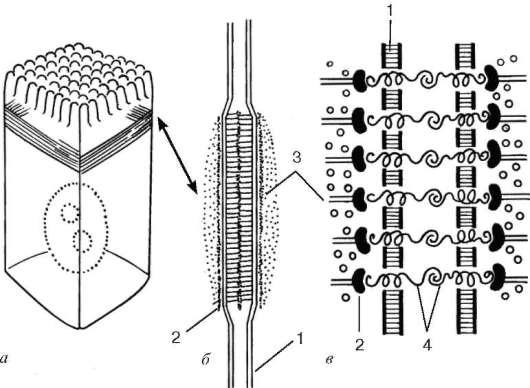
Orez. 4.7. Banda adeziva (banda de aderenta):
dar- amplasarea acestuia în celulă; b- vedere în sectiune; în- schema de organizare moleculară. 1 - plasmalema; 2 - strat de proteine de adeziune; 3 - microfilamente de actină; 4 - glicoproteine de legare
filamentele intermediare și spectrina) și se leagă de membrane la joncțiunea celulelor învecinate.
banda adeziva, sau centură aglomerată (zonula adherens),- o formațiune pereche sub formă de panglici, fiecare din care înconjoară părțile apicale ale celulelor învecinate și asigură aderența lor între ele în această zonă (Fig. 4.7). Aici, celulele sunt conectate între ele prin glicoproteine integrale, la care, din partea citoplasmei ambelor celule, se învecinează un strat de proteine membranare, inclusiv proteina caracteristică vinculină. Un mănunchi de microfilamente de actină se apropie de acest strat și se leagă de el. Interacțiunea microfilamentelor de actină cu proteinele care leagă actina din multe celule învecinate poate duce la o modificare a reliefului întregului strat epitelial.
Conexiunile adezive pot include contact focal, caracteristice fibroblastelor. În acest caz, celula nu se conectează cu o celulă vecină, ci cu elemente ale substratului extracelular. Microfilamentele de actină participă și ele la formarea contactului focal. Joncțiunile intercelulare adezive includ desmozomi(Fig. 4.8).
desmozom, sau punct de adeziune (macula adherens). Acestea sunt structuri pereche, care sunt o zonă mică sau un punct cu un diametru de aproximativ 0,5 μm. Din partea citoplasmei, un strat de proteine, care include desmoplakine, este adiacent membranei plasmatice. Mănunchiuri de filamente intermediare sunt introduse în acest strat din partea laterală a citoplasmei. Pe partea exterioară a plasmolemei celulelor vecine din regiunea desmozomilor sunt conectate
![]()
Orez. 4.8. Desmosom:
dar- amplasarea in cusca; b- schema ultrastructurii. 1 - plasmalema; 2 - stratul desmo-gley; 3 - strat de desmoplakin; 4 - filamente intermediare. D - desmozom; PD - hemidesmozom
cu ajutorul proteinelor transmembranare – desmogleine. De exemplu, fiecare celulă a epidermei pielii poate avea până la câteva sute de desmozomi.
Rolul funcțional al desmozomilor este în principal în legătura mecanică dintre celule. Desmozomii leagă celulele între ele în diferite epitelii, în mușchii cardiaci și netezi. Hemidesmozomi leagă celulele epiteliale de membrana bazală.
Conexiunile de comunicare în celulele animale sunt reprezentate de joncțiuni gap și sinapse(Fig. 4.9).
conexiune întreruptă, sau nexus (nexus), reprezintă o regiune cu lungimea de 0,5-3 microni, unde membranele plasmatice sunt separate printr-un interval de 2-3 nm (vezi Fig. 4.9). Din partea citoplasmei, nu se găsesc structuri speciale legate de membrană în această zonă, dar în structura plasmolemelor celulelor învecinate, complexe proteice speciale (conexiuni) sunt situate unul față de celălalt, care formează canale de la o celulă la alta. . Acest tip de conexiune se găsește în toate grupele de țesuturi.
Rolul funcțional al joncțiunii gap este transferul de ioni și molecule mici (greutate moleculară 2 × 103) de la celulă la celulă. Deci, în mușchiul inimii, excitația, care se bazează pe procesul de modificare a permeabilității ionilor, este transmisă de la celulă la celulă prin nexusuri.
Conexiuni sinaptice sau sinapse (synapsis). Acest tip de conexiuni este caracteristic țesutului nervos și apare în zone specializate de contact atât între doi neuroni, cât și între un neuron și un alt element care face parte dintr-un receptor sau efector (de exemplu, sinapsele neuromusculare, neuroepiteliale).
Sinapsele sunt zone de contact între două celule specializate pentru transmiterea într-un singur sens a excitației sau inhibiției de la un element la altul (vezi capitolul 10).
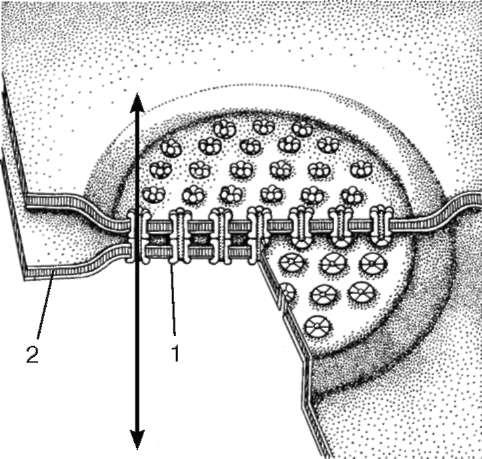
Orez. 4.9. Conexiune cu fante (comunicare):
1 - conexon; 2 - plasmalema
sistemul vacuolar
Reticulul endoplasmatic
Reticulul endoplasmatic (reticulul endoplasmatic) a fost descoperit de K. R. Porter în 1945. Această componentă a sistemului vacuolar celular este o colecție de vacuole, saci cu membrană plate sau formațiuni tubulare care creează o rețea membranară tridimensională. Rețeaua include granulară și agranulară secțiuni care pot fi intercalate.
Granular reticulul endoplasmatic(reticul endoplasmicum granulosum) pe secțiuni ultrasubțiri este reprezentată de membrane închise, care formează pungi turtite, cisterne, tuburi pe secțiuni.
Diametrul cisternelor variază semnificativ și, în funcție de activitatea funcțională a celulei, variază de la 20 nm la câțiva micrometri. O trăsătură distinctivă a membranelor reticulului endoplasmatic granular este aceea că sunt acoperite cu numeroși ribozomi din partea hialoplasmei (Fig. 4.10).
Reticulul endoplasmatic granular are o structură diferită. Pentru celulele nespecializate sau pentru celulele cu activitate metabolică scăzută este caracteristică prezența cisternelor rare și împrăștiate. Dacă există acumulări locale ale reticulului endoplasmatic granular, atunci aceasta indică o sinteză activă a proteinelor secretoare. Deci, în celulele hepatice și unele celule nervoase, reticulul endoplasmatic granular este asamblat în zone separate. În celulele pancreasului, reticulul endoplasmatic granular sub formă de cisterne membranare strâns strâns unul lângă celălalt ocupă zonele bazale și perinucleare ale celulei. Ribozomii asociați cu membranele reticulului endoplasmatic sunt implicați în sinteza proteinelor care sunt excretate dintr-o anumită celulă (proteinele „exportate”). În plus, reticulul endoplasmatic granular este implicat în sinteza proteinelor - enzime necesare organizării metabolismului intracelular și, de asemenea, utilizate pentru digestia intracelulară.
Proteinele care se acumulează în cavitățile reticulului endoplasmatic pot, ocolind hialoplasma, să fie transportate în vacuolele complexului Golgi, unde sunt modificate și fac parte fie din lizozomi, fie din granulele secretoare, al căror conținut rămâne izolat de hialoplasmă prin membrana. În interiorul tubilor sau vacuolelor endoplasmatice granulare
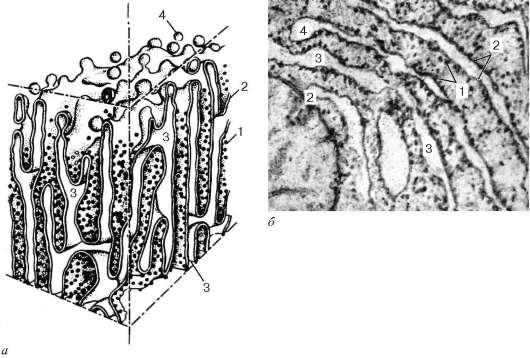
Orez. 4.10. Structura reticulului endoplasmatic granular: dar - sistem; b- micrografie electronică a unei secțiuni a unei celule epiteliale hepatice. 1 - ribozomi; 2 - farfurii; 3 - cavitățile interne ale rezervoarelor; 4 - desprinderea veziculelor membranare lipsite de ribozomi
de rețea, proteinele sunt modificate, de exemplu, prin legarea lor de zaharuri (glucozilare primară).
În reticulul endoplasmatic granular, pe ribozomii săi, se sintetizează proteine integrale membranare, care sunt înglobate în grosimea membranei. Aici, din partea hialoplasmei, are loc sinteza lipidelor și încorporarea lor în membrană. Ca rezultat al acestor două procese, membranele reticulului endoplasmatic și alte componente ale sistemului vacuolar al celulei cresc.
Deci, rolul reticulului endoplasmatic granular constă în sinteza proteinelor exportate pe ribozomii săi, în izolarea acestora de conținutul hialoplasmei din interiorul cavităților membranei, în transportul acestor proteine în alte părți ale celulei, în substanța chimică. modificarea unor astfel de proteine și în condensarea lor locală, precum și în sinteza componentelor structurale ale membranelor celulare.
reticul endoplasmatic agranular (neted) (reticul endoplasmaticum nongranulosum) reprezentata si de membrane care formeaza mici vacuole, tuburi, tubuli, care se pot ramifica, se contopesc intre ele. Spre deosebire de ER granular, nu există ribozomi pe membranele ER netede. Diametrul vacuolelor și tubilor reticulului endoplasmatic neted este de obicei de aproximativ 50-100 nm. Reticulul endoplasmatic neted apare și se dezvoltă pe baza reticulului endoplasmatic granular. În unele zone ale reticulului endoplasmatic granular se formează noi zone membranare lipoproteice, lipsite de ribozomi. Aceste zone pot crește, se pot separa de membranele granulare și pot funcționa ca un sistem vacuolar independent.
Activitatea reticulului endoplasmatic neted este asociată cu metabolismul lipidelor și a unor polizaharide intracelulare. Reticulul endoplasmatic neted este implicat în etapele finale ale sintezei lipidelor. Este foarte dezvoltat în celulele secretoare de steroizi, de exemplu, în celulele endocrine ale cortexului suprarenal, în celulele epiteliale ale tubilor seminiferi contorți.
Legătura topografică strânsă a reticulului endoplasmatic neted cu depozitele de glicogen (polizaharidă intracelulară de rezervă a animalelor) în hialoplasma diferitelor celule (celule hepatice, fibre musculare) indică posibila sa participare la metabolismul carbohidraților.
În fibrele musculare striate, reticulul endoplasmatic neted este capabil să depună ioni de calciu necesari pentru funcționarea țesutului muscular (vezi capitolul 9).
Rolul reticulului endoplasmatic neted în dezactivarea diferitelor substanțe dăunătoare organismului datorită oxidării lor cu ajutorul unui număr de enzime speciale este foarte important. Mai ales clar se manifestă în celulele ficatului. Deci, cu unele otrăviri, în celulele hepatice apar zone acidofile (nu conțin ARN), complet umplute cu un reticul endoplasmatic neted.
Complexul Golgi
Complexul Golgi (complex lamelar) a fost descoperit în 1898 de K. Golgi. Autorul, folosind proprietățile legării metalelor grele (osmiu sau argint) cu structurile celulare, a dezvăluit formațiuni de plasă în celulele nervoase, pe care le-a numit aparat de plasă internă. (aparatul reticular intern). Mai târziu s-a numit aparat, sau Complexul Golgi (complexul Golgiensis). Structuri similare au fost apoi descrise în toate celulele eucariote.
Când este privit la microscop electronic, complexul Golgi este reprezentat de structuri membranare asamblate împreună în zone mici.
Se numește o zonă separată de acumulare a acestor membrane dictiozom (stiva Golgi).Într-o celulă pot exista mai multe astfel de zone. Aproape unul de celălalt (la o distanță de 20-25 nm) sunt 5-10 plate cisterne,între care se află straturi subțiri de hialoplasmă. Fiecare rezervor are o grosime variabilă: în centrul membranelor sale pot fi reunite (până la 25 nm), iar la periferie pot avea prelungiri - fiole, a căror lățime nu este constantă. Pe lângă cisternele plate distanțate dens, în zona complexului Golgi sunt observate multe bule mici. (veziculă), care se găsesc mai ales în zonele sale periferice. Uneori sunt dantelate din prelungiri ampulare la marginile cisternelor plate. În zona dictiozomului, cea proximală (cis)și distal (trans) suprafete. În celulele secretoare, complexul Golgi este de obicei polarizat: suprafața sa proximală este orientată spre nucleu, în timp ce cea distală este orientată spre suprafața celulei.
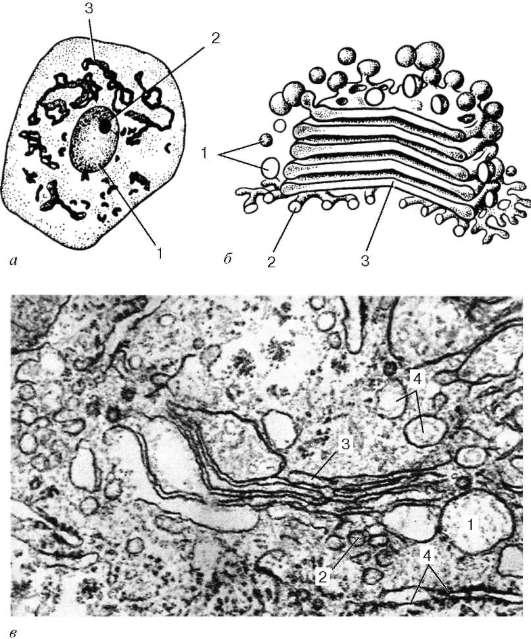
Orez. 4.11. Complexul Golgi:
dar - celula nervoasa măduva spinării, impregnare cu argint după metoda Golgi: 1 - miez; 2 - nucleol; 3 - complexul Golgi; b- schema structurii ultramicroscopice (reconstructie tridimensionala); în- complex Golgi pe o secțiune ultrasubțire (celula hepatică): 1 - vezicule; 2 - tubuli; 3 - pungi turtite (rezervoare); 4 - fragmente ale reticulului endoplasmatic granular
În celule, dictiozomii individuali pot fi conectați între ei printr-un sistem de vezicule și cisterne adiacente suprafeței distale, astfel încât se formează o rețea tridimensională liberă, care este detectată în microscoapele luminoase și electronice („rețeaua trans” de complexul Golgi).
Complexul Golgi este implicat în segregarea și acumularea produselor sintetizate în reticulul endoplasmatic, în rearanjarea chimică, maturarea acestora; în rezervoarele sale, polizaharidele sunt sintetizate și complexate cu proteine, ceea ce duce la formarea peptidoglicanilor. Cu ajutorul complexului Golgi, se realizează procesul de îndepărtare a secretelor gata făcute în afara celulei secretoare. În plus, complexul
Orez. 4.12. Participarea structurilor celulare la secreția proteică (schemă): 1 - alimentarea cu aminoacizi din hemocapilar către ribozomii reticulului endoplasmatic granular; 2 - sinteza si segregarea proteinelor; 3 - tranziția proteinelor în vacuolele complexului Golgi; 4 - clivaj din complexul Golgi al veziculelor cu produse secretoare; 5 - eliberarea secretului din celulă
Golgi asigură formarea lizozomilor. Membranele complexului sunt formate prin scindarea unor mici vacuole din reticulul endoplasmatic granular. Aceste vacuole intră în complexul Golgi proximal, unde se contopesc cu membranele acestuia. În consecință, noi porțiuni de membrane și produse sintetizate în reticulul endoplasmatic granular intră în complexul Golgi. În cisternele membranare ale complexului Golgi apar modificări secundare în structura proteinelor sintetizate în reticulul endoplasmatic granular. Aceste modificări (modificări) sunt asociate cu rearanjarea lanțurilor de oligozaharide ale glicoproteinelor sintetizate. În interiorul cavităților complexului Golgi, cu ajutorul diferitelor enzime (trans-glucozidaze), proteinele lizozomale și proteinele de secreție sunt modificate în diferite moduri: au loc înlocuirea secvențială și creșterea lanțurilor de oligozaharide. Proteinele modificatoare trec de la cisterna suprafeței cis proximale la cisterna suprafeței distale prin transferul în cursă de releu a vacuolelor mici care conțin proteina transportată.
În cisterne distale (trans) La suprafață, proteinele sunt sortate: pe suprafețele interioare ale membranelor rezervoarelor există receptori care recunosc fie proteine secretoare, fie proteine care alcătuiesc lizozomii (hidrolaze). Ca urmare, două tipuri de vacuole mici se desprind din cisternele suprafeței distale a dictiozomilor: a) care conțin hidrolaze - lizozomi (primare); b) proteine secretoare.
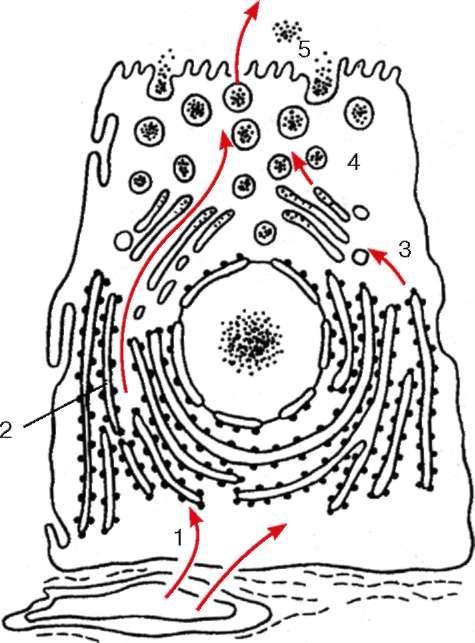
Funcția secretorie a complexului Golgi este aceea că proteina sintetizată pe ribozomi, care se acumulează în interiorul cisternelor reticulului endoplasmatic, este transportată mai departe în vacuolele complexului Golgi (Fig. 4.12).
Apoi proteina acumulată se poate condensa, formând produse proteice secretoare (cum se observă, de exemplu, în pancreas, glande mamare și alte glande). Din prelungiri ampulare ale rezervoarelor complexului
sa Golgi a desprins veziculele care conțin aceste proteine. În viitor, ele pot fuziona între ele și endozomii și pot crește în dimensiune, formându-se granule secretoare. După aceea, granulele secretoare încep să se deplaseze spre suprafața celulei, vin în contact cu membrana plasmatică, cu care se contopesc propriile membrane și astfel conținutul granulelor se află în afara celulei. Din punct de vedere morfologic, acest proces se numește extrudare (ejecție, exocitoză) și seamănă cu pinocitoza doar cu succesiunea inversă a etapelor.
Trebuie remarcat faptul că din momentul formării și până la excreția din celule, produsele secretate sunt separate printr-o membrană de hialoplasmă. Prin urmare, membranele complexului Golgi îndeplinesc un rol segregator în formarea secrețiilor celulare. În vacuolele complexului Golgi, uneori are loc o acumulare de molecule de lipide resintetizate și formarea de proteine complexe - lipoproteine, care pot fi transportate de vacuole în afara celulei. Vacuolele complexului Golgi dau naștere la lizozomi.
Lizozomi
Lizozomi (lizozomi)- aceasta este o clasă diversă de vacuole cu dimensiunea de 0,2-0,4 microni, limitate de o singură membrană. trăsătură caracteristică lizozomii este prezența în ei a enzimelor hidrolitice - hidrolaze (proteinaze, nucleaze, fosfataze, lipaze etc.), care descompun diversi biopolimeri la o valoare a pH-ului acid. Lizozomii au fost descoperiți în 1949 de de Duve.
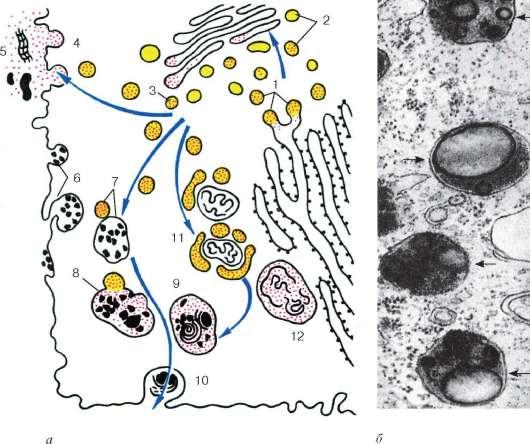
Pe lângă lizozomii înșiși (primari), se disting autofagolizozomii sau heterolizozomii (lizozomii secundari) și telolizozomii (corpii reziduali) (Fig. 4.13).
Diversitatea morfologiei lizozomilor se explică prin faptul că aceste particule sunt implicate în procesele de digestie intracelulară, formând vacuole digestive complexe de origine atât exogenă (extracelulară), cât și endogenă (intracelulară).
Lizozomi (primari) sunt mici vezicule membranare de aproximativ 0,2-0,5 microni, umplute cu o substanță fără structură care conține hidrolaze, inclusiv fosfatază acidă activă, care este o enzimă marker pentru lizozomi. Aceste vezicule mici sunt practic foarte greu de distins de veziculele mici de la periferia zonei Golgi, care conțin și fosfatază acidă. Locul sintezei sale este reticulul endoplasmatic granular. Apoi, această enzimă apare în cisternele suprafeței proximale a dictiozomului și apoi în vezicule mici de-a lungul periferiei dictiozomului și, în final, în lizozomi. Astfel, întreaga cale de formare a lizozomului este foarte asemănătoare cu formarea granulelor secretoare (zimogene) în celulele pancreatice, cu excepția ultimei etape.
heterofagolizozomi (lizozomi secundari) sau vacuole digestive intracelulare, sunt formate prin fuziunea lizozomilor cu vacuole fagocitare sau pinocitare. Dacă are loc fuziunea lizozomului
Orez. 4.13. Structura lizozomilor:
dar - schema de participare a structurilor celulare la formarea lizozomilor și la digestia intracelulară: 1 - formarea de vezicule mici care conțin enzime hidrolitice din reticulul endoplasmatic granular; 2 - transferul enzimelor în complexul Golgi; 3 - formarea lizozomilor primari; 4 - izolarea și utilizarea (5) hidrolazelor în clivaj extracelular; 6 - vezicule endocitare; 7 - fuziunea lizozomilor primari și veziculelor endocitare; 8 - formarea lizozomilor secundari; 9 - telolizozomi; 10 - excreția corpurilor reziduale; 11 - fuziunea lizozomilor primari cu structurile celulare în colaps; 12 - autofagolizozom; b - Micrografie electronică a unei secțiuni de heterofagolizozomi (indicată prin săgeți)
cu organele modificate ale celulei în sine, atunci se numește o astfel de structură autofagolizozom.În acest caz, enzimele lizozomilor au acces la substraturi, pe care încep să le descompună. Substanțele care au intrat în compoziția hetero sau autofagolizozomilor (lizozomi secundari) sunt scindate de hidrolaze la monomeri, care sunt transportați prin membrana lizozomului la hialoplasmă, unde sunt reutilizate, adică sunt incluse în diferite procese metabolice.
Cu toate acestea, scindarea și digestia macromoleculelor de către lizozom pot să nu se finalizeze într-un număr de celule. În acest caz, în vacuolele lizozomilor se acumulează
alimente nedigerate. Acest organel se numește corp lizozom, sau corp rezidual (corpusculum residuale). Corpurile reziduale conțin mai puține enzime hidrolitice, conțin compactarea conținutului, restructurarea acestuia. Adesea în corpurile reziduale se observă structurarea secundară a lipidelor nedigerabile, care formează structuri stratificate. Acolo se depun si pigmenti. De exemplu, la om, în timpul îmbătrânirii, în celulele creierului, ficatului și fibrelor musculare din telolizozomi, există o depunere de „pigment de îmbătrânire” - lipofuscină.
Cu participarea lizozomilor (autofagolizozomi), poate avea loc modificarea produselor sintetizate de celula însăși. Astfel, cu ajutorul enzimelor lizozomale, tiroglobulina este hidrolizată în celulele glandei tiroide, ceea ce duce la formarea hormonilor tiroidieni, care sunt apoi excretați în sânge prin exocitoză.
ÎN autofagolizozomi Se găsesc fragmente sau chiar structuri citoplasmatice întregi, precum mitocondriile, elemente ale reticulului endoplasmatic, ribozomi, granule de glicogen și altele, ceea ce este dovada rolului lor decisiv în procesele de digestie intracelulară.
Semnificația funcțională a autofagocitozei este încă neclară. Există o presupunere că acest proces este asociat cu selecția și distrugerea componentelor celulare alterate, deteriorate. În acest caz, lizozomii joacă rolul de „curățători” intracelulari care îndepărtează structurile defecte. Interesant, în condiții normale, numărul de autofagolizozomi crește sub stres metabolic, de exemplu, în timpul inducerii hormonale a activității celulelor hepatice. Numărul de autofagolizozomi crește semnificativ cu diferite leziuni celulare; în acest caz, zone întregi din interiorul celulelor pot suferi autofagocitoză.
O creștere a numărului de autofagolizozomi în celule în timpul proceselor patologice este un fenomen comun.
Peroxizomii
Peroxizomi (peroxisomae)în celulele țesutului uman, acestea sunt corpuri mici (0,3-1,5 μm în dimensiune) de formă ovală, limitate de o membrană, care conțin o matrice granulară, în centrul căreia sunt adesea structuri cristaline formate din fibrile și tuburi (miez). vizibil. Peroxizomii sunt caracteristici în special celulelor hepatice și renale. În fracția peroxizomală se găsesc enzime de oxidare a aminoacizilor, în timpul cărora se formează peroxid de hidrogen și se detectează și enzima catalaza, care o distruge. Catalaza peroxizomului joacă un rol protector important, deoarece H 2 O 2 este o substanță toxică pentru celulă.
Astfel, organele celulare cu o singură membrană care alcătuiesc sistemul vacuolar asigură sinteza și transportul biopolimerilor intracelulari, produse de secreție excretate din celulă, care este însoțită de biosinteza tuturor membranelor acestui sistem. Lizozomii și peroxizomii sunt implicați în degradarea substraturilor celulare exogene și endogene.
Mitocondriile
Mitocondriile (mitocondriale)- sistemul energetic al celulei, organitele sintezei ATP. Funcția lor principală este asociată cu oxidarea compușilor organici și utilizarea energiei eliberate în timpul dezintegrarii acestor compuși pentru sinteza moleculelor de ATP. Pe baza acestui fapt, mitocondriile sunt adesea numite stațiile energetice ale celulei sau organelele respirației celulare.
Termenul „mitocondrii” a fost introdus de Benda în 1897 pentru a desemna structurile granulare și filamentoase din citoplasma diferitelor celule. Mitocondriile pot fi observate în celulele vii, deoarece au o densitate destul de mare. Forma și dimensiunea mitocondriilor celulelor animale sunt variate, dar în medie grosimea lor este de aproximativ 0,5 microni, iar lungimea lor este de la 1 la 10 microni. Calculele arată că numărul lor în celule variază foarte mult - de la elemente individuale la sute. Deci, în celula hepatică, ele reprezintă mai mult de 20% din volumul total al citoplasmei și conțin aproximativ 30-35% din cantitatea totală de proteine din celulă. Suprafața tuturor mitocondriilor celulei hepatice este de 4-5 ori mai mare decât suprafața membranei plasmatice.
În multe cazuri, mitocondriile individuale pot avea dimensiuni gigantice și reprezintă o rețea extinsă - reticulul mitocondrial. De exemplu, în mușchii scheletici, reticulul mitocondrial este reprezentat de multe cordoane mitocondriale ramificate și gigantice. Mitocondriile ramificate gigantice se găsesc în celulele nefronilor proximali etc.
Mitocondriile se acumulează de obicei în apropierea acelor părți ale citoplasmei unde este nevoie de ATP. Deci, în mușchiul inimii, mitocondriile sunt situate în apropierea miofibrilelor. La spermatozoizi, mitocondriile formează o carcasă spirală în jurul axei flagelului etc. O creștere a numărului de mitocondrii din celule are loc prin diviziunea sau înmugurirea mitocondriilor originale.
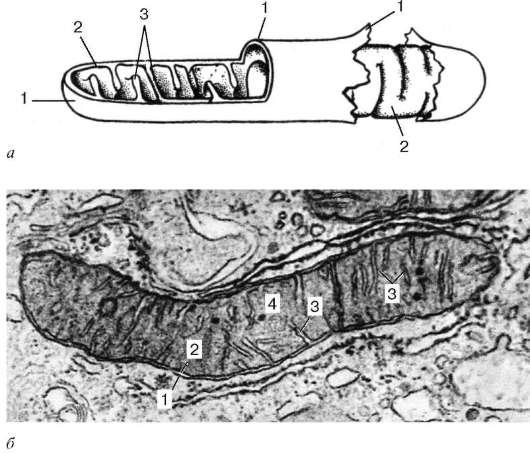
Mitocondriile sunt limitate de două membrane de aproximativ 7 nm grosime (Fig. 4.14).
Membrana mitocondrială exterioară (membrana mitocondrială externă) le separă de hialoplasmă. De obicei are contururi uniforme și este închisă, astfel încât să fie o pungă cu membrană. Membrana exterioară este separată de cea interioară printr-un spațiu intermembranar de aproximativ 10–20 nm lățime. Membrana mitocondrială internă (membrana mitocondrialis interna) limitează conținutul intern real al mitocondriilor, acesta matrice (matrice mitocondrială). O trăsătură caracteristică a membranelor interioare ale mitocondriilor este capacitatea lor de a forma numeroase proeminențe în interiorul mitocondriilor. Astfel de proeminențe arată cel mai adesea ca niște creste plate sau crist.
Matricea mitocondrială are o structură cu granulație fină (vezi Fig. 4.14, b) uneori dezvăluie filamente subțiri (aproximativ 2-3 nm grosime) și granule de aproximativ 15-20 nm în dimensiune. Catenele matricei mitocondriale sunt molecule de ADN, iar granulele mici sunt ribozomi mitocondriali.
Orez. 4.14. Structura ultramicroscopică a mitocondriilor:
dar- schema; b- micrografie electronică a unei secțiuni a mitocondriei unei celule hepatice. 1 - membrana mitocondrială exterioară; 2 - membrana mitocondriala interioara; 3 - cristae; 4 - matricea mitocondrială
Funcția principală a mitocondriilor este sinteza ATP, care are loc ca urmare a proceselor de oxidare a substraturilor organice și de fosforilare a adenozindifosfatului (ADP).
Stadiile inițiale ale acestor procese complexe au loc în hialoplasmă. Aici, oxidarea primară a substraturilor (de exemplu, zaharuri) la acid piruvic (piruvat) are loc cu sinteza simultană a unei cantități mici de ATP. Aceste procese au loc în absența oxigenului (oxidare anaerobă, glicoliză). Toate etapele ulterioare ale producției de energie - oxidarea aerobă și sinteza majorității ATP - sunt efectuate cu consum de oxigen și sunt localizate în interiorul mitocondriilor. În acest caz, oxidarea ulterioară a piruvatului și a altor substraturi ale metabolismului energetic are loc odată cu eliberarea de CO 2 și transferul de protoni către acceptorii lor. Aceste reacții sunt efectuate cu ajutorul unui număr de enzime din așa-numitul ciclu al acidului tricarboxilic, care sunt localizate în matricea mitocondrială.
Ministerul Educației al Republicii Belarus
Universitatea Ecologică Internațională de Stat numită după A.D. Saharov
Facultatea de Medicina Mediului
Departamentul de Genetică Ecologică și Moleculară
Rezumat despre citologia moleculară pe tema „Reticul endoplasmatic”
pregătit de un elev în anul IV
Laptsevici Valeria
FEM, MBD, gr.92061
verificat de: dr. Morozik M.S.
Minsk 2012
Introducere…………………………………………………………………………………….………3
1. Reticul endoplasmatic……………………………………………………………………….…4
1.1.Reticulul endoplasmatic este neted………………………………………..6
1.2 Reticul endoplasmatic rugos (RER) …………………..…8
1.3.SR (reticulul sarcoplasmatic, SR)………………………………………9
2. Reticulul endoplasmatic: transportul proteinelor………………………………………..….10
2.1.Microzom……………………………………………………………………………………………11
3. Proteine responsabile de legarea ribozomilor………………………………………….12
4. Transportul proteinelor în mitocondrii…………………………………………………………………….13
(o particulă de recunoaștere a semnalului)……………….15
6. Proteine: încorporarea în membrana RE………………………………………………………………….16
6.1.Reticul endoplasmatic: plierea proteinelor…….….16
7. Izomeraza disulfură: formarea de legături disulfurice corecte………..17
8.Reticulul endoplasmatic: modificarea proteinelor, glicozilare…….18
9. Reticulul endoplasmatic: modificarea proteinelor, adăugarea de inozitol………………………………………………………………………………………………………… ……………………………………………………………………………………………………………………… ……………………………………………………………………………………………………………………… ……………………………………………………………………………………………………………………… …………
10.Reticulul endoplasmatic: sinteza componentelor membranei celulare....20
11. Transportul fosfolipidelor din reticulul endoplasmatic la organite ..21
Lista literaturii utilizate………………………………………………………….22
Introducere
Organelele sunt componente permanente și indispensabile ale majorității celulelor. Toate organitele sunt împărțite în: nemembranare (microtubuli, ribozomi, centru celular); monomembrană (vacuole, EPS, lizozomi, complex Golgi); cu două membrane (mitocondrii, nucleu).O proprietate comună a organelelor membranare este că toate sunt construite din pelicule de lipoproteine (membrane biologice) care se închid pe ele însele, astfel încât să se formeze cavități sau compartimente închise. Conținutul intern al acestor compartimente este întotdeauna diferit de hialoplasmă.
Celula sintetizează o cantitate imensă diverse substante. Unele dintre ele sunt consumate pentru nevoi proprii (sinteza ATP, construirea organitelor, acumularea de nutrienți), unele sunt îndepărtate din celulă și folosite la construirea învelișului (celule vegetale și fungice), a glicocalixului (celule animale). Secretele celulare sunt și enzimele, hormonii, colagenul, cheratina etc. Acumularea acestor substanțe și deplasarea lor dintr-o parte a celulei în alta sau îndepărtarea în afara acesteia are loc în sistemul membranelor citoplasmatice închise - reticulul endoplasmatic, sau reticulul endoplasmatic. , și complexul Golgi care alcătuiesc sistemul de transport al celulelor.
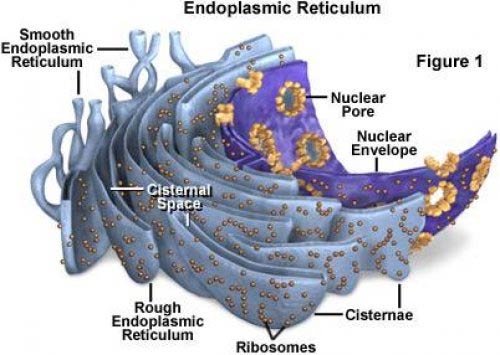
1.Reticul endoplasmatic
organele de celule eucariote. Descoperit de K. Porter în 1945 în endoplasma fibroblastelor. Toate celulele eucariote au un reticul endoplasmatic (RE). Membrana sa extrem de tortuoasă reprezintă de obicei mai mult de jumătate din totalul membranelor celulare. Se crede că deși membrana ER prezinta numeroase pliuri si coturi care patrund in intreaga citoplasma, formeaza o suprafata continua ce limiteaza un singur spatiu intern. Acest spațiu intern, numit cavitatea ER, ocupă adesea mai mult de 10% din volumul total al celulei. Cavitatea ER este separată de citosol printr-o singură membrană (membrană ER) care servește drept legătură între cele două compartimente. Și cavitatea ER și a fiecărui rezervoraparate Golgibule de transport.
Reticulul endoplasmatic (RE) al celulei conține mai multe proteine (cu 60-70%), dar mai puține fosfolipide (cu 30-40%) decât membrana citoplasmatică. Multe dintre proteinele ES au activitate enzimatică. ES sunt împărțite în două tipuri - netede și aspre. În celulele intacte, rețeaua netedă conține sisteme de transport de electroni și metabolizează molecule mici, acționează ca un mecanism de detoxifiere celulară și participă la sinteza lipidelor și a steroizilor. Rețeaua netedă este caracterizată prin prezența sistemelor enzimatice implicate în verigile cheie ale metabolismului. Glucoza-6-fosfataza este concentrată în concentrație mare în hepatocite și mai puțin în alte tipuri de celule. Această enzimă este inclusă în mecanismul de reglare a glicemiei prin asigurarea proceselor de defosforilare a glucozei-6-fosfatului în celule. Citocromul P-450 si NADPH-citocrom-P-450 reductaza, facand parte din lantul de transport, sunt incluse in reactiile de hidroxilare si detoxifiere. Hidroxilarea enzimatică în reticulul endoplasmatic îndeplinește funcții anabolice și catabolice importante în interiorul celulei. Funcțiile anabolice includ biosinteza colesterolului, sinteza steroizilor și acizilor biliari (în hepatocite). Funcțiile catabolice se extind la metabolismul medicamentelor și substanțelor toxice cu proprietăți hidrofile și, prin urmare, sunt ușor expuse la eliberare (eliberare de insecticide, anestezice etc.). La metabolizarea acestor substanțe, este posibilă formarea de substanțe cancerigene. Reticulul endoplasmatic neted este ușor deteriorat în timpul hipoxiei, activării LPO și activării fosfolipazelor endogene. Pierderea funcțiilor sale în celule reduce dramatic rezistența organismului la produsele patogene exogene și endogene și contribuie la dezvoltarea bolii. Reticulul endoplasmatic aspru este format prin legarea ribozomilor de rețea lină cu ajutorul riboforinei proteice (mol. m. 63-65 kDa). Ribozomii, constând dintr-un complex ARN-proteină, sunt organite specializate în aproape toate tipurile de celule. Ele formează un centru catalitic pentru traducerea ARNm într-un lanț peptidic și realizează sinteza proteinelor intracelulare. ARN-ul ribozomal este sintetizat în nucleol și apoi, ca precursor al ribozomilor, este transportat prin porii nucleului în citoplasmă. În citoplasmă, ribozomii fac parte dintr-o rețea brută sau se transformă în polizomi. Capacitatea de sinteză a proteinelor a celulelor este determinată de numărul de ribozomi din citoplasmă și reticulul endoplasmatic rugos.
ER joacă un rol esențial în biosinteza celulară. Pe membranele RE, sinteza proteinelor transmembranare și lipidelor RE, aparatul Golgi, lizozomi şi membrană plasmatică. Aici sunt produse cele mai multe lipide.membranele mitocondrialeȘi membranele peroxizomilor. În plus, toate proteinele nou sintetizate, indiferent de destinația lor (cavitatea ER, aparatul Golgi, lizozomii sau spațiul extracelular), intră mai întâi în cavitatea ER. Deoarece ER servește ca punct de plecare pentru sinteza tuturor proteinelor secretate, este, de asemenea, locul unde se formeazămatrice extracelulara.
Funcții . Reticulul endoplasmatic are multe funcții diverse. Funcția principală a reticulului endoplasmatic granular este participarea la sinteza proteinelor. Prin urmare, este deosebit de puternic dezvoltat în acele celule în care se sintetizează o mulțime de proteine (celule ale diferitelor glande), și este slab dezvoltat în celulele care sintetizează o cantitate mică de proteine (celule ale ganglionilor limfatici, splina).
Pe membranele reticulului endoplasmatic neted se sintetizează grăsimile și carbohidrații. Toate aceste produse de sinteză se acumulează în canale și cavități, iar apoi sunt transportate în diverse organele celulare, unde sunt consumate sau acumulate în citoplasmă ca incluziuni celulare.
Prin urmare, reticulul endoplasmatic este un organel celular care primește Participarea activăîn sinteza proteinelor, carbohidraților și grăsimilor și, de asemenea, transportă aceste substanțe în diferite părți ale celulei.
1.1 Reticulul endoplasmatic este neted
Cu rezervoare ER brute conectate membrane ER netede, care este o rețea de tuburi subțiri cu un diametru de 20 până la 30 nm, lipsite de ribozomi asociați și care se numesc neted ea.
De regulă, dacă celulele conțin un adevărat ER neted, atunci în cantități foarte mici; de fapt, majoritatea regiunilor ER sunt parțial netede și parțial glanulare.
Domină reticulul endoplasmatic netedcelule specializate în metabolismul lipidic. De exemplu, celulele care sintetizeazăhormoni steroizidin colesterol, au un ER extins și neted conceput pentru enzimele implicate însinteza colesteroluluiși transformându-l în hormoni.
Un alt exemplu de celule bogate în ER netedă sunt hepatocite . Acesta este locul principal unde se formează particulele de lipoproteine, destinate „exportului”. Enzime care sintetizează componente lipidice lipoproteinele , sunt localizate pe membranele RE netede. Aceste membrane conțin enzime care catalizează o serie de reacții. detoxifiere , drept urmare sunt neutralizate camedicamentele, și compuși nocivi formați în procesul de metabolism. Cele mai studiate reacții de detoxifiere catalizate de enzimele familiei citocromul P450.
Dacă cantități mari de anumiți compuși intră în sânge, cum ar fi fenobarbital, apoi în ficat enzimele de detoxifiere sunt sintetizate în cantități neobișnuit de mari, iar suprafața unui ER neted se poate dubla în câteva zile. După îndepărtarea medicamentului, membranele în exces ale ER netede sunt distruse de lizozomi (cu participarea unor formațiuni speciale numite autofagozomi), iar după 5 zile ER neted capătă un volum normal. Cum sunt reglementate toate aceste schimbări nu se știe.
1.2 Reticulul endoplasmatic rugos (RER)
Urgenția brută și-a primit numele din cauza multor ribozom situat pe suprafața sa citoplasmatică; formează stive polarizate de rezervoare aplatizate, fiecare dintre ele având un spațiu (cavitate) de 20 până la 30 nm lățime. Membrana este conectată la aceste rezervoare ER neted.
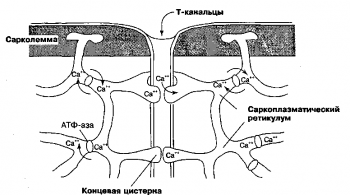
1.3.SR (reticulul sarcoplasmatic, SR)
Celulele musculare au un organel neted, asemănător ER, numit reticul sarcoplasmatic, care captează ioni din citosol. calciu . SR este situat în imediata apropiere a miofibrila . Structurile sale sunt subdivizate în cisterne terminale, care acoperă miofibrilele într-un semicerc, și tubuli longitudinali, care leagă cisterne terminale adiacente. Tancurile terminale ale SR se alătură T-tubuli - invaginări profunde ale membranei externe. Numărul de tubuli T corespunde aproximativ cu numărul sarcomere . Proteina membranară principală a reticulului sarcoplasmatic este ATPaza de calciu pompând ionii de calciu în interior. Contracție și relaxare rapidă miofibrile în fiecare ciclu contractie muscularamediată de eliberarea ionilor de calciu din reticulul sarcoplasmatic și apoi recaptarea acestuia din citosol.
2.Reticulul endoplasmatic: transport de proteine
Cavitatea ER este separată de citosol printr-o singură membrană ( membrana ER ) servind drept legătură între aceste două compartimente. Cavitatea opusă ER și fiecare rezervoraparate Golgiseparate între ele prin două membrane și citosol, astfel încât transportul macromoleculelor între aceste organite se realizează folosindbule de transport.
Toate proteinele nou sintetizate, indiferent de destinația lor (cavitatea ER, aparatul Golgi, lizozomii sau spațiul extracelular), intră mai întâi în cavitatea ER.
Unele proteine se deplasează din citosol în ER murdar imediat după sinteza lor.
Acestea sunt două tipuri de proteine:
1) transmembranar, care sunt transferate doar parțial prin membrana ER și să rămână închis în ea și
2) solubil în apă, care sunt complet transferate prin membrana ER și eliberate în cavitatea acesteia.
în celulele de mamifereimportul de proteine în REîncepe chiar înainte ca lanțul polipeptidic să fie complet sintetizat, adică apare simultan cu difuzat (cotraducere).
Astfel, există două populații izolate spațial de ribozomi în citoplasmă. Unul din ei (ribozomi atașați de membrană), sunt situate pe suprafața membranei RE cu fața către citoplasmă și sunt implicate în sinteza proteinelor care sunt imediat transferate în RE. Alte (ribozomi liberi) nu sunt atașate de nicio membrană și produc toate celelalte proteine codificate de nucleu. Ribozomii legați și liberi sunt identici ca structură și funcție. Diferă doar prin proteinele care sunt sintetizate pe ele în fiecare acest moment. Dacă ribozomul primește sinteza unei proteine cu o peptidă semnal pentru ER, atunci un astfel de semnal direcționează ribozomul către membrana ER.
2.1.Microzom
Când țesuturile sau celulele sunt distruse prin omogenizare, ER se dezintegrează în multe vezicule închise mici (aproximativ 100 nm în diametru) numite microzomi, care sunt relativ ușor de curățat.
Microzomii derivați din ER granulară (aspre) sunt împânziți cu ribozomi și sunt numițimicrozomi aspri. Ribozomii sunt întotdeauna localizați pe suprafața lor exterioară; aceasta indică faptul că spațiul din interiorul microzomilor este echivalent biochimic cu cavitatea ER.
Microzomii aspri sunt ușor de curățat și își păstrează activitatea funcțională, sunt extrem de utili pentru studierea multor procese care au loc în ER. Aceste organite sunt aranjate topologic în același mod ca ER brut; suprafața lor citoplasmatică este ușor accesibilă ingredientelor care pot fi adăugate in vitro.
Microzomi netezisunt formate parțial din secțiuni netede ale RE, parțial din fragmente ale membranei plasmatice, aparatul Golgi, endozomi și mitocondrii.
Microzomi aspriizolate din ficat conțin mai mult de 20 de proteine care sunt absente în microzomii netezi. Acest fapt indică existența unor mecanisme limitative. Unele dintre aceste proteinemembrane ER rugoase
3. Reticul endoplasmatic: proteine responsabile de legarea ribozomilor
Microzomi aspriizolate din ficat conțin mai mult de 20 de proteine care sunt absente în microzomii netezi. Acest fapt indică existența unor mecanisme limitative.
Unele dintre aceste proteinemembrane ER rugoaseajută la legarea ribozomilor, alții probabil îi determină forma turtită.
Nu este clar cum aceste proteine sunt reținute în membrană: dacă formează agregate mari bidimensionale sau interacționează cu o rețea de proteine structurale pe una sau alta suprafață a membranei ER.
Ribozomii ER asprusunt reținute pe membrană în parte prin creșterea lanțurilor polipeptidice care se deplasează prin membrană pe măsură ce sunt sintetizate. Cu toate acestea, dacă formarea lanțurilor polipeptidice este întreruptă de orice inhibitor (de exemplu, puromicina ), ribozomii rămân încă legați demembrana microzomilor aspri. Locul de legare a membranei este situat pe subunitatea mare a ribozomului, dar nu este clar de care dintre multele proteine din membrana rugoasă ER se leagă ribozomul.
4.Transportul proteinelor în mitocondrii
Mitocondriile sunt organite care se găsesc în aproape toate celulele eucariote. Cea mai importantă funcție a mitocondriilor este sinteza ATP, împreună cufosforilarea oxidativă. Mitocondria este formată din patru subcompartimente: o membrană exterioară permeabilă la molecule și ioni mici (mai puțin de 10 kDa); membrana interioară, care este impermeabilă la majoritatea ionilor și formează structuri regulate pliate ( cristae ); spațiul intermembranar situat între aceste două membrane și matricea. Matricea conține cADN mitocondrial și componente necesare pentru transcripția și traducerea proteinelor codificate de genomul mitocondrial.
Deşi mitocondriile au propriul lor ADN și aparat pentru sinteza proteinelor, majoritatea proteinelor lor sunt codificate de ADN-ul celular și provin din citosol. Genomul mitocondrial codifică câteva dintre propriile ARNr și tARN, precum și uneleproteinele lanțului respiratorși ATP-aze . În funcție de tipul de organism, pot exista de la 8 la 16 proteine codificate în mitocondrii.De regulă, toate aceste proteine sunt foarte hidrofobe și sunt localizate pe membrana interioară a mitocondriilor din partea laterală a matricei. În general, creșterea și funcționarea mitocondriilor este imposibilă fără importul de proteine codificate de genomul nuclear și sintetizate pe ribozomii citoplasmatici (așa-numitele proteine precursoare, în literatura engleză „preproteins” sau „precursori”). Fiecare proteină care intră trebuie să ajungă la un subcompartiment specific în care funcționează. Și fiecare dintre aceste subcompartimente conține un set diferit de proteine. Creșterea mitocondrială este posibilă datorită importului de proteine citoplasmatice, care include transferul selectiv secvențial al proteinelor prin una sau două membrane.
În cele mai multe cazuri, energia mișcării direcționale este utilizată sub formă de ATP, dar transferul proteinelor către mitocondrii necesită și prezența unui gradient electrochimic pe membrana mitocondrială interioară. Acest gradient se formează în timpul transportului de electroni, deoarece protonii sunt pompați din matrice în spațiul intermembranar.
Proteinele importate în matricea mitocondrială ajung de obicei din citosol în decurs de una până la două minute după separarea lor de poliribozomi. Proteinele sunt transportate în matricea mitocondrială prin zone de adeziune care leagă membranele exterioare și interioare. Acest transfer necesită hidroliza ATP, precum și un gradient electrochimic pe membrana interioară.
Proteina transportată se desfășoară pe măsură ce traversează membranele mitocondriale. Deoarece atât proteinele solubile în apă, cât și cele hidrofobe au o structură similară atunci când sunt desfășurate, ele pot fi transferate printr-un mecanism comun. Se presupune că hidroliza ATP furnizează energie pentru desfășurarea moleculei de proteină și că unele gene ale familiei sunt necesare pentru această reacție de desfășurare. hsp70.
Proteine importate înmatricei mitocondriale, aproape întotdeauna purtată la capătul N-terminalpeptidă semnallungime de la 20 la 80 de resturi de aminoacizi. După ce proteina intră în mitocondrii, peptida semnal este îndepărtată rapid de o protează specifică (peptidaza semnal) a matricei și apoi, probabil, se degradează în matrice la aminoacizi. Peptida semnal poate fi extrem de simplă. În a doua etapă de transport, proteina poate fi transportată la membrana interioară. Pentru a face acest lucru, trebuie să aibă și o peptidă semnal hidrofobă; această peptidă se deschide după îndepărtarea primului semnal.
În membrana exterioară a mitocondriilorexistă o structură neobișnuită (seamănă cu membrana exterioară a bacteriilor gram-negative), al cărei strat lipidic conține cantități mari de proteine care formează pori - porina . Din acest motiv, membrana exterioară este liber permeabilă la ionii anorganici și metaboliți și la moleculele proteice mai mici de 10 kDa. Dar pentru proteinele mai mari, membrana exterioară acționează ca o barieră și, prin urmare, ajută la prevenirea scurgerii proteinelor din spațiul intermembranar înapoi în citosol.
Importul proteinelor codificate de genomul nuclear în mitocondrii este un proces complex în mai multe etape.Schatz G., Dobberstein B., 1996, Neupert W., 1997, Pfanner N. şi colab., 1997, Whelan J., Glazer E., 1997 ]. Alături de direcția principală de import de proteine - în matricea mitocondrială - există modalități de import de proteine în alte subcompartimente mitocondriale.
În prezent, există două teorii principale de translocare a precursorilor proteinelor codificate de genomul nuclear în mitocondrii:co-difuzareȘi post-translațională .
5. SRP, particule de recunoaștere a semnalului (o particulă de recunoaștere a semnalului)
SRP - o particulă de recunoaștere a semnalului și un ghidPeptidă semnal ER la receptor specific din membrana RE. Aceasta este o particulă complexă constând din șase lanțuri polipeptidice diferite asociate cu o singură moleculă de 7SL-ARN.
Particula de recunoaștere a semnalului se leagă de peptida semnal de îndată ce părăsește ribozomul. Acest lucru duce la o oprire temporară a sintezei proteinelor. În curs de dezvoltarepauză în difuzare, probabil permite ribozomul se leagă de membrana ER înainte ca sinteza lanţului polipeptidic să fie finalizată. Din acest motiv, nu are loc eliberarea inutilă de proteine în citosol.
SRP captează strâns ribozomul, atașându-se atât la peptida semnal (de îndată ce apare pe subunitatea mare a ribozomului), cât și lasitusul de legare aminoacil-ARNt ribozomal. Ca urmare, traducerea se oprește deoarece legarea următoarei este blocată. aminoacil-ARNt cu ribozom (Fig. 8-43).
Pauza în translație durează până când particula care a capturat ribozomul se leagă de receptorul SRP situat pe partea citoplasmaticămembrane ER rugoase. Interacționează cu ribozomii legați de SRP în așa fel încât particula să își schimbe poziția și translația se reia. În același timp, ribozomul se leagă de membrana ER, iar lanțul polipeptidic care crește pe acesta este transferat în sistemul de translocare din membrană. Acest sistem este puțin înțeles, se știe doar că include o a doua proteină receptor peptidic semnal care diferă de SRP. Aparent, rolul său este de a lega ribozomul, pe care a fost sintetizată peptida semnal ER, de membrana ER; de asemenea, participă la transferul ulterior al proteinei prin membrană.
6.Proteine: încorporare în membrana ER
Conform ipoteza semnaluluipeptida semnal direcționează proteina către membrana ER. Majoritatepeptide semnaleliminat prin specialpeptidaza semnal asociat cu membrana RE . Cu toate acestea, prezența unei peptide semnal în sine nu este suficientă pentru funcționarea acestei peptidaze: prezența unui loc de tăiere în vecinătate, care nu este necesar pentru transfer, este necesară. S-a demonstrat că peptidele semnal din unele proteine sunt localizate în interiorul lanțului polipeptidic și nu sunt niciodată excizate.
Se crede că peptidele semnal nedeletate joacă un rol important în implementarea diferitelor metodeînglobarea în membranăgasit inproteinele transmembranare. Toate aceste metode pot fi considerate variante alesecventa de evenimente, în urma căreia proteina solubilă este transferată în cavitatea ER.
In conformitate cu idei moderne, peptida semnal hidrofobă a proteinei solubile, printre alte funcții, serveștesemnal de pornire a transferuluiși rămâne cufundat în membrană tot timpul în timp ce restul moleculei proteice este târât prin ea sub forma unei bucle mari. Când capătul carboxil al moleculei trece prin membrană, proteina rămâne asociată cu aceasta doar de peptida semnal. Prin urmare, dacă această peptidă este tăiată, proteina este eliberată în cavitatea ER.( poza 8-45)
Pentru proteine membranaresituatia este mai complicata.
6.1 Reticulul endoplasmatic: plierea proteinelor
Se știe că timpul pe care îl petrece o proteină în ER înainte de a intra în aparatul Golgi variază foarte mult. Probabil, aceste diferențe depind în mare măsură de cât timp proteina dată este separată de precipitat (se transformă într-o stare solubilă) și se coagulează.
Cavitatea ER conține o cantitate mare de proteine de legare BiP , care pare să recunoască proteinele pliate greșit prin legarea de plasturi hidrofobe exterioare.
7. Izomeraza disulfură: formarea de legături disulfurice corecte
În cavitatea ER nu există agenți reducători și, prin urmare, acolo se formează punți -S-S în proteine. Cu o abundență de proteine de pliere, acest proces uneori merge prost. Cavitatea ER conține o enzimă care ajută la corectarea unor astfel de erori.Disulfur izomerazaeste o proteină care în număr mare conținută în cavitatea RE și este atașată de partea interioară a membranei sale. Are același semnal de reținere ER ca BiP . Mecanismul de acțiune al disulfurizomerazei este acela prin tăiere Conexiuni S-S, dă proteinei capacitatea de a schimba rapid o mulțime de informații până când se ajunge la conformația cu cea mai mică energie liberă totală. În această etapă, proteina nou sintetizată se pliază corespunzător. corect conformaţie poate fi aleasă aleatoriu, dar izomeraza disulfură accelerează semnificativ procesul de căutare.
8. Reticulul endoplasmatic: modificarea proteinelor, glicozilare
Una dintre funcțiile principale ale ER este atașarea covalentă a zaharurilor de proteine. Majoritatea proteinelor care intră în cavitatea ER devinglicoproteine. Pe de altă parte, în citosol foarte puține proteine sunt glicozilate, iar cele care sunt glicozilate poartă diverse modificări ale zahărului.
Esențial pentru înțelegerea procesuluiglicozilarea proteinelora fost descoperirea faptului că o singură oligozaharidă, constând din N-acetilglicozamină, manoză și glucoză, și care conține doar 14 reziduuri, este atașată la proteine în ER.
Deoarece această oligozaharidă se atașează întotdeauna de grupul de lanț lateral NH(2) al unui reziduu de asparagină, se numește N-legat sau oligozaharidă legată de asparagină.
Atașarea este catalizată de o enzimă legată de membrană al cărei sit activ este orientat spre cavitatea ER. Aceasta explică de ce proteinele citosolului nu sunt glicozilate în acest mod. Precursorul de oligozaharidă preformat este transferat la reziduul de asparagină dorit. Aceasta este o reacție într-un singur pas și are loc aproape imediat după ce reziduul de asparagină apare în cavitatea ER în timpul transferului proteinei prin membrană.
Deoarece majoritatea proteinelor sunt importate co-translațional în ER, aproape întotdeauna se adaugă o oligozaharidă N-legată în timpul sintezei proteinelor pentru a oferi cel mai bun acces la reziduurile de asparagină dorite.Semnale pentru N-glicozilareservesc două secvențe Asn-X-Ser sau Asn-X-Thr (unde X este orice aminoacid cu excepția prolinei).
Precursorul oligozaharidei este reținut în membrana ER de o moleculă specială de lipide - dolichola . Oligozaharida este legată de dolicol printr-o legătură fosfat de înaltă energie, care furnizează energia de activare pentru reacția de glicozilare. Înainte de a fi atașată la o proteină, o oligozaharidă este construită din monozaharide pe această moleculă lipidă legată de membrană. Inițial, zaharurile sunt activate în citosol prin formarea unor produse intermediare - zaharuri nucleotidice, care apoi (direct sau indirect) își transferă zahărul către molecula de lipide într-o anumită secvență. După ce a parcurs această cale, precursorul oligozaharidei sare din partea citosolică a membranei ER în cavitatea sa.
Întreaga varietate de structuri de oligozaharide N-legate apare ca urmare a modificărilor moleculei precursoare inițiale. Chiar și în ER, în majoritatea glicoproteinelor, trei resturi de glucoză și un reziduu de manoză sunt scindate din oligozaharidă. „Finalizarea” sau „prelucrarea” oligozaharidei continuă înaparate Golgi .
Cel mai larg distribuit în glicoproteineOligozaharide N-legate. Mult mai rar, oligozaharidele se leagă la gruparea hidroxil a catenei laterale a unui rest serină, treonină sau hidroxilizină. Astfel deOligozaharide O-legateformat în aparatul Golgi.
9. Reticulul endoplasmatic: modificarea proteinelor, adăugarea de inozitol
Capătul carboxil al unoraproteine ale membranei plasmaticecu ajutorul unor enzime specifice se ataseaza covalent de reziduul de zahar din glicolipid. Mecanismul pentru formarea acestei conexiuni este prezentat înfig.8-45 înglobând proteine în membrana RE. S-a constatat că în acest caz, la proteină se adaugă o moleculă glicozilatăfosfatidilinozitolconţinând doi acizi graşi. Această modificare a fost găsită pentru un numar mare proteine ale membranei plasmatice, inclusiv o formă de adeziv proteina neuronilor.
10. Reticul endoplasmatic: sinteza componentelor membranei celulare
în membrana RE aproape toate sunt formate lipide necesare pentru a construi noimembranele celulare inclusiv fosfolipidele și colesterolul . Principalul fosfolipid sintetizat estefosfatidilcolina(numită și lecitină ), care se poate forma în trei etape din doi acizi grași, glicerofosfat și colină.
Urgenția produce și colesterol și ceramidă . Ceramida este exportată în aparate Golgi , unde servește ca precursor a două tipuri de lipide: lanțurile de oligozaharide sunt atașate la o moleculă de ceramidă pentru a formaglicosfingolipideși pentru alții - grupul principal de fosfocolină din fosfatidilcolină și se dovedește sfingomielina . Astfel, atât glicolipidele, cât și sfingomielina se formează relativ târziu în procesul de formare a membranei. Ele sunt localizate exclusiv în jumătatea necitosolicădublu strat lipidicdeoarece acolo se află enzimele care le sintetizează.
11. Transportul fosfolipidelor din reticulul endoplasmatic la organite
membrană plasmatică, membrana aparatului GolgiȘi membrana lizozomuluisunt părți ale sistemului membranar asociate cu ER cu bule de transportfurnizează atât proteine, cât și lipide. Mitocondrii și peroxizomi nu aparțin acestui sistem și necesită alte mecanisme pentru a importa proteine și lipide membranare.
Special solubil în apăproteine purtătoare fosfolipideau capacitatea de a transfera molecule de fosfolipide individuale de la o membrană la alta. Se presupune că în acest fel fosfatidilserina este transferată în mitocondrii, apoi este decarboxilată, formând fosfatidiletanolamină; Fosfatidilcolina este cel mai probabil importată ca moleculă intactă.
Proteinele purtătoare se distribuie fosfolipide aleatoriu între organele manieră.
Lista literaturii folosite:
- Chentsov Yu.S. Introducere în biologia celulară: manual pentru universități - ed. a 4-a, revizuită. si suplimentare – M.: Akademkniga, 2005. – 495 p.
- Chentsov Yu.S. Citologie generala //
- Zavarzin A.A. Biologie celulară: Citologie generală. / A.A. Zavarzin, A.D. Kharazova, M.N. Molitvin. - Sankt Petersburg: Editura Universității din Sankt Petersburg, 1992.
14. Eps granulat și neted. Structura și caracteristicile funcționării în celule de același tip.
Reticulul endoplasmatic (EPS) - un sistem de canale tubulare comunicante sau separate și cisterne aplatizate situate în întreaga citoplasmă a celulei. Sunt delimitate de membrane (organite membranare). Uneori, rezervoarele au expansiuni sub formă de bule. Canalele EPS se pot conecta cu membrane de suprafață sau nucleare, contact cu complexul Golgi.
În acest sistem se pot distinge EPS neted și aspru (granular).
EPS dur. Pe canalele ER rugoase, ribozomii sunt localizați sub formă de polizomi. Aici are loc sinteza proteinelor, produse în principal de celulă pentru export (scoaterea din celulă), de exemplu, secreții de celule glandulare. Aici are loc formarea lipidelor și proteinelor membranei citoplasmatice și asamblarea acestora. Cisternele și canalele dens împachetate ale ER granulare formează o structură stratificată în care sinteza proteinelor se desfășoară cel mai activ. Acest loc se numește ergastoplasmă.
EPS neted. Nu există ribozomi pe membranele netede ale RE. Aici are loc în principal sinteza grăsimilor și substanțelor similare (de exemplu, hormoni steroizi), precum și a carbohidraților. Prin canalele EPS netede, materialul finit se deplasează, de asemenea, la locul de ambalare în granule (în zona complexului Golgi). În celulele hepatice, ER neted participă la distrugerea și neutralizarea unui număr de substanțe toxice și medicinale (de exemplu, barbiturice). În mușchii striați, tubii și cisternele ER netede depun ioni de calciu.
15. Complexul Golgi. Structură și funcții.
Complexul Golgi este o structură membranară inerentă oricărei celule eucariote. Complexul Golgi este format din cisterne aplatizate, de obicei dispuse în stive (dictiozomi). Rezervoarele nu sunt izolate, ci sunt interconectate printr-un sistem de tuburi. Prima cisternă din nucleu se numește cis-pol al complexului Golgi, iar ultima, respectiv, trans-pol. Numărul de cisterne din diferite celule ale diferitelor organisme poate varia, dar, în general, structura complexului Golgi în toate eucariotele este aproximativ aceeași. În celulele secretoare, este deosebit de puternic dezvoltat. Funcțiile complexului Golgi sunt de a transporta proteinele la destinație, precum și de glicozilare, deglicozilare și modificarea lanțurilor de oligozaharide.
Complexul Golgi este caracterizat de anizotropie funcțională. Proteinele nou sintetizate sunt transportate din reticulul endoplasmatic la polul cis al dictiozomilor folosind vezicule. Apoi se deplasează treptat spre trans-pol, suferind modificări treptate (pe măsură ce se îndepărtează de nucleu, se modifică compoziția sistemelor enzimatice din rezervoare). În cele din urmă, proteinele călătoresc la destinația lor finală în vezicule care înmugurează din polul trans. Complexul Golgi asigură transportul proteinelor în trei compartimente: către lizozomi (precum și către vacuola centrală a celulei vegetale și vacuolele contractile ale protozoarelor), către membrana celulară și către spațiul intercelular. Direcția transferului de proteine este determinată de etichete glicozidice speciale. De exemplu, un marker pentru enzimele lizozomale este manoza-6-fosfat. Maturarea și transportul proteinelor mitocondriale, nucleare și cloroplastice au loc fără participarea complexului Golgi: ele sunt sintetizate de ribozomi liberi și apoi intră direct în citosol. O funcție importantă a complexului Golgi este sinteza și modificarea componentei carbohidrate a glicoproteinelor, proteoglicanilor și glicolipidelor. De asemenea, sintetizează multe polizaharide, cum ar fi hemiceluloza și pectina din plante. Cisternele complexului Golgi conțin o gamă întreagă de glicoziltransferaze și glicozidaze diferite. Ele suferă, de asemenea, sulfatarea reziduurilor de carbohidrați.
Organele - structuri prezente constant în citoplasmă, specializate în îndeplinirea anumitor funcții în celulă. Ele sunt împărțite în organite cu semnificație generală și specială.
Reticulul endoplasmatic
Reticulul endoplasmatic, sau reticulul endoplasmatic, este un sistem de cisterne cu membrană plate și tubuli membranari. Rezervoarele și tubulii cu membrană sunt interconectate și formează o structură membranară cu un conținut comun. Acest lucru vă permite să izolați anumite zone ale citoplasmei de nialoplasma principală și să implementați unele funcții celulare specifice în ele. Rezultatul este diferențierea funcțională. zone diferite citoplasma. Structura membranelor EPS corespunde modelului fluid-mozaic. Din punct de vedere morfologic, există 2 tipuri de EPS: neted (granular) și aspru (granular). ER neted este reprezentat de un sistem de tubuli membranari. Rough EPS este un sistem de rezervoare cu membrană. Pe partea exterioară a membranelor EPS aspre sunt ribozomi. Ambele tipuri de EPS sunt dependente structural - membranele unui tip de EPS pot trece în membrane de alt tip.
Funcțiile reticulului endoplasmatic:
1. ER granular este implicat în sinteza proteinelor, în canale se formează molecule de proteine complexe.
2. Smooth ER este implicat în sinteza lipidelor și carbohidraților.
3. Transport materie organicăîn celulă (prin canalele ER).
4. Împarte celula în secțiuni - în care diferite reacții chimiceși procesele fiziologice.
EPS neted este multifuncțional. În membrana sa există proteine-0 enzime care catalizează reacțiile de sinteză a lipidelor membranare. În ER netedă, sunt sintetizate și unele lipide non-membranare (hormoni steroizi). Compoziția membranei acestui tip de EPS include purtători de Ca 2+. Ei transportă calciul de-a lungul unui gradient de concentrație (transport pasiv). În transportul pasiv, ATP este sintetizat. Cu ajutorul lor, concentrația de Ca 2+ din hialoplasmă este reglată în EPS neted. Acest parametru este important pentru reglarea microtubulilor și microfibrilelor. În celulele musculare, ER neted reglează contracția musculară. În EPS are loc detoxifierea multor substanțe dăunătoare celulei (droguri). ER neted poate forma vezicule membranoase sau microcorpi. Astfel de vezicule desfășoară reacții oxidative specifice izolat de EPS.
functie principala eps dur este sinteza proteinelor. Acest lucru este determinat de prezența ribozomilor pe membrane. Membrana ER rugoasă conține proteine speciale riboforine. Ribozomii interacționează cu riboforinele și sunt fixați pe membrană într-o anumită orientare. Toate proteinele sintetizate în ER au un fragment de semnal terminal. Pe ribozomii ER brut, sunt sintetizate trei tipuri de proteine:
1. Proteinele membranare. Toate proteinele plasmolemei, membranele ER în sine și majoritatea proteinelor altor organite sunt produse ale ribozomilor ER.
2. proteine secretoare . Aceste proteine intră în reticulul endoplasmatic și apoi sunt expulzate din celulă prin exocitoză.
3. Proteine intraorganoide. Aceste proteine sunt localizate și funcționează în cavitățile organelelor membranare: ER însuși, complexul Golgi, lizozomi și mitocondrii. EPS este implicat în formarea biomembranelor.
În cisternele de ER brut, apare modificarea post-translațională a proteinelor.
ER este un organel versatil Celulele eucariote. Încălcarea structurii și funcției EPS duce la consecințe grave. EPS este locul de formare a veziculelor membranare cu funcții specializate ( peroxizomii).
Complexul Golgi.
Complexul Golgi este un organel membranar universal din celulele eucariote. Partea structurală a complexului Golgi este reprezentată de sistem rezervoare cu membrană, formând o stivă de rezervoare. Această stivă se numește dictiozom. Tubulii și veziculele membranare se îndepărtează de ele.
Complexul Golgi poate fi reprezentat într-o celulă printr-un dictiozom într-o secțiune specială a citoplasmei. O celulă poate conține mai mulți dictiozomi izolați interconectați.
În dictiozomul complexului Golgi se disting 2 poli: proximal (regenerativ) și distal (funcțional). Polul proximal este orientat spre citoplasmă sau nucleu, iar polul distal este orientat spre plasmolemă.
Structura membranelor complexului Golgi corespunde structurii fluido-mozaice. Membranele diferiților poli sunt separate prin cantitatea de glicolipide și glicoproteine. La polul proximal se formează noi cisterne de dictiozomi. Veziculele membranoase mici se desprind din EPS neted și se deplasează în zona polului proximal. Aici se unesc și formează o cisterna mai mare. Ca urmare a acestui proces, substanțele care sunt sintetizate în EPS pot fi transportate în rezervoarele complexului Golgi. Veziculele se desprind de pe suprafețele laterale ale polului distal, care sunt implicate în engiocitoză.
Complexul Golgi îndeplinește 3 funcții celulare generale:
Cumulativ
Secretar
Agregare
În cisternele complexului Golgi au loc anumite procese biochimice. Ca urmare, se efectuează modificarea chimică a componentelor membranei rezervoarelor complexului Golgi și a moleculelor din interiorul acestor rezervoare. În membranele cisternelor polului proximal există enzime care realizează sinteza carbohidraților (polizaharide) și atașarea acestora la lipide și proteine, adică. are loc glicozilarea. Prezența acestei sau a altei componente carbohidrate în proteinele glicozilate determină soarta acestora. În funcție de aceasta, proteinele intră în diferite regiuni ale celulei și sunt secretate. Glicozilarea este una dintre etapele de maturare a secretului. În plus, proteinele din cisternele complexului Golgi pot fi fosforilate și acetilate. Polizaharidele libere pot fi sintetizate în complexul Golgi. Unele dintre ele suferă sulfatare cu formarea de mucopolizaharide (glicozaminoglicani). O altă opțiune pentru maturarea secreției este condensarea proteinelor. Acest proces constă în îndepărtarea moleculelor de apă din granulele secretoare, ceea ce duce la compactarea secretului.
De asemenea, universalitatea complexului Golgi în celulele eucariote este participarea acestuia la formare lizozomi.
Lizozomi.
Lizozomi sunt organite membranoase ale celulei. În interiorul lizozomilor se află o matrice lizozomală de mucopolizaharide și enzime proteice.
Membrana lizozomală este un derivat al membranei EPS, dar are propriile sale caracteristici. Aceasta se referă la structura stratului bilipid. În membrana lizozomului, aceasta nu este continuă (nu continuă), dar include micele lipidice. Aceste micelii alcătuiesc până la 25% din suprafața membranei lizozomale. Această structură se numește placă-micelară. O varietate de proteine sunt localizate în membrana lizozomului. Acestea includ enzime: hidrolaze, fosfolipaze; și proteine cu greutate moleculară mică. Hidrolazele sunt enzime specifice lizozomului. Ele catalizează reacțiile de hidroliză (clivaj) substanțelor macromoleculare.
Funcțiile lizozomilor:
1. Digestia particulelor în timpul fagocitozei și pinocitozei.
2. Protectiv în timpul fagocitozei
3. Autofagie
4. Autoliza în ontogenie.
Funcția principală a lizozomilor este participarea la ciclurile heterofagotice (heterofagie) și la ciclurile autofagotice (autofagie). În heterofagie, substanțele străine celulei sunt descompuse. Autofagia este asociată cu descompunerea substanțelor proprii celulei. Varianta obișnuită a heterofagiei începe cu endocitoză și formarea unei vezicule endocitare. În acest caz, vezicula se numește heterofagozom. Pe ER brut, proteinele lizozomului, inclusiv hidrolazele, sunt sintetizate. Ele sunt în primul rând glicozilate ca parte a veziculei membranoase și direcționate către complexul Golgi. Aici are loc glicozilarea suplimentară și formarea unei matrice lizozomale. Ca rezultat, se formează lizozomi primari cu hidrolaze inactive. Inactivarea hidrolazelor se datorează glicozilării lor și acțiunii inhibitorilor specifici de hidrolază. Acești inhibitori sunt proteine membranoase de lizozom cu greutate moleculară mică.
Lizozomul primar converge în heterofagozom cu ajutorul microtubulilor. După contactul acestor vezicule membranoase, ele se apropie una de cealaltă și formează un lizozom secundar sau heterofagolizozom. Formarea unui heterofagozom activează pompa de protoni, care transportă protoni H + în ea. Mediul lizozomului secundar devine mai acid, ceea ce induce activitatea hidrolazelor. Ca urmare, substanța care a intrat în lizozomul secundar este supusă scindării. Produșii de hidroliză cu greutate moleculară mică trec prin membrana lizozomului secundar în hialoplasmă. După ce hidroliza este finalizată, lizozomul secundar poate fuziona cu un nou heterofagozom și poate începe un nou ciclu heterofagotic. După mai multe astfel de cicluri, hidrolazele își pierd activitatea și se transformă într-un telolizozom sau corp rezidual. Telolizomul conține resturi de substanțe nedigerate. Poate fi stocat în hialoplasmă sau inclus în procesul de exocitoză.
Într-o altă variantă de heterofagie, nu există o etapă de endocitoză a substanțelor străine. În acest caz, lizozomul primar este imediat inclus în exocitoză. Ca urmare, hidrolazele matricei se găsesc în glicocalixul celulei și sunt capabile să scindeze substanțele străine extracelulare.
Autofagie simplă (macroautofagie) nu are diferențe fundamentale față de heterofagie. În acest caz, substanța divizată este înconjurată de o secțiune nu a plasmolemei, ci a endomembranei (EPS, complexul Golgi). Ca rezultat, se formează un autofagozom. Se fuzionează cu lizozomul primar pentru a forma lizozomul secundar. Se numește autofagolizozom. Soarta ulterioară a autofagolizozomului este similară cu soarta lizozomului secundar în ciclul heterofagotic. Autofagia distruge organele membranei celulare (mitocondriile). În acest caz, membranele lizozomului primar se îmbină cu membrana exterioară a mitocondriilor. În același mod, conținutul diferitelor vezicule membranare ale citoplasmei poate fi distrus.
O altă variantă a autofagiei a fost numită lizofagie.În acest caz, nu se formează autofagozom. Un caz special de lizofagie este microautofagia, când substanța degradabilă trece prin membrana lizozomală în matricea lizozomală. Există o opțiune când autofagia este realizată prin divizarea substanțelor din hialoplasmă în sine. În acest caz, fosforilarea proteinelor membranare primare a lizozomului induce eliberarea de nidrolaze din lizozom în hialoplasmă. Aici are loc hidroliza extra-lizozomală a substanțelor. Multe funcții celulare se bazează pe autofagie și heterofagie.
Autofagia este caracteristică tuturor celulelor eucariote. Când substanțele sunt distruse în procesul de autofagie, se formează metaboliți cu greutate moleculară mică. Sunt folosite în plastic și schimb de energieși îndeplinesc o funcție trofică. Pe baza autofagiei și heterofagiei, lizozomii sunt implicați în procesarea anumitor proteine. Proteina tiroglobulinei leagă iodul și pătrunde în celulele epiteliale ale glandei tiroide prin endocitoză. Aici, lizozomul descompune tiroglobulina în hormoni cu greutate moleculară mică: tiroxina și triiodotironina. În absența activității hidrolazelor lizozomale, catabolismul normal (diviziunea) substanțelor este perturbat. În funcție de încălcarea catabolismului, bolile de acumulare sunt clasificate în: glicogenoze, mucopolizaharidoze, mucolipidoze, sfingolipidoze. Acestea sunt boli ereditare.
Peroxizomii.
Peroxizomii(microcorpii) sunt similare structural cu lizozomii. Ele constau dintr-un matirix și o nucleotidă. Matricea peroxizomilor conține până la 15 enzime. Cele mai importante dintre acestea sunt peroxidaza și catalaza, D-aminoacid oxidaza și uratrooxidaza. Nucleotida peroxizomului corespunde regiunii de condensare a enzimei. Peroxizomii sunt formați în ER, înmuguriți din ER agranular, enzimele lor sunt parțial sintetizate în ER granular și parțial în hialoplasmă. Membrana peroxizomală este impermeabilă la ioni și la substraturi cu greutate moleculară mică.
Peroxizomii este centrul principal al producerii de oxigen în celulă. Ca urmare a oxidării aminoacizilor, carbohidraților, se formează H 2 O 2 care, datorită catalazei, se descompune în apă și O 2. Peroxizomii mari ai ficatului și rinichilor joacă un rol important în neutralizarea unui număr de substanțe. În plus, sunt implicați în catabolism (în schimbul de aminoacizi, oxalat și poliamine).
În prezent, a fost descoperită o clasă de boli ereditare - boli peroxizomale, a căror dezvoltare este cauzată de un defect al peroxizomilor. În aceste boli, organele sunt afectate, se dezvoltă tulburări sistem nervos provocând moartea la pacienții din copilărie.
Mitocondriile.
Mitocondriile sunt organite membranare universale ale celulelor. Mitocondriile au 2 membrane - exterioara si interioara. Între aceste membrane există un spațiu intermembranar. În unele părți ale membranei formează locuri de contact. Mitocondriile conțin matricea mitocondrială. Localizează molecule de ADN mitocondrial, ribozomi proprii, ARN, proteine, metaboliți cu greutate moleculară mică.
Membrana exterioară conține mai mult de 80% lipide și mai puțin de 20% proteine, în timp ce membrana interioară conține opusul. Printre proteinele membranei exterioare sunt porine care formează pori. Prin intermediul lor, din hialoplasmă provin molecule de o anumită dimensiune. Ca urmare, membrana exterioară are o permeabilitate nespecifică. Receptorii speciali și proteinele canalului sunt localizați în zona locurilor de contact. Membrana interioară formează crestae. Pe ele, din partea matricei mitocondriale, sunt localizate corpuri în formă de ciupercă - componente proteice care realizează sinteza ATP.
Simptomele majorității bolilor mitocondriale apar odată cu vârsta, ceea ce se datorează probabil acumulării de mutații efectuate de H 2 O 2 și O 2 . pentru că aceste substante sunt generate in cantitati maxime in timpul fosforilarii oxidative, organele care au cel mai mult nevoie de energie mitocondriala (SNC, inima, muschii scheletici, rinichi, ficat, insulițe Langerhans).
Ciclul de viață al mitocondriilor este de aproximativ 10 zile, distrugerea lor are loc prin autofagie, iar organele muritoare sunt înlocuite cu altele noi, care se formează prin relansarea celor anterioare. Replicarea ADN-ului mitocondrial are loc în orice fază a ciclului celular, indiferent de ADN-ul nuclear.
Funcții mitocondriale:
1. Centrul respirator și energetic al celulei - absorb oxigenul necesar pentru a treia etapă (aerobă) de disimilare.
2. Sinteza lor ADN, ARN, părți de proteine.
Ribozomi.
Ribozomi– organele sens general care nu au o structură membranară. locul sintezei proteinelor. D=15-35 nm. Se găsesc în citoplasmă, plastide și mitocondrii. Majoritatea ribozomilor se formează în nucleolul nucleului - sub formă de 2 subunități care părăsesc nucleul și se combină pentru a forma un ribozom, care constă dintr-o subunitate mare și mică. Fiecare subunitate conține ARNr și o proteină.
Ribozomii, care se conectează cu ARNm în timpul sintezei proteinelor, formează polizomi (poliribozomi).
Ribozomii sunt asociați cu ER granular, sintetizează proteine secretoare în mod normal sau rămân în membranele celulei.
Funcțiile ribozomului - sinteza proteinei.
Plastide.
plastide - Organele de importanță generală în celule vegetale, euglena verde (protozoare). Se disting: cloroplaste, cromoplaste, leucoplaste.
Cloroplaste - plastide verzi înconjurate de două membrane. Strat interior membranele din cavitatea cloroplastului formează saci plate - tilocoizi. Au formă de disc, formează un teanc de ≈ 50 de bucăți, se numesc stivele granule. Cloroplastul conține 40-60 de granule. Spațiul dintre tilacoizi este umplut cu stroma (matricea) cloroplastei din proteine, lipide, carbohidrați, enzime, ATP, ADN, ARN, ribozomi. Cloroplastele se formează din proplastide - corpuri mici nediferențiate. Cloroplastele se reproduc prin diviziune. Cloroplastele se pot transforma in cromoplaste si leucoplaste toamna.
Funcțiile cloroplastelor:
1. Fotosinteza
2. Sinteza proteinelor proprii.
leucoplaste - plastide incolore în părțile necolorate ale plantelor: celule, endosperm de semințe, tuberculi, rădăcinoase. Acestea sunt organite cu două membrane, în interiorul a 2-3 excrescențe. Forma este rotunjită. Ele trec în cloroplaste și cromoplaste.
Funcţie:
1. Acumularea de nutrienți - amidon, grăsimi, proteine.
Cromoplaste - plastide cu două membrane de formă filamentoasă, lamelară sau altă formă. Culoare galben-roșu-maro-portocaliu datorită pigmenților carotenoide. Se găsește în celulele fructifere. Cromoplastele sunt etapa finală în dezvoltarea plastidelor - cloroplastele și leucoplastele se transformă în ele.
Funcţie:
1. În celulă: joacă rolul unui fel de filtru de lumină pentru cloroplaste în procesul de fotosinteză; loc de sinteza si localizare a pigmentilor vegetali.
2. Culoarea corolelor florilor - atragerea insectelor polenizatoare.
3. Colorarea fructelor - atracția animalelor - dispersarea semințelor.
Centrul celular.
Centrul celular(centrizom) - un organoid al unei structuri non-membranare în celulele animalelor și plantelor inferioare. Este situat în apropierea nucleului, este format din 2 centrioli - corpuri cilindrice lungi de 500 nm, situate perpendicular între ele. Pereții sunt formați din 9 tripleți de microtubuli. Centrizomul este înconjurat de o citoplasmă mai ușoară, centrosferă.
Funcţie:
Centru de formare a microtubulilor fusului. În timpul diviziunii celulare, centrizomul este împărțit în 2 părți și un centrisol se deplasează la un pol al celulei, celălalt la celălalt și formează fusuri de diviziune, asigurând o distribuție uniformă a cromozomilor între celulele fiice.













