Carbon carbon. Element carbon. proprietățile carbonului. Aplicarea carbonului. Compuși anorganici de carbon
Unul dintre cele mai uimitoare elemente care poate forma o mare varietate de compuși de natură organică și anorganică este carbonul. Acest element este atât de neobișnuit în proprietățile sale, încât până și Mendeleev i-a prezis un viitor grozav, vorbind despre caracteristici care nu au fost încă dezvăluite.
Ulterior acest lucru a fost practic confirmat. A devenit cunoscut faptul că este principalul element biogen al planetei noastre, care face parte din absolut toate ființele vii. În plus, poate exista sub forme radical diferite în toate privințele, dar în același timp constau numai din atomi de carbon.
În general, această structură are multe caracteristici și vom încerca să ne ocupăm de ele în cursul articolului.
Carbonul: formula și poziția în sistemul de elemente
În sistemul periodic, elementul carbon este situat în grupa IV (conform noului model în 14), subgrupa principală. Numărul său atomic este 6 și greutatea sa atomică este 12,011. Denumirea elementului cu semnul C indică numele său în latină - carboneum. Sunt cateva diferite formeîn care există carbon. Prin urmare, formula sa este diferită și depinde de modificarea specifică.
Cu toate acestea, există, desigur, o denumire specifică pentru scrierea ecuațiilor de reacție. În general, când se vorbește despre o substanță în forma sa pură, aceasta este acceptată formulă moleculară carbon C, fără indexare.
Istoria descoperirii elementelor
Prin el însuși, acest element este cunoscut încă din antichitate. La urma urmei, unul dintre cele mai importante minerale din natură este cărbunele. Prin urmare, pentru grecii antici, romani și alte naționalități, el nu era un secret.
Pe lângă această varietate, s-au folosit și diamante și grafit. Au existat multe situații confuze cu acesta din urmă pentru o lungă perioadă de timp, deoarece adesea, fără analiză a compoziției, astfel de compuși au fost luați pentru grafit, cum ar fi:
- plumb argintiu;
- carbură de fier;
- sulfură de molibden.
Toate au fost vopsite în negru și, prin urmare, considerate a fi grafit. Mai târziu, această neînțelegere a fost clarificată și această formă de carbon a devenit ea însăși.
Din 1725, diamantele au devenit de mare importanță comercială, iar în 1970, tehnologia obținerii lor artificial a fost stăpânită. Din 1779, datorită lucrării lui Karl Scheele, Proprietăți chimice pe care carbonul îl prezintă. Acesta a fost începutul unei serii descoperiri majoreîn domeniul acestui element și a devenit baza pentru a afla toate caracteristicile sale unice.

Izotopii carbonului și distribuția în natură
În ciuda faptului că elementul luat în considerare este unul dintre cele mai importante biogene, conținutul său total în masa scoarței terestre este de 0,15%. Acest lucru se datorează faptului că este supus unei circulații constante, ciclului natural din natură.
În general, există mai mulți compuși minerali care conțin carbon. Acestea sunt rase naturale precum:
- dolomite și calcare;
- antracit;
- șisturi petroliere;
- gaz natural;
- cărbune;
- ulei;
- cărbune brun;
- turbă;
- bitum.
În plus, nu ar trebui să uităm de ființele vii, care sunt doar un depozit de compuși de carbon. La urma urmei, au format proteine, grăsimi, carbohidrați, acizi nucleiciși, prin urmare, cele mai vitale molecule structurale. În general, în conversia greutății corporale uscate din 70 kg, 15 cade pe un element pur. Și așa este cu fiecare persoană, ca să nu mai vorbim de animale, plante și alte creaturi.
Dacă luăm în considerare și apa, adică hidrosfera în ansamblu și atmosfera, atunci există un amestec carbon-oxigen exprimat prin formula CO 2 . Dioxid sau dioxid de carbon este unul dintre principalele gaze care alcătuiesc aerul. În această formă, fracția de masă a carbonului este de 0,046%. În apele oceanelor se dizolvă și mai mult dioxid de carbon.
Masa atomică a carbonului ca element este 12,011. Se știe că această valoare se calculează ca medie aritmetică între greutățile atomice ale tuturor speciilor izotopice existente în natură, ținând cont de abundența acestora (în procente). Acesta este și cazul substanței în cauză. Există trei izotopi principali în care se găsește carbonul. Acest:
- 12 C - fracția sa de masă în marea majoritate este de 98,93%;
- 13C - 1,07%;
- 14 C - radioactiv, timp de înjumătățire 5700 ani, emițător beta stabil.
În practica determinării vârstei geocronologice a probelor, este utilizat pe scară largă izotopul radioactiv 14 C, care este un indicator datorită perioadei lungi de dezintegrare.

Modificări alotropice ale unui element
Carbonul este un element care există ca substanță simplă sub mai multe forme. Adică, este capabil să formeze cel mai mare număr de modificări alotropice cunoscute astăzi.
1. Variații cristaline – există sub formă de structuri puternice cu rețele regulate de tip atomic. Acest grup include soiuri precum:
- diamante;
- fulerene;
- grafiti;
- carabine;
- lonsdaleiți;
- si tuburi.
Toate diferă prin rețele, în nodurile cărora există un atom de carbon. De aici, proprietățile complet unice, nu similare, atât fizice, cât și chimice.
2. Forme amorfe - sunt formate de un atom de carbon, care face parte din unii compuși naturali. Adică, acestea nu sunt soiuri pure, ci cu impurități ale altor elemente în cantități mici. Acest grup include:
- Cărbune activ;
- piatră și lemn;
- funingine;
- nanofuma de carbon;
- antracit;
- carbon sticlos;
- tip tehnic de substanță.
Ele sunt, de asemenea, unite de caracteristicile structurale ale rețelei cristaline, care explică și manifestă proprietăți.
3. Compușii carbonului sub formă de clustere. O astfel de structură, în care atomii sunt închiși într-o conformație specială gol din interior, umplut cu apă sau nucleele altor elemente. Exemple:
- nanoconuri de carbon;
- astralene;
- dicarbon.

Proprietățile fizice ale carbonului amorf
Datorită varietății mari de modificări alotrope, evidențiați unele comune proprietăți fizice dificil pentru carbon. Este mai ușor să vorbim despre o anumită formă. De exemplu, carbonul amorf are următoarele caracteristici.
- În centrul tuturor formelor se află soiurile cu granulație fină de grafit.
- Capacitate termică mare.
- Proprietăți conductoare bune.
- Densitatea carbonului este de aproximativ 2 g/cm3.
- Când este încălzit peste 1600 0 C, are loc o tranziție la forme de grafit.
Soiurile de funingine și piatră sunt utilizate pe scară largă în scopuri de inginerie. Ele nu sunt o manifestare a modificării carbonului în forma sa pură, dar îl conțin în cantități foarte mari.
Carbon cristalin
Există mai multe opțiuni în care carbonul este o substanță care formează cristale regulate de diferite tipuri, în care atomii sunt legați în serie. Ca urmare, se formează următoarele modificări.
- - cubic, în care sunt conectate patru tetraedre. Ca rezultat, toate legăturile chimice covalente ale fiecărui atom sunt maxim saturate și puternice. Astfel se explică proprietățile fizice: densitatea carbonului este de 3300 kg/m 3 . Duritate mare, capacitate termică scăzută, lipsă de conductivitate electrică - toate acestea sunt rezultatul structurii rețelei cristaline. Există diamante obținute tehnic. Ele se formează în timpul tranziției grafitului la următoarea modificare sub influența temperaturii ridicate și a unei anumite presiuni. În general, este la fel de mare ca puterea - aproximativ 3500 0 С.
- Grafit. Atomii sunt aranjați similar cu structura substanței anterioare, cu toate acestea, doar trei legături sunt saturate, iar a patra devine mai lungă și mai puțin puternică, conectează „straturile” inelelor hexagonale ale rețelei. Ca rezultat, se dovedește că grafitul este o substanță neagră moale și grasă la atingere. Are o conductivitate electrică bună și un punct de topire ridicat - 3525 0 C. Este capabil de sublimare - sublimare din stare solidă în stare gazoasă, ocolind starea lichidă (la o temperatură de 3700 0 C). Densitatea carbonului este de 2,26 g/cm3, ceea ce este mult mai mică decât cea a diamantului. Aceasta explică proprietățile lor diferite. Datorită structurii stratificate a rețelei cristaline, este posibil să se utilizeze grafit pentru fabricarea minelor de creion. Când sunt transportate peste hârtie, solzii se desprind și lasă un semn negru pe hârtie.
- Fulerene. Au fost deschise abia în anii 80 ai secolului trecut. Sunt modificări în care carbonii sunt interconectați într-o structură închisă convexă specială, cu un gol în centru. Și forma unui cristal - un poliedru, organizarea corectă. Numărul de atomi este par. Cea mai cunoscută formă de fuleren C 60 . În timpul cercetărilor au fost găsite mostre dintr-o substanță similară:
- meteoriți;
- sedimente de fund;
- folgurite;
- shungite;
- spațiul cosmic, unde erau conținute sub formă de gaze.
Toate soiurile de carbon cristalin au un important valoare practică, deoarece au o serie de proprietăți utile în inginerie.

Activitate chimică
Carbonul molecular prezintă reactivitate scăzută datorită configurației sale stabile. Poate fi forțat să intre în reacții numai prin furnizarea de energie suplimentară atomului și forțând electronii de la nivelul exterior să se evapore. În acest moment, valența devine 4. Prin urmare, în compuși, are o stare de oxidare de + 2, + 4, - 4.
Aproape toate reacțiile cu substanțe simple, atât metale, cât și nemetale, au loc sub influența temperaturilor ridicate. Elementul în cauză poate fi atât un agent oxidant, cât și un agent reducător. Cu toate acestea, aceste din urmă proprietăți sunt deosebit de pronunțate în ea și pe aceasta se bazează utilizarea sa în industria metalurgică și în alte industrii.
În general, capacitatea de a intra într-o interacțiune chimică depinde de trei factori:
- dispersia carbonului;
- modificare alotropică;
- temperatura de reactie.
Astfel, în unele cazuri, apare interacțiunea cu următoarele substanțe:
- nemetale (hidrogen, oxigen);
- metale (aluminiu, fier, calciu și altele);
- oxizi metalici și sărurile lor.
Nu reacționează cu acizi și alcalii, foarte rar cu halogeni. Cea mai importantă dintre proprietățile carbonului este capacitatea de a forma lanțuri lungi între ele. Se pot închide într-un ciclu, formează ramuri. Așa se formează compușii organici, care astăzi se numără la milioane. Baza acestor compuși sunt două elemente - carbon, hidrogen. În compoziție pot fi incluși și alți atomi: oxigen, azot, sulf, halogeni, fosfor, metale și altele.

Compușii de bază și caracteristicile acestora
Există mulți compuși diferiți care conțin carbon. Formula celor mai faimoase dintre ele este CO 2 - dioxid de carbon. Cu toate acestea, pe lângă acest oxid, există și CO - monoxid sau monoxid de carbon, precum și suboxidul C 3 O 2.
Dintre sărurile care conțin acest element, cei mai des întâlniți sunt carbonații de calciu și magneziu. Deci, carbonatul de calciu are mai multe sinonime în nume, deoarece apare în natură sub formă de:
- cretă;
- marmură;
- calcar;
- dolomită.
Importanța carbonaților de metal alcalino-pământos se manifestă prin faptul că aceștia sunt participanți activi la procesele de formare a stalactitelor și stalagmitelor, precum și a apelor subterane.
Acidul carbonic este un alt compus care formează carbon. Formula sa este H2CO3. Cu toate acestea, în forma sa obișnuită, este extrem de instabilă și se descompune imediat în dioxid de carbon și apă în soluție. Prin urmare, doar sărurile sale sunt cunoscute, și nu ea însăși, ca soluție.
Halogenurile de carbon - se obțin în principal indirect, deoarece sinteza directă are loc doar la temperaturi foarte ridicate și cu un randament redus de produs. Una dintre cele mai comune - CCL 4 - tetraclorura de carbon. Un compus toxic care poate provoca otrăvire dacă este inhalat. Obținut prin reacții de substituție fotochimică radicală în metan.
Carburele metalice sunt compuși de carbon în care prezintă o stare de oxidare de 4. Sunt posibile și asociații cu bor și siliciu. Proprietatea principală a carburilor unor metale (aluminiu, wolfram, titan, niobiu, tantal, hafniu) este rezistența ridicată și conductivitate electrică excelentă. Carbura de bor B 4 C este una dintre cele mai dure substanțe după diamant (9,5 conform lui Mohs). Acești compuși sunt utilizați în inginerie, precum și în industria chimică, ca surse pentru producerea de hidrocarburi (carbura de calciu cu apă duce la formarea de acetilenă și hidroxid de calciu).
Multe aliaje metalice sunt realizate folosind carbon, crescând astfel în mod semnificativ calitatea și specificații(oțelul este un aliaj de fier și carbon).
Numeroși compuși organici de carbon merită o atenție deosebită, în care carbonul este un element fundamental capabil să se combine cu aceiași atomi în lanțuri lungi de diferite structuri. Acestea includ:
- alcani;
- alchene;
- arene;
- proteine;
- carbohidrați;
- acizi nucleici;
- alcooli;
- acizi carboxilici și multe alte clase de substanțe.
Aplicarea carbonului
Importanța compușilor de carbon și a modificărilor sale alotropice în viața umană este foarte mare. Puteți numi câteva dintre cele mai globale industrii pentru a clarifica faptul că acest lucru este adevărat.
- Acest element formează toate tipurile de combustibil organic din care o persoană primește energie.
- Industria metalurgică folosește carbonul ca cel mai puternic agent reducător pentru a obține metale din compușii lor. Carbonații sunt, de asemenea, folosiți pe scară largă aici.
- Construcțiile și industria chimică consumă o cantitate imensă de compuși de carbon pentru sinteza de noi substanțe și obținerea produselor necesare.

De asemenea, puteți numi astfel de sectoare ale economiei ca:
- industria nucleară;
- afaceri de bijuterii;
- echipamente tehnice (lubrifianți, creuzete termorezistente, creioane etc.);
- determinarea vârstei geologice a rocilor - trasor radioactiv 14 C;
- carbonul este un adsorbant excelent, ceea ce face posibilă utilizarea lui pentru fabricarea filtrelor.
Ciclu în natură
Masa de carbon găsită în natură este inclusă într-un ciclu constant, care se efectuează ciclic în fiecare secundă globul. Astfel, sursa atmosferică de carbon - CO 2 - este absorbită de plante și eliberată de toate ființele vii în procesul de respirație. Odată ajuns în atmosferă, este absorbit din nou, și astfel ciclul nu se oprește. În același timp, moartea reziduurilor organice duce la eliberarea carbonului și la acumularea acestuia în pământ, de unde este apoi din nou absorbit de organismele vii și eliberat în atmosferă sub formă de gaz.
Structura unui diamant (dar)și grafit (b)
Carbon(Latin carboneum) - DE LA, element chimic grupa IV sistem periodic Mendeleev, număr atomic 6, masă atomică 12.011. Se găsește în natură sub formă de cristale de diamant, grafit sau fullerenă și alte forme și face parte din organice (cărbune, petrol, organisme animale și vegetale etc.) și nu materie organică(calcar, bicarbonat de sodiu etc.). Carbonul este larg răspândit, dar conținutul său în Scoarta terestra doar 0,19%.
Carbonul este utilizat pe scară largă sub formă de substanțe simple. Pe lângă diamantele prețioase, care fac obiectul bijuteriilor, mare importanță au diamante industriale – pentru fabricarea sculelor de șlefuit și tăiere. Cărbunele și alte forme amorfe de carbon sunt utilizate pentru decolorare, purificare, adsorbție de gaze, în domeniile de tehnologie în care sunt necesari adsorbanți cu suprafață dezvoltată. Carburele, compușii de carbon cu metale, precum și cu bor și siliciu (de exemplu, Al 4 C 3, SiC, B 4 C) se caracterizează prin duritate ridicată și sunt utilizați la fabricarea sculelor abrazive și tăietoare. Carbonul este prezent în oțeluri și aliaje în stare elementară și sub formă de carburi. Saturarea suprafeței pieselor turnate din oțel cu carbon la temperatură ridicată (cementare) crește semnificativ duritatea suprafeței și rezistența la uzură.
Referință istorică
Grafitul, diamantul și carbonul amorf sunt cunoscute încă din antichitate. Se știe de mult că alte materiale pot fi marcate cu grafit, iar chiar numele „grafit”, care provine din cuvântul grecesc care înseamnă „a scrie”, a fost propus de A. Werner în 1789. Cu toate acestea, istoria grafitului este confuz, adesea substanțe cu proprietăți fizice externe similare au fost confundate cu acesta, cum ar fi molibdenitul (sulfura de molibden), considerat la un moment dat grafit. Printre alte denumiri de grafit, sunt cunoscute „plumb negru”, „carbură de fier”, „plumb argintiu”.
În 1779, K. Scheele a descoperit că grafitul poate fi oxidat cu aer pentru a forma dioxid de carbon. Pentru prima dată, diamantele și-au găsit utilizare în India, iar în Brazilia, pietrele prețioase au căpătat importanță comercială în 1725; zăcăminte din Africa de Sud au fost descoperite în 1867.
În secolul al XX-lea Principalii producători de diamante sunt Africa de Sud, Zair, Botswana, Namibia, Angola, Sierra Leone, Tanzania și Rusia. Diamantele artificiale, a căror tehnologie a fost creată în 1970, sunt produse în scopuri industriale.
Proprietăți
Sunt cunoscute patru modificări cristaline ale carbonului:
- grafit,
- diamant,
- carabină,
- lonsdaleite.
Grafit- gri-negru, opac, gras la atingere, solz, masa foarte moale cu luciu metalic. La temperatura camerei și presiunea normală (0,1 MN/m2, sau 1 kgf/cm2), grafitul este stabil termodinamic.
Diamant- substanta foarte solida, cristalina. Cristalele au o rețea cubică centrată pe față. La temperatura camerei și la presiune normală, diamantul este metastabil. O transformare notabilă a diamantului în grafit se observă la temperaturi peste 1400°C în vid sau într-o atmosferă inertă. La presiunea atmosferică și la o temperatură de aproximativ 3700 ° C, grafitul se sublimează.
Carbonul lichid poate fi obținut la presiuni de peste 10,5 MN/m2 (105 kgf/cm2) și la temperaturi peste 3700°C. Carbonul solid (cocs, funingine, cărbune) se caracterizează și printr-o stare cu o structură dezordonată - așa-numitul carbon „amorf”, care nu este o modificare independentă; structura sa se bazează pe structura grafitului cu granulație fină. Încălzirea unor varietăți de carbon „amorf” peste 1500-1600 ° C fără aer determină transformarea lor în grafit.
Proprietățile fizice ale carbonului „amorf” depind foarte mult de dispersia particulelor și de prezența impurităților. Densitatea, capacitatea termică, conductibilitatea termică și conductibilitatea electrică a carbonului „amorf” este întotdeauna mai mare decât grafitul.
Carabină obtinut artificial. Este o pulbere fin cristalina de culoare neagra (densitate 1,9-2 g/cm3). Construit din lanțuri lungi de atomi DIN așezate paralel unul cu celălalt.
Lonsdaleite găsit în meteoriți și obținut artificial; structura și proprietățile sale nu au fost definitiv stabilite.
| Proprietățile carbonului | ||
|---|---|---|
| numar atomic | 6 | |
| Masă atomică | 12,011 | |
| Izotopi: | grajd | 12, 13 |
| instabil | 8, 9, 10, 11, 14, 15, 16, 17, 18, 19, 20, 21, 22 | |
| Temperatură de topire | 3550°С | |
| Temperatura de fierbere | 4200°С | |
| Densitate | 1,9-2,3 g / cm 3 (grafit) 3,5-3,53 g/cm 3 (diamant) |
|
| Duritate (Mohs) | 1-2 | |
| Conținut în scoarța terestră (masă) | 0,19% | |
| Stări de oxidare | -4; +2; +4 | |
Aliaje
Oţel
Cocsul este folosit în metalurgie ca agent reducător. Cărbune - în forje, pentru obținerea prafului de pușcă (75% KNO 3 + 13% C + 12% S), pentru absorbția gazelor (adsorbție), precum și în viața de zi cu zi. Funinginea este folosită ca umplutură de cauciuc, pentru fabricarea vopselelor negre - cerneală de imprimare și cerneală, precum și în celule galvanice uscate. Carbonul sticlos este folosit pentru fabricarea de echipamente pentru medii extrem de agresive, precum și în aviație și astronautică.
Cărbunele activat absoarbe substanțe nocive din gaze și lichide: umplu măști de gaz, sisteme de purificare, este folosit în medicină pentru otrăvire.
Carbonul este baza tuturor substanțelor organice. Fiecare organism viu este alcătuit în mare parte din carbon. Carbonul este baza vieții. Sursa de carbon pentru organismele vii este de obicei CO 2 din atmosferă sau apă. Ca urmare a fotosintezei, ea intră în lanțurile trofice biologice în care viețuitoarele se mănâncă unele pe altele sau rămășițele una ale altora și, prin urmare, extrag carbon pentru a-și construi propriul corp. Ciclul biologic al carbonului se termină fie cu oxidarea și revenirea în atmosferă, fie cu eliminarea sub formă de cărbune sau petrol.
Utilizarea izotopului radioactiv 14 C a contribuit la succesul biologiei moleculare în studierea mecanismelor de biosinteză și transmitere a proteinelor informații ereditare. Determinarea activității specifice a 14 C în resturile organice carbonice face posibilă aprecierea vârstei acestora, care este utilizată în paleontologie și arheologie.
Surse
| Elemente și materiale chimice |
||
|---|---|---|
| Elemente chimice | Azot. argon. Hidrogen. Heliu. Fier . Calciu. Oxigen. Siliciu. Magneziu. Mangan. | |
Carbonul este probabil unul dintre cele mai impresionante elemente ale chimiei de pe planeta noastră, care are capacitatea unică de a forma o mare varietate de legături organice și anorganice diferite.
Într-un cuvânt, compușii de carbon, care au caracteristici unice, stau la baza vieții pe planeta noastră.
Ce este carbonul

În tabelul chimic D.I. Mendeleev, carbonul se află la al șaselea număr, este inclus în al 14-lea grup și poartă denumirea „C”.
Proprietăți fizice
Acesta este un compus de hidrogen care face parte dintr-un grup de molecule biologice, Masă molarăși a cărui greutate moleculară este de 12,011, punctul de topire este de 3550 de grade.

Starea de oxidare a acestui element poate fi: +4, +3, +2, +1, 0, -1, -2, -3, -4, iar densitatea este de 2,25 g/cm3.
În starea de agregare, carbonul este un solid, iar rețeaua cristalină este atomică.
Carbonul are următoarele modificări alotropice:
- grafit;
- fullerenă;
- carabină.
Structura atomului
Un atom al unei substanțe are o configurație electronică de forma - 1S 2 2S 2 2P 2. La nivelul exterior, un atom are 4 electroni situati in doi orbitali diferiti.

Dacă luăm starea excitată a elementului, atunci configurația sa devine 1S 2 2S 1 2P 3 .
În plus, un atom al unei substanțe poate fi primar, secundar, terțiar și cuaternar.
Proprietăți chimice

În condiții normale, elementul este inert și interacționează cu metale și nemetale la temperaturi ridicate:
- interacționează cu metalele, rezultând formarea de carburi;
- reacționează cu fluorul (halogen);
- la temperaturi ridicate interacționează cu hidrogenul și sulful;
- când temperatura crește, asigură recuperarea metalelor și nemetalelor din oxizi;
- la 1000 de grade interactioneaza cu apa;
- se aprinde când temperatura crește.
Obținerea de carbon
Carbonul în natură poate fi găsit sub formă de grafit negru sau, ceea ce este foarte rar, sub formă de diamant. Grafitul nenatural se obține prin reacția cocsului cu silice.

Și diamantele artificiale sunt obținute prin aplicarea de căldură și presiune împreună cu catalizatori. Deci metalul este topit, iar diamantul rezultat iese sub formă de precipitat.

Adaosul de azot produce diamante gălbui, în timp ce borul produce diamante albăstrui.
Istoria descoperirilor
Carbonul a fost folosit de oameni din cele mai vechi timpuri. Grecii cunoșteau grafitul și cărbunele, iar diamantele au fost găsite pentru prima dată în India. Apropo, oamenii au luat adesea compuși cu aspect similar ca grafitul. Dar chiar și în ciuda acestui fapt, grafitul a fost folosit pe scară largă pentru scris, deoarece chiar și cuvântul „grapho” cu greacă se traduce prin „scrie”.

În prezent, grafitul este folosit și în scris, în special, poate fi găsit în creioane. La începutul secolului al XVIII-lea, comerțul cu diamante a început în Brazilia, au fost descoperite multe zăcăminte și, deja, în a doua jumătate a secolului al XX-lea, oamenii au învățat cum să obțină pietre nenaturale.
Pe în prezent diamantele artificiale sunt folosite în industrie, iar diamantele reale sunt folosite în industria de bijuterii.
Rolul carbonului în corpul uman
Carbonul intră în corpul uman cu alimente, în timpul zilei - 300 g. Iar cantitatea totală de materie din corpul uman este de 21% din greutatea corpului.

Din acest element sunt formați din 2/3 mușchi și 1/3 oase.Și gazul este îndepărtat din corp împreună cu aerul expirat sau cu uree.
Nu valoreaza nimic: fără această substanță, viața pe Pământ este imposibilă, deoarece carbonul formează legături care ajută organismul să lupte cu influența distructivă a lumii înconjurătoare.
Astfel, elementul este capabil să facă lanțuri lungi sau inele de atomi, care stau la baza multor alte legături importante.
Găsirea carbonului în natură
Elementul și compușii săi pot fi găsite peste tot. În primul rând, observăm că substanța reprezintă 0,032% din cantitatea totală a scoarței terestre.

Un singur element poate fi găsit în cărbune.Și elementul cristalin se află în modificări alotropice. De asemenea, cantitatea de dioxid de carbon din aer este în continuă creștere.
O concentrație mare a unui element în mediu inconjurator pot fi găsite ca compuși cu diverse elemente. De exemplu, dioxidul de carbon este conținut în aer într-o cantitate de 0,03%. Minerale precum calcarul sau marmura conțin carbonați.
Toate organismele vii poartă compuși de carbon împreună cu alte elemente.În plus, rămășițele organismelor vii devin depozite precum petrol, bitum.
Aplicarea carbonului

Compușii acestui element sunt folosiți pe scară largă în toate sferele vieții noastre și pot fi enumerați pe termen nelimitat, așa că vom indica câțiva dintre ei:
- grafitul este folosit în mine de creion și electrozi;
- diamantele și-au găsit aplicația largă în bijuterii și găurire;
- carbonul este folosit ca agent reducător pentru a îndepărta elemente precum minereul de fier și siliciul;
- cărbunele activ, compus în principal din acest element, este utilizat pe scară largă în domeniul medical, industrie și gospodărie.
Este imposibil să descriem pe scurt ce este carbonul. La urma urmei, este baza vieții. Acest element este prezent în toți compușii organici și numai el poate forma molecule de ADN din milioane de atomi. Proprietățile sale sunt numeroase, așa că merită să vorbim despre el mai detaliat.
Formula, notație, caracteristici
Acest element, situat în tabel sub numărul de serie șase, este notat cu simbolul „C”. Electronic formula structurala carbonul arată astfel: 1s 2 2s 2 2p 2 . Masa sa este de 12,0107 amu. Această substanță are:
- Două electron nepereche in stare de baza. Prezintă valență II.
- Patru electroni nepereche în stare excitată. Prezintă valență IV.
Trebuie remarcat faptul că o anumită masă de carbon este conținută în scoarța terestră. 0,023% mai exact. Se acumulează în principal în partea superioară, în biosferă. Cea mai mare parte a masei de carbon din litosferă se acumulează în dolomiți și calcare, sub formă de carbonați.
caracteristici fizice
Deci, ce este carbonul? Aceasta este o substanță care există într-o mare varietate de modificări alotropice, iar proprietățile lor fizice pot fi enumerate pentru o lungă perioadă de timp. Și diversitatea substanțelor este determinată de capacitatea carbonului de a forma legături chimice de diferite tipuri.
Dar proprietățile carbonului ca substanță simplă? Ele pot fi rezumate după cum urmează:
- În condiții normale, densitatea este de 2,25 g/cm³.
- Punctul de fierbere este de 3506,85 °C.
- Capacitate de căldură molară - 8,54 J / (K.mol).
- Temperatura critica faza de tranzitie(când gazul nu se condensează la nicio presiune) - 4130 K, 12 MPa.
- Volumul molar 5,3 cm³/mol.
De asemenea, merită enumerate modificările carbonului.
Dintre substanțele cristaline, cele mai cunoscute sunt: diamantul, carbina, grafitul, nanodiamantul, fullerita, lonsdaleitul, fulerenul și fibrele de carbon.
Formațiunile amorfe includ: lemn, fosil și cărbune activ, antracit, cocs, carbon sticlos, funingine, negru de fum și nanospumă.
Dar niciuna dintre cele de mai sus nu este o formă pură alotropică a substanței în cauză. Este doar compuși chimici conţinând concentraţii mari de carbon.

Structura
Interesant este că orbitalii de electroni ai atomului de carbon nu sunt la fel. Au geometrii diferite. Totul depinde de gradul de hibridizare. Există trei geometrii cel mai frecvent întâlnite:
- tetraedric. Se formează atunci când sunt amestecați trei electroni p și unul s. Această geometrie a atomului de carbon este observată în lonsdaleit și diamant. Metanul și alte hidrocarburi au o structură similară.
- Trigonală. Această geometrie este formată dintr-un amestec de doi orbitali de electroni p și unul s. Un alt element p nu participă la hibridizare, dar este implicat în formarea legăturilor π cu alți atomi. Această structură este caracteristică fenolului, grafitului și altor modificări.
- Digonală. Această structură se formează datorită amestecării electronilor s și p (câte unul). Interesant este că norii de electroni arată ca niște gantere asimetrice. Ele sunt întinse în această direcție. Încă doi electroni p formează notoriile legături π. Această geometrie este tipică pentru carabină.
Nu cu mult timp în urmă, în 2010, oamenii de știință de la Universitatea din Nottingham au descoperit un compus în care patru atomi deodată se aflau în același plan. Numele său este dilitio metandiu monomeric.
molecule
Merită să vorbim despre ele separat. Atomii substanței în discuție se pot combina, în urma cărora se formează molecule complexe de carbon. Din Na, C2 și H2 saturat, între care există prea puțină atracție, se disting printr-o tendință de a se condensa în stare solidă. Moleculele de carbon pot rămâne în stare gazoasă doar dacă temperatura este menținută ridicată. În caz contrar, substanța se va întări instantaneu.
Cu ceva timp în urmă, în Statele Unite, la Laboratorul Național Berkeley, a fost sintetizată o nouă formă de carbon solid. Acesta este C36. Și molecula sa formează 36 de atomi de carbon. Substanța se formează împreună cu fulerenele C60. Acest lucru se întâmplă între doi electrozi de grafit, în condițiile unei flăcări cu descărcare în arc. Oamenii de știință sugerează că moleculele noii substanțe au proprietăți chimice și electrice interesante care nu au fost încă studiate.

Grafit
Acum putem vorbi mai detaliat despre cele mai faimoase modificări ale unei astfel de substanțe precum carbonul.
Grafitul este un mineral nativ cu o structură stratificată. Iată caracteristicile sale:
- Conduce electricitatea foarte bine.
- Este o substanță relativ moale datorită durității sale scăzute.
- Când este încălzit în absența aerului, prezintă stabilitate.
- Nu se topește.
- Uleos, alunecos la atingere.
- Grafitul natural conține 10-12% impurități. De regulă, aceștia sunt oxizi de fier și argilă.
Dacă vorbim despre proprietăți chimice, este de remarcat faptul că, cu săruri și metale alcaline, această substanță formează așa-numiții compuși de incluziune. Grafitul reacționează, de asemenea, cu oxigenul la temperaturi ridicate, ardend până la dioxid de carbon. Dar contactul cu acizii neoxidanți nu atrage niciun rezultat - această substanță pur și simplu nu se dizolvă în ei.
Grafitul este folosit în diverse domenii. Este folosit la fabricarea plăcilor de căptușire și a creuzetelor de topire, la producerea elementelor de încălzire și a electrozilor. Fără participarea grafitului, este imposibil să obțineți diamante sintetice. De asemenea, joacă rolul unui moderator de neutroni în reactoarele nucleare. Și, desigur, mine de creion sunt făcute din el, interferând cu caolinul. Și aceasta este doar o parte din zonele în care este utilizat.

Diamant
Este un mineral metastabil care poate exista pe termen nelimitat, datorită, într-o oarecare măsură, rezistenței și densității carbonului. Diamantul este cea mai dură substanță de pe scara Mohs și poate tăia cu ușurință prin sticlă.
Are conductivitate termică ridicată, dispersie, indice de refracție. Este rezistent la uzură, iar pentru a se topi, aveți nevoie de o temperatură de 4000 ° C și o presiune de aproximativ 11 GPa. Caracteristica sa este luminiscența, capacitatea de a străluci în diferite culori.
Aceasta este o substanță rară, deși comună. Vârsta mineralelor, conform anumitor studii, poate varia de la 100 de milioane la 2,5 miliarde de ani. Au fost descoperite diamante de origine extraterestră, posibil chiar pre-solară.
Acest mineral și-a găsit aplicația în bijuterii. Un diamant tăiat, numit strălucitor, este scump, dar statutul său de bijuterie și frumusețea l-au făcut și mai popular. Apropo, această substanță este folosită și la fabricarea frezelor, burghiilor, cuțitelor etc. Datorită durității sale excepționale, mineralul este folosit în multe industrii.

Carabină
În continuarea subiectului despre ce este carbonul, trebuie spuse câteva cuvinte despre o astfel de modificare precum carabina. Arată ca o pulbere cristalină fină neagră, are proprietăți semiconductoare. Obținut artificial la începutul anilor 60 de oamenii de știință sovietici.
Particularitatea acestei substanțe constă în creșterea conductivității sub influența luminii. De aceea a început să fie folosit în fotocelule.

Grafen
Acesta este primul cristal bidimensional din lume. Această modificare are o rigiditate mecanică mai mare decât grafitul și o conductivitate termică record de ~5,10 3 W m −1 .K −. Purtătorii de sarcină cu grafen au o mobilitate ridicată, motiv pentru care substanța are perspective în ceea ce privește utilizarea sa în diverse aplicații. Se crede că poate deveni baza viitoare a nanoelectronicii și chiar poate înlocui siliciul în circuitele integrate.
Grafenul se obține artificial, în laboratoare științifice. Pentru a face acest lucru, trebuie să recurgeți la desprinderea mecanică a straturilor de grafit dintr-o substanță foarte orientată. În acest fel, se obțin eșantioane de înaltă calitate cu mobilitatea necesară purtătorului.
Proprietățile sale nu au fost pe deplin studiate, dar oamenii de știință au observat deja ceva interesant. De exemplu, nu există cristalizare Winger în grafen. Și într-un strat dublu de materie, comportamentul electronilor seamănă cu cel caracteristic cristale lichide. Dacă se respectă parametrii de ciobire pe cristal, va fi posibilă obținerea unei nanostructuri în formă de cutie de grafen.

Toxicitate
Acest subiect merită remarcat la sfârșitul poveștii despre ce este carbonul. Faptul este că această substanță este eliberată în atmosferă împreună cu gazele de eșapament ale mașinilor. Și, de asemenea, la arderea cărbunelui, gazeificarea subterană și în multe alte procese.
Conținutul crescut al acestei substanțe în aer duce la creșterea numărului de boli. În special, acest lucru se aplică plămânilor și tractului respirator superior. Iar efectul toxic se datorează interacțiunii naturii radiațiilor cu particulele β, ceea ce duce la faptul că compoziție chimică moleculele se schimbă și proprietățile substanței - de asemenea.
Carbonul (C) este al șaselea element al tabelului periodic al lui Mendeleev cu o greutate atomică de 12. Elementul aparține nemetalelor și are un izotop de 14 C. Structura atomului de carbon stă la baza întregului Chimie organica, deoarece toate substanțele organice includ molecule de carbon.
atom de carbon
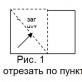
Poziția carbonului în tabelul periodic Mendeleev:
- al șaselea număr de serie;
- a patra grupă;
- a doua perioada.

Orez. 1. Poziția carbonului în tabelul periodic.
Pe baza datelor din tabel, putem concluziona că structura atomului elementului carbon include două învelișuri, pe care se află șase electroni. Valența carbonului, care face parte din substanțele organice, este constantă și egală cu IV. Aceasta înseamnă că există patru electroni în nivelul electronic exterior și doi în cel interior.
Dintre cei patru electroni, doi ocupă un orbital sferic 2s, iar ceilalți doi ocupă un orbital 2p în formă de gantere. În starea excitată, un electron se deplasează de la orbitalul 2s la unul dintre orbitalii 2p. Când un electron se deplasează de la un orbital la altul, se consumă energie.
Astfel, un atom de carbon excitat are patru electroni nepereche. Configurația sa poate fi exprimată prin formula 2s 1 2p 3 . Acest lucru face posibilă formarea a patru legături covalente cu alte elemente. De exemplu, într-o moleculă de metan (CH 4), carbonul formează legături cu patru atomi de hidrogen - o legătură între orbitalii s ai hidrogenului și carbonului și trei legături între orbitalii p ai carbonului și orbitalii s ai hidrogenului.
Schema structurii atomului de carbon poate fi reprezentată ca +6C) 2) 4 sau 1s 2 2s 2 2p 2.

Orez. 2. Structura atomului de carbon.
Proprietăți fizice
Carbonul apare în mod natural sub formă de roci. Sunt cunoscute mai multe modificări alotropice ale carbonului:
- grafit;
- diamant;
- carabină;
- cărbune;
- funingine.
Toate aceste substanțe diferă în structura rețelei cristaline. Cea mai dură substanță - diamantul - are o formă cubică de carbon. La temperaturi ridicate, diamantul se transformă în grafit cu structură hexagonală.

Orez. 3. Rețele cristaline de grafit și diamant.
Proprietăți chimice
Structura atomică a carbonului și capacitatea sa de a atașa patru atomi ai unei alte substanțe determină proprietățile chimice ale elementului. Carbonul reacționează cu metalele pentru a forma carburi:
- Ca + 2C → CaC 2;
- Cr + C → CrC;
- 3Fe + C → Fe 3 C.
Reacționează și cu oxizii metalici:
- 2ZnO + C → 2Zn + CO2;
- PbO + C → Pb + CO;
- SnO 2 + 2C → Sn + 2CO.
La temperaturi ridicate, carbonul reacţionează cu nemetale, în special cu hidrogenul, formând hidrocarburi:
C + 2H2 → CH4.
Cu oxigen, carbonul formează dioxid de carbon și monoxid de carbon:
- C + O2 → CO2;
- 2C + O 2 → 2CO.
Monoxidul de carbon se formează și atunci când interacționează cu apa.