De ce se crede că carbonul este baza chimică. Candidatul pentru cel mai durabil
„Carbonul apare în natură atât în stare liberă, cât și în stare combinată, în forme și forme foarte diferite. În stare liberă, carbonul este cunoscut sub cel puțin trei forme: cărbune, grafit și diamant. În starea de compuși, carbonul face parte din așa-numitele substanțe organice, adică. multe substanțe găsite în corpul fiecărei plante și animale. Este în formă dioxid de carbonîn apă și aer, dar sub formă de săruri de dioxid de carbon și reziduuri organice în sol și masă Scoarta terestra. Varietatea de substanțe care alcătuiesc corpul animalelor și plantelor este cunoscută de toată lumea. Ceară și ulei, terebentină și rășină, hârtie și proteine de bumbac, țesut celular vegetal și țesut muscular animal, acid tartric și amidon - toate acestea și multe alte substanțe incluse în țesuturile și sucurile plantelor și animalelor sunt compuși de carbon. Domeniul compușilor de carbon este atât de mare încât constituie o ramură specială a chimiei, adică. chimia compușilor carbonați sau, mai bine, hidrocarburici.
În primul rând, carbonul are o valență. În al doilea rând, carbonul este capabil să se unească pentru a forma lanțuri lungi sau chiar rețele tridimensionale, iar acestea sunt legături foarte puternice; cel mai extrem caz, în care fiecare atom de carbon se combină cu alți patru, formând o structură formată numai din pro-carbon: această structură este un diamant, cel mai solid. Fără a ajunge la asemenea extreme, este evident că asocierea a 2 sau 3 atomi de carbon va fi foarte puternică. În plus, cu aceste lanțuri sau rețele de carbon pot fi asociați și alți atomi, în special ceilalți atomi menționați mai sus, hidrogen, oxigen și azot.
Aceste cuvinte sunt de la D.I. Mendeleev servește ca o epigrafă detaliată a poveștii noastre despre un element vital - carbonul. Cu toate acestea, există aici o teză, cu care, din punctul de vedere al stiinta moderna despre substanță, se poate argumenta, dar mai multe despre asta mai jos.
Probabil destule degete pe mâini pentru a număra elemente chimice căruia nu i s-a consacrat cel puţin o carte ştiinţifică. Dar o carte independentă de știință populară - nu un fel de broșură pe 20 de pagini incomplete cu o copertă de hârtie de ambalaj, ci un volum destul de solid de aproape 500 de pagini - are un singur element în activ - carbonul.
Acest lucru creează o mulțime de conexiuni extrem de complexe, exact genul de complexitate care face viața posibilă. Un alt element va înlocui carbonul? Ar trebui să fie un element exuberant și ce ar forma un numar mare de alianţe cu sine şi cu alte elemente. Dintre cele mai comune cinci elemente, deja aruncăm heliul deoarece nu formează compuși. Hidrogenul și oxigenul au valențe de 1 și 2, deci pot forma doar compuși foarte simpli. Teoretic, ar putea exista un lanț format din atomi de oxigen, dar cel mai apropiat este peroxidul de hidrogen, format din doi atomi de hidrogen și doi atomi de oxigen.
În general, literatura despre carbon este cea mai bogată. Acestea sunt, în primul rând, toate cărțile și articolele chimiștilor organici fără excepție; în al doilea rând, aproape tot ce ține de polimeri; în al treilea rând, nenumărate publicații legate de combustibilii fosili; în al patrulea rând, o parte semnificativă a literaturii biomedicale...
Prin urmare, nu vom încerca să îmbrățișăm imensitatea (la urma urmei, nu întâmplător autorii cărții populare despre elementul nr. 6 l-au numit „Inepuizabil”), ci ne vom concentra doar asupra principalului lucru din punct principal - vom încerca să vedem carbonul din trei puncte de vedere.
Azotul are o valență de 3 și se poate lega cu alți trei atomi. Cu toate acestea, lanțurile mai multor atomi de azot sunt necunoscute. Așa că ne rămâne doar carbon, printre cele mai abundente 5 elemente din univers. Și nu există altul, care, deși nu atât de abundent, este suficient de abundent pentru a fi luat în considerare? Cel mai bun candidat este siliciul, un element foarte abundent în roci și, prin urmare, pe orice planetă terestră. Siliciul formează, odată cu oxigenul, siliciul care formează nisipurile plajelor. Și majoritatea rocilor sunt silicați, adică derivați ai dioxidului de siliciu.
Carbonul prin ochii unui chimist de cristal
Carbonul este unul dintre puținele elemente „fără familie, fără trib”. Istoria contactului uman cu această substanță datează din timpuri preistorice. Numele descoperitorului carbonului este necunoscut și, de asemenea, nu se știe care dintre formele de carbon elementar - diamant sau grafit - a fost descoperită mai devreme. Ambele s-au întâmplat cu mult prea mult timp în urmă. Un singur lucru poate fi afirmat cu siguranță: înainte de diamant și înainte de grafit, a fost descoperită o substanță, care cu câteva decenii în urmă era considerată a treia formă, amorfă, de carbon elementar - cărbune. Dar, în realitate, cărbunele, chiar și cărbunele, nu este carbon pur. Conține hidrogen, oxigen și urme de alte elemente. Adevărat, ele pot fi îndepărtate, dar chiar și atunci carbonul cărbunelui nu va deveni o modificare independentă a carbonului elementar. Aceasta a fost stabilită abia în al doilea sfert al secolului nostru. Analiza structurală a arătat că carbonul amorf este în esență același grafit. Aceasta înseamnă că nu este amorf, ci cristalin; doar cristalele sale sunt foarte mici și există mai multe defecte în ele. După aceea, au început să creadă că carbonul pe Pământ există în două forme elementare - sub formă de grafit și diamant.
În plus, siliciul are o valență de 4, la fel ca și carbonul. Poate exista viață pe bază de siliciu? Începând cu faptul că siliciul nu formează lanțuri sau rețele cu el însuși. Acesta este un atom prea mare pentru a putea forma astfel de structuri. Cele mai asemănătoare sunt structurile cu oxigen sub formă de compus între doi atomi de siliciu; În acest fel, se formează lanțuri mari și rețele tridimensionale, dar rezultatul este aproape întotdeauna o piatră.
Un mineral este un solid anorganic natural care are o compoziție chimică specifică și o structură cristalină. Pentru ca o substanță să fie un mineral, trebuie să aibă cele cinci caracteristici descrise în această definiție. Să analizăm fiecare dintre caracteristici. Un mineral apare în mod natural pe Pământ. Argintul, azbestul și talcul, care se găsesc în mod natural, sunt minerale. Oțelul și cimentul, care sunt substanțe fabricate, nu sunt minerale. Mineralul trebuie să fie anorganic sau să nu fie compus din viețuitoare sau resturi de viețuitoare.
Te-ai gândit vreodată la motivele „compartimentului” ascuțit al proprietăților care trece în a doua perioadă scurtă a tabelului periodic de-a lungul liniei care separă carbonul de azotul care îl urmează? Azotul, oxigenul, fluorul sunt gazoase în condiții normale. Carbon - sub orice formă - solid. Punctul de topire al azotului este minus 210,5°C, iar carbonul (sub formă de grafit sub presiune peste 100 atm.) este de aproximativ plus 4000°C...
Cuarțul, care reprezintă 11% din scoarța terestră, este un mineral. Cărbunele și petrolul, deși se găsesc în zăcăminte subterane naturale, nu sunt minerale deoarece se formează din rămășițele ființelor vii care există de mult timp. Mineralul este întotdeauna solid. Ca toate solidele, un mineral are propriul volum și formă. Știți de ce oxigenul, care apare în mod natural și este anorganic, nu este un mineral? Mineralul are o anumită compoziție chimică. Un mineral poate fi făcut dintr-o singură substanță sau element pur, cum ar fi aurul, cuprul sau sulful.
Dmitri Ivanovich Mendeleev a fost primul care a sugerat că această diferență se datorează structurii polimerice a moleculelor de carbon. El a scris: „Dacă carbonul ar forma o moleculă de C 2, ca O 2, ar fi un gaz”. Și mai departe: „Abilitatea atomilor de cărbune de a se combina între ei și de a da molecule complexe se manifestă în toți compușii de carbon... În niciunul dintre elemente, o asemenea capacitate de a se complica nu este dezvoltată într-o asemenea măsură ca în carbon. Până acum nu există nicio bază pentru determinarea gradului de polimerizare a unei molecule de carbon, grafit, diamant, doar se poate crede că acestea conțin C n, unde n este o valoare mare.
Din care provin mineralele de diamant și grafit element carbon. Aproape toate mineralele sunt formate din două sau mai multe elemente care se combină chimic pentru a forma un compus. Volumele mineralului sunt aranjate într-un model care se repetă iar și iar. Volumele sunt baza materiei. Dacă nu este conținut, modelul repetat al atomilor minerali formează un corp solid numit cristal. Cristalul are margini plate cu margini ascuțite și puncte. Toate mineralele au o structură cristalină caracteristică.
În unele minerale, această structură este evidentă cu ochiul liber. La alte specii, se observă doar la nivel microscopic. Unele dintre ele sunt foarte comune și ușor de găsit. Pentru o bază azotată, o pentoză și o grupare fosfat. Bazele azotate pot fi clasificate ca pirimidine și purine. Baza este atașată la pentoza de carbon 3, iar fosfatul este esterificat la carbonul său 5.
Această presupunere a fost confirmată în vremea noastră. Atât grafitul, cât și diamantul sunt polimeri formați din aceiași atomi de carbon.
Conform remarcii clare a profesorului Yu.V. Khodakov, „pe baza naturii forțelor care trebuie depășite, profesia de tăietor de diamante ar putea fi atribuită profesiilor chimice”. Într-adevăr, tăietorul trebuie să învingă nu forțele relativ slabe ale interacțiunii intermoleculare, ci forțele legăturii chimice, care combină atomii de carbon într-o moleculă de diamant. Orice cristal de diamant, chiar și un Cullinan uriaș, de șase sute de grame, este în esență o moleculă, o moleculă dintr-un polimer tridimensional extrem de regulat, aproape perfect construit.
Soluțiile cu aceste proprietăți sunt considerate bazice sau alcaline. Acest studiu prezintă definiția, utilizările, riscurile și clasificările sale. În a noastră Viata de zi cu zi există mai multe baze cu aplicații importante. Pericolul consumului de steroizi și anabolizante.
Este foarte probabil ca viața Pământului să fi început mai întâi pe Marte. Dovezile care vorbesc în sprijinul acestei teorii revoluționare se regăsesc în datele despre formarea primelor molecule necesare nașterii vieții. De ani de zile, oamenii de știință s-au nedumerit cu privire la Sfântul Graal al biologiei - cum a apărut prin gruparea atomilor în așa fel încât să producă cele trei componente principale ale moleculelor tuturor organismelor vii - ARN și proteine.
Grafitul este o altă chestiune. Aici, ordonarea polimerică se extinde numai în două direcții - de-a lungul planului și nu în spațiu. Într-o bucată de grafit, aceste planuri formează un pachet destul de dens, ale cărui straturi sunt interconectate nu prin forțe chimice, ci prin forțe mai slabe de interacțiune intermoleculară. De aceea este atât de ușor - chiar și din contactul cu hârtia - grafitul se exfoliază. În același timp, este foarte dificil să rupi o placă de grafit în direcția transversală - aici legătura chimică contracarează.
Aceste molecule, care sunt blocul de bază al organismelor vii, sunt mult mai complexe decât așa-numita „bulion prebiotic”. Potrivit oamenilor de știință, acest amestec primordial a fost compus din substanțe chimice organice de carbon și a existat pe Pământ în urmă cu aproximativ 3 miliarde de ani. În acest bulion de bază s-au „născut” cele trei ingrediente principale.
Acesta este, de asemenea, un punct cheie în teoria originii vieții. Pur și simplu adăugarea de energie, căldură și lumină la o serie de molecule organice într-un bulion pre-antibiotic nu produce în mod automat viață, rezultând rășină. Deci, cum a apărut ARN-ul, primul dintre cele trei blocuri de bază ale vieții? În acest scop, mineralele implicate în crearea ARN-ului trebuie dizolvate în bulionul principal. Potrivit profesorului Brenner, concentrația acestor minerale a fost mult mai intensă pe Marte decât pe Pământul tânăr.
Caracteristicile structurii moleculare explică diferența uriașă dintre proprietățile grafitului și diamantului. Grafitul este un excelent conductor de căldură și electricitate, în timp ce diamantul este un izolator. Grafitul nu transmite deloc lumina - diamantul este transparent. Indiferent de modul în care diamantul este oxidat, doar CO 2 va fi produsul de oxidare. Și prin oxidarea grafitului, puteți obține opțional mai mulți produse intermediare, în special acizii grafitic (compoziție variabilă) și melitic C 6 (COOH) 6. Oxigenul, parcă, s-a blocat între straturile unui pachet de grafit și oxidează doar câțiva atomi de carbon. Nu există puncte slabe într-un cristal de diamant și, prin urmare, fie oxidarea completă, fie neoxidarea completă este posibilă - nu există a treia cale...
Brenner și echipa sa cred că viața s-a născut pe Planeta Roșie și apoi, prin intermediul meteoriților, a fost adusă pe Pământ. Teoria panspermiei nu este cunoscută științei, dar profesorul Brenner o privește dintr-un unghi nou. Mineralele, bogate în molibden și pin, sunt cheia nașterii vieții, spune el.
Mineralele care conțin bor ajută la formarea substanțelor botanice, iar cele care conțin molibden rearanjează molecula intermediară și o rearanjează în riboză. Riboza este monozaharida cheie care construiește structura de bază a ARN-ului. Oamenii de știință sunt siguri că în urmă cu 3 miliarde de ani condițiile de pe planeta noastră nu erau potrivite pentru formarea mineralelor care conțin pin și molibden. Aceasta înseamnă că mineralele care conțin bor nu există pe Pământ, sau cel puțin nu în cantități suficiente pentru a asigura reacția chimică necesară.
Deci, există un polimer „spațial” de carbon elementar, există unul „planar”. În principiu, existența unui polimer liniar „unidimensional” de carbon a fost presupusă de mult timp, dar nu a fost găsit în natură.
A fost primit destul de recent, deja în anii 60, de chimiștii sovietici V.V. Korshak, A.M. Sdadkov, V.I. Kasatochkin și Yu.P. Kudryavtsev. Noua substanță a fost sintetizată prin oxidarea catalitică a acetilenei. Polimerul liniar al carbonului a fost numit carabină. În exterior, arată ca o pulbere neagră fin-cristalină, are proprietăți semiconductoare, iar sub acțiunea luminii, conductivitatea electrică a carabinei crește foarte mult. Prima aplicare practică a carabinei se bazează pe această proprietate - în fotocelule. Este important ca carbyne să nu piardă din fotoconductivitate la temperaturi de până la 500°C; aceasta este mult mai mult decât alte materiale cu același scop.
În cuvintele profesorului Brenner: Numai dacă molibdenul este puternic oxidat poate afecta crearea vieții pe Pământ. Dar sub această formă, molibdenul nu putea exista pe Pământ acum 3 miliarde de ani. În același timp, mediul timpuriu al lui Marte a fost mult mai uscat și mai oxidant. Condițiile planetei roșii erau mult mai potrivite reacții chimice necesare pentru a crea viață.
Rezultatele obținute de profesorul Brenner și echipa sa arată fără echivoc că suntem, de fapt, toți marțienii de origine. Fără milioane și milioane de ani, teoria evoluționistă se dezintegrează complet. Iată câteva dintre numeroasele dovezi plauzibile din diverse domenii ale științei care sugerează că lumea este mult mai tânără decât evoluționiştii.
Potrivit descoperitorilor carabinei, cel mai dificil lucru pentru ei a fost să determine ce fel de legături sunt legați atomii de carbon într-un lanț. Ar putea avea legături simple și triple alternative (-C ≡ C - C ≡ C - C ≡), dar ar putea avea doar legături duble (= C = C = C = C =). Și ar putea fi ambele în același timp. Doar câțiva ani mai târziu, Korshak și Sladkov au reușit să demonstreze că nu există legături duble în carabină. Cu toate acestea, din moment ce teoria permitea existența unui polimer liniar de carbon doar cu legături duble, ar fi pur și simplu un păcat să nu încercăm să obținem această varietate - în esență, a patra modificare a carbonului elementar.
Geologie: datarea cu radiocarbon a diamantelor
Departe de a dovedi evoluția, cuantificarea carbonului 14 oferă de fapt unele dintre cele mai puternice dovezi pentru creație și un pământ tânăr. Radiocarbonul nu poate rămâne liber în materie timp de milioane de ani, deoarece cade rapid. Din acest motiv, poate fi folosit doar pentru a obține „vârste” în intervalul de zeci de mii de ani.
Astronomie: Moon Retreat
Diamantul este cea mai dură substanță cunoscută de noi și este extrem de rezistent la degradarea chimică. Atracția gravitațională a lunii creează mareele pământului, determinând luna să se miște foarte încet. Din cauza acestui efect, luna ar fi fost mai aproape de Pământ în trecut. Pe baza forțelor gravitaționale și a retragerii curente, putem calcula cât de mult din lună s-a mișcat în timp.
Această substanță a fost obținută la Institutul de Compuși Organoelementali al Academiei de Științe a URSS. Noul polimer liniar de carbon a fost numit polycumulen. Aparent, este prea devreme pentru a specula cu privire la posibilele aplicații practice ale „fratelui mai mic al carabinei” - cercetările asupra proprietăților sale continuă, autorii descoperirii nu se grăbesc să tragă concluzii.
Până acum, un singur lucru este incontestabil: există patru modificări ale carbonului elementar și fiecare dintre ele este interesantă în felul său.
Geologie: câmpul magnetic incident al Pământului
Dar majoritatea cărților de astronomie ne învață că luna are o vechime de peste 4 miliarde de ani, ceea ce pune o dilemă serioasă - cu mai puțin de 1,5 miliarde de ani în urmă, luna ar fi trebuit să atingă pământul! Pământul, ca și alte planete, are un câmp magnetic care cade rapid. Acum putem măsura viteza cu care energia magnetică este epuizată și putem construi un model pentru a explica informațiile.
Oamenii de știință au inventat un „model dinam” la nucleul Pământului pentru a explica modul în care câmpul magnetic poate exista atât de mult timp, dar acest model nu poate explica în mod adecvat datele de dezintegrare rapidă și schimbările rapide pe care le-a experimentat în trecut. Modelul creaționist explică datele în mod eficient și clar camp magnetic Pământ, care oferă dovezi uimitoare că Pământul are doar câteva mii de ani, nu miliarde.
Carbonul prin ochii unui chimist anorganic
Acest element este întotdeauna tetravalent, dar din moment ce se află chiar în mijlocul perioadei, starea sa de oxidare în diferite circumstanțe este fie +4, fie -4. În reacțiile cu nemetale, este electropozitiv, cu metale - invers. Chiar și în cazurile în care legătura nu este ionică, ci covalentă, carbonul rămâne fidel în sine - valența sa formală rămâne egală cu patru.
Biologie: țesut moale de dinozaur
ÎN anul trecut au existat multe dovezi ale materialelor biologice „conservate minunat” în presupusele paturi de roci antice și fosile. Evoluționistii spun că acest țesut de dinozaur are peste 65 de milioane de ani, dar testele de laborator au arătat că nu este. mod cunoscut- și poate că nu există nicio posibilitate - asta material biologic durează peste câteva mii de ani.
Antropologie: creșterea populației
Poate din cauza ideii greșite a evoluționștilor înainte de cât timp trăiesc dinozaurii? Este incredibil ce ne poate arăta matematica de bază de vârstă. Putem calcula anii prin care umanitatea a existat numărând populația la fiecare 150 de ani pentru a obține o estimare a ceea ce ar trebui să fie în spatele populației umanității într-o anumită perioadă de timp.
Există foarte puțini compuși în care carbonul prezintă cel puțin formal o valență diferită de patru. Un singur astfel de compus este în general cunoscut, CO, monoxid de carbon, în care carbonul pare a fi bivalent. Tocmai se pare, pentru că în realitate sunt mai multe tip complex conexiuni. Atomii de carbon și oxigen sunt legați printr-o legătură polarizată 3-covalentă și formula structurala această conexiune este scrisă astfel:
O + ≡ C -.
În 1900, M. Gomberg a obţinut compusul organic trifenilmetil (C 6 H 5) 3 C. Se părea că atomul de carbon de aici era trivalent. Dar mai târziu s-a dovedit că de data aceasta valența neobișnuită a fost pur formală. Trifenilmetil și analogii săi sunt radicali liberi, dar, spre deosebire de majoritatea radicalilor, ei sunt destul de stabili.
Din punct de vedere istoric, foarte puțini compuși de carbon au rămas „sub acoperișul” chimiei anorganice. Aceștia sunt oxizi de carbon, carburi - compușii săi cu metale, precum și bor și siliciu, carbonați - săruri ale celor mai slabe acid carbonic, disulfură de carbon CS 2 , compuși cu cianură. Trebuie să ne consolam cu faptul că, așa cum se întâmplă adesea (sau s-a întâmplat) în producție, „arborele” compensează neajunsurile din nomenclatură. Într-adevăr, cea mai mare parte a carbonului din scoarța terestră nu este conținută în organismele vegetale și animale, nu în cărbune, petrol și toate celelalte materii organice luate împreună, ci în doar doi compuși anorganici - calcar CaCO 3 și dolomit MgCa (CO 3 ). ) 2. Carbonul face parte din alte câteva zeci de minerale, este suficient să amintim marmură CaCO 3 (cu aditivi), Cu 2 (OH) 2 CO 3 malachit, ZnCO 3 smithsonite zinc mineral... Există carbon atât în rocile magmatice, cât și în cele cristaline. şisturi.
Mineralele care conțin carburi sunt foarte rare. De regulă, acestea sunt substanțe de origine deosebit de profundă; prin urmare, oamenii de știință sugerează că în nucleu globul există carbon.
Pentru industria chimică, carbonul și compușii săi anorganici prezintă un interes considerabil - mai des ca materii prime, mai rar ca materiale structurale.
Multe dispozitive de producție chimică, de exemplu, schimbătoarele de căldură, sunt fabricate din grafit. Și acest lucru este natural: grafitul are o mare rezistență termică și chimică și în același timp conduce foarte bine căldura. Apropo, datorită acelorași proprietăți, grafitul a devenit un material important pentru tehnologia cu jet. Cârmele sunt realizate din grafit, lucrând direct în flacăra aparatului de duză. Este practic imposibil să aprindeți grafitul în aer (chiar și în oxigen pur, nu este ușor să faceți acest lucru), iar pentru a evapora grafitul este nevoie de o temperatură mult mai mare decât cea care se dezvoltă chiar și într-un motor de rachetă. Și în plus, la presiune normală, grafitul, ca și granitul, nu se topește.
Este greu de imaginat producția electrochimică modernă fără grafit. Electrozii de grafit sunt folosiți nu numai de electrometalurgiști, ci și de chimiști. Este suficient să reamintim că în electrolizoarele folosite pentru producerea sodă caustică și a clor, anozii sunt grafit.
S-au scris multe cărți despre utilizarea compușilor de carbon în industria chimică. Carbonatul de calciu, calcar, servește ca materie primă în producția de var, ciment, carbură de calciu. Un alt mineral - dolomita - este „strămoșul” unui grup mare de refractare dolomitice. Carbonat de sodiu și bicarbonat - carbon de sodiu și sifon de băut. Unul dintre principalii consumatori de sodă a fost și rămâne industria sticlei, care utilizează aproximativ o treime din producția mondială de Na 2 CO 3 .
Și, în sfârșit, puțin despre carburi. De obicei, când se spune carbură, se referă la carbură de calciu - o sursă de acetilenă și, în consecință, la numeroase produse de sinteză organică. Dar carbura de calciu, deși cea mai faimoasă, nu este în niciun caz singura substanță foarte importantă și necesară a acestui grup. Carbura de bor B 4 C este un material important in tehnologia nucleara (pentru mai multe detalii vezi articolul „Boron”), carbura de siliciu SiC sau carborundum este cel mai important material abraziv. Carburele multor metale se caracterizează prin rezistență chimică ridicată și duritate excepțională; carborundum, de exemplu, este doar puțin inferior diamantului. Duritatea sa pe scara Mohs este de 9,5 ... 9,75 (diamant - 10). Dar carborundum este mai ieftin decât diamantul. Este produs în cuptoare electrice la o temperatură de aproximativ 2000°C dintr-un amestec de cocs și nisip cuarțos.
Carbonul prin ochii unui chimist organic
Potrivit celebrului om de știință sovietic academician I.L. Knunyants, chimia organică poate fi privită ca un fel de punte aruncată de știință de la natura neînsuflețită la forma sa cea mai înaltă - viața. Și în urmă cu doar un secol și jumătate, cei mai buni chimiști ai vremii au crezut și și-au învățat adepții că chimia organică este știința substanțelor formate cu participarea și sub îndrumarea unei „materie” ciudate - forță de viață. Dar curând această putere a fost trimisă la coșul de gunoi al științelor naturale. Sintezele mai multor substanțe organice - uree, acid acetic, grăsimi, substanțe asemănătoare zahărului - au făcut-o pur și simplu inutilă.
A apărut definiția clasică a lui K. Schorlemmer, care nu și-a pierdut sensul nici 100 de ani mai târziu: „Chimia organică este chimia hidrocarburilor și a derivaților acestora, adică produse formate atunci când hidrogenul este înlocuit cu alți atomi sau grupe de atomi”.
Deci, organicele nu sunt chimia nici măcar a unui element, ci a unei singure clase de compuși ai acestui element. Dar ce clasa! O clasă împărțită nu numai în grupuri și subgrupe, ci și în științe independente. Au ieșit din organice, biochimie, chimia polimerilor sintetici, chimia compușilor biologic activi și medicinali desprinși din organice...
Milioane de compuși organici (compuși de carbon!) și aproximativ o sută de mii de compuși ai tuturor celorlalte elemente combinate sunt acum cunoscuți.
Este bine cunoscut faptul că viața este construită pe bază de carbon. Dar de ce exact carbonul - al unsprezecelea element ca abundență de pe Pământ - și-a asumat dificila sarcină de a fi baza oricărei vieți?
Răspunsul la această întrebare este ambiguu. În primul rând, „în niciunul dintre elemente nu este dezvoltată o asemenea capacitate de complicare într-o asemenea măsură ca în carbon”. În al doilea rând, carbonul este capabil să se combine cu majoritatea elementelor și într-o mare varietate de moduri. În al treilea rând, legătura dintre atomii de carbon, precum și cu atomii de hidrogen, oxigen, azot, sulf, fosfor și alte elemente care alcătuiesc substanțele organice, poate fi distrusă sub influența factorilor naturali. Prin urmare, carbonul circulă constant în natură: de la atmosferă la plante, de la plante la organisme animale, de la viu la mort, de la mort la viu...
Cele patru valențe ale unui atom de carbon sunt ca patru mâini. Și dacă doi astfel de atomi sunt conectați, atunci există deja șase „brațe”. Sau - patru, dacă doi electroni sunt cheltuiți pentru formarea unei perechi (legătură dublă). Sau - doar două, dacă legătura, ca în acetilenă, este triplă. Dar aceste legături (se numesc nesaturate) sunt ca o bombă în buzunar sau un geniu într-o sticlă. Ei sunt ascunși deocamdată, dar la momentul potrivit se eliberează pentru a-și face plățile într-un joc furtunos, de jocuri de noroc, de interacțiuni și transformări chimice. O mare varietate de structuri se formează în urma acestor „jocuri” dacă carbonul este implicat în ele. Editorii „Enciclopediei pentru copii” au calculat că din 20 de atomi de carbon și 42 de atomi de hidrogen pot fi obținute 366319 hidrocarburi diferite, 366319 substanțe din compoziția C 20 H 42. Și dacă nu există șase duzini de participanți la „joc”, ci câteva mii; dacă printre ei sunt reprezentanți nu a două „echipe”, ci, să zicem, a opt!
Acolo unde există carbon, există diversitate. Acolo unde există carbon, sunt dificultăți. Și cele mai diferite modele din arhitectura moleculară. Lanțuri simple, ca în butan CH 3 - CH 2 - CH 2 - CH 3 sau polietilenă - CH 2 - CH 2 - CH 2 - CH 2 - și structuri ramificate (cel mai simplu dintre ele este izobutanul); inele cu un schelet pur de carbon (ciclopropan, ciclohexan, benzen) și aceleași inele cu „pendant” (toluen, anilină); inele în care sunt încastrați atomi străini - compuși heterociclici, cum ar fi tiofenul C 4 H 4 S și conglomerate de diferite inele (cel mai simplu este naftalina, constând din două inele benzenice). Și toate aceste structuri sunt cele mai simple - ameba și ciliați ai chimiei organice.
Dacă continuăm analogia cu fauna sălbatică, atunci undeva la nivelul mușchilor și lichenilor vor exista aproape toți polimerii sintetici cunoscuți acum, de exemplu, nailon:
sau o rășină solidă fenol-formaldehidă utilizată pe scară largă în inginerie:
Și în partea de sus a complicației sunt cei mai importanți polimeri pentru noi: acizi nucleici si proteine. Structura lor este foarte complexă și în cele mai multe cazuri nu a fost încă descifrată definitiv. Și fiecare nouă realizare în acest domeniu ne amintește din nou și din nou nu numai de puterea științei moderne, ci și de complexitatea extraordinară a sarcinilor cu care se confruntă cei care încearcă să înțeleagă sensul vieții la nivel molecular și submolecular. Gândiți-vă la dublu helix al moleculei de ADN sau la încurcarea labirintică a celor patru catene ale moleculei de hemoglobină.
În urmă cu câțiva ani, a avut loc un eveniment de importanță mondială: s-a realizat sinteza chimică completă a moleculei proteice de insulină.
Acesta este unul dintre cele mai simple ca structură, dar foarte important pentru proteinele vieții. Este responsabil pentru metabolismul carbohidraților din organism.
În molecula de insulină, există două lanțuri legate printr-o punte disulfură (doi atomi de sulf). Unul dintre lanțuri este format din 21 de aminoacizi, iar în interiorul lui se află un inel disulfuric. Celălalt lanț conține 30 de aminoacizi, de asemenea legați într-o secvență strictă. Sinteza primului lanț a constat din 89 de etape de reacție, a doua - din 138. În cele din urmă, ultima etapă de lucru, a 228-a, a fost conectarea lanțurilor.
Inutil să spun că această muncă a necesitat multă muncă și timp. Și într-o celulă vie, sinteza unei molecule de proteine (chiar mult mai complexă decât o moleculă de insulină) durează doar 2-3 secunde.
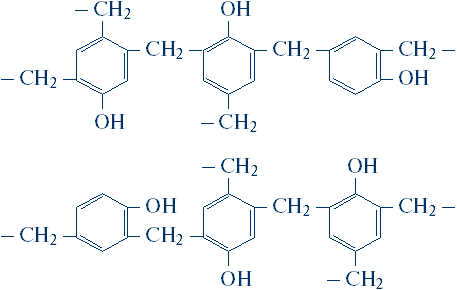
Nu uitați de încă o caracteristică a sintezei proteinelor: acum sunt cunoscuți mai mult de 20 de aminoacizi - blocurile structurale din care este construită o moleculă de proteine. Formula generală condiționată pentru toți aminoacizii pare simplă:
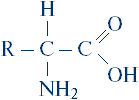
Dar diferite grupuri de atomi pot fi ascunse sub simbolul R. Numai în cel mai simplu caz, în molecula de glicină, R este un atom de hidrogen și, de exemplu, în histadină, R este format din 11 atomi:
Ordinea în care aminoacizii sunt combinați într-o moleculă de proteină este foarte importantă. S-a stabilit, de exemplu, că una dintre bolile grave ale sângelui apare datorită faptului că doar într-un loc al moleculei de hemoglobină unul dintre aminoacizi este înlocuit cu altul (acid glutamic - valină).
Moleculele de proteine conțin multe mii de atomi. Trebuie să existe hidrogen, oxigen, azot; foarte des - sulf. Dar baza acestor molecule este întotdeauna carbonul. Și fără carbon nu există viață, cel puțin pe Pământ.
Există totuși organisme în care conținutul elementului nr. 6 este de numai 0,1%. În linte de rață, strângerea iazului stagnant, 2,5% carbon. Dar într-un clopot mai bine organizat, este deja de 10,2%. La șoareci, carbonul reprezintă 10,77%, în timp ce la pisici, aproape de două ori mai mult, la 20,56%. Nu aceasta este împrejurarea care a stat la baza binecunoscutului fenomen că o pisică prinde un șoarece și nu invers?
Dar glumele deoparte. Carbonul merită să fie tratat cu respect și seriozitate. Numai pentru că „elementele vieții” sunt uneori numite potasiu, fosfor și azot. Dar dacă da, atunci ce definiție merită elementul pe baza căruia sunt construite cu adevărat toate viețuitoarele?
Și aici este al unsprezecelea
În ceea ce privește prevalența în scoarța terestră - o înveliș solidă la o adâncime de până la 16 km și în atmosferă la o înălțime de până la 15 km, carbonul ocupă locul unsprezece. Este, de asemenea, pe locul unsprezece ca abundență în atmosfera solară. În general, există destul de mult carbon în spațiu. Stațiile spațiale sovietice Venera-4, Venera-5 și Venera-6 au stabilit că atmosfera stelei dimineții este formată în principal din dioxid de carbon. Acest gaz domină și atmosfera lui Marte. Dar în atmosferele lui Saturn, Jupiter, Uranus și Neptun, împreună cu amoniacul, domină un alt compus de carbon - metanul. Carbonul a fost găsit în meteoriți și comete. Cu ajutorul observațiilor spectroscopice, carbonul a fost găsit și pe stele îndepărtate. În spectrele stelelor relativ reci, benzile de absorbție caracteristice radicalilor CH*, CN* și C2* au fost observate în mod repetat. Nu fără motiv, se presupune că radicalii CH * și CN * există în mediul de gaz și praf care umple spațiul interstelar.
Asistent metalurgist
Carbonul nu este un metal. Dar, conform unor caracteristici, în special, conductivitatea termică și conductibilitatea electrică, grafitul este foarte „asemănător cu metalul”. Carbonul nu este un metal și, totuși, este unul dintre cele mai importante elemente pentru metalurgie. Datorită lui, fierul moale, slab, complet nepotrivit ca material structural, devine fontă sau oțel. În ultimele decenii s-au răspândit așa-numitele oțeluri grafitizate, în structura cărora se află microcristale libere de grafit. Practic, aceste oțeluri sunt folosite în producția de scule, arbori cotiți, matrițe și pistoane, deoarece se caracterizează printr-o rezistență și duritate mai mare decât alte oțeluri nealiate.
Ca agent reducător, carbonul este utilizat nu numai în producția de fontă, ci și în multe metale neferoase. Practic, cocsul acționează ca agent reducător, în care carbonul este de 97 ... 98%. Dar cărbunele - primul, se pare, agent reducător în metalurgia feroasă - în metalurgia neferoasă a timpului nostru acționează într-o altă capacitate. Din el este făcut așa-numitul strat de acoperire, care protejează metalul topit de oxidare.
Nu fără carbon și producția de aluminiu - metalul crește pe un catod de grafit.
Și în procesul de furnal, de obicei participă nu numai carbonul elementar (sub formă de cocs), ci și unul dintre compușii elementului nr. 6. Calcarele dense obișnuite sunt utilizate ca fluxuri în topirea fontei din minereurile de fier care conțin silice și alumină ca gangă.
Încă baza
Cărbunele, petrolul, șisturile bituminoase, turba, gazele naturale sunt baza materială a industriei de energie termică din trecut, prezent și viitor apropiat. Pentru că, oricât de luminoase ar fi perspectivele energie nucleară, de câțiva ani atomul va merge la utilități. Până în prezent, ponderea sa în producerea de energie electrică este relativ mică. În timp, rolurile par să se schimbe. Atunci hegemonii actuali, combustibilii naturali pe bază de carbon, vor deveni „ajutoare”. Și, aparent, va veni vremea când fosilele combustibile vor fi folosite în întregime pentru prelucrarea chimică. Între timp, majoritatea sunt trimiși la cuptoare și motoare, care în esență sunt tot cuptoare.
Sinteza diamantului
În decembrie 1954, firma americană General Electric a raportat că angajații acestei firme Hall, Bundy și alții au primit diamante artificiale sub formă de plăci triunghiulare mici. Procesul de sinteză a fost efectuat la o presiune de aproximativ 100 mii atm. si la o temperatura de 2600°C. Catalizatorul a fost tantal, sau mai precis, diamantul a fost obținut din grafit pe o peliculă subțire de carbură de tantal formată în timpul sintezei diamantului.
Cu toate acestea, chiar mai devreme, în februarie 1953, grupul lui Erik Gunnar Lundblad (Suedia) a primit primele diamante artificiale, dar oamenii de știință suedezi nu s-au grăbit să publice rezultatele muncii lor.
De atunci, de la mijlocul anilor 1950, în mai multe țări s-au desfășurat lucrări de succes privind sinteza industrială a diamantelor. La noi, această lucrare a fost condusă de V.N. Bakul și academicianul L.F. Vereșchagin. Ca un cadou pentru cel de-al 22-lea Congres al PCUS, 2.000 de carate (carate - 0,2 g) de diamante sintetice au fost realizate folosind tehnologia autohtonă. Acum țara noastră produce atât de multe diamante industriale câte nevoie tehnologia. Se știe, de exemplu, că la mijlocul anilor 1970 Uzina de Automobile Gorki folosea până la 400.000 de carate de diamante artificiale pe an. O plantă - 80 kg de diamante! Aproximativ aceeași sumă a fost „cheltuită” de uzina de instrumente din Sestroretsk și de alte întreprinderi.
Diamantele sintetice de calitate prețioasă sunt deja produse în lume; costă mult mai mult decât cele naturale.
Sinteza industrială a diamantelor este o mare realizare a științei și tehnologiei. Oamenii de știință merg la el de multe decenii. Majoritatea încercărilor făcute în trecut s-au încheiat cu eșec. Dar au fost și scăpări. Următoarele note descriu două dintre ele și sinteza diamantului în materia meteoriților.
Meteoritul... mâncat
O etapă importantă în realizarea posibilității formării diamantelor în afara scoarței terestre a fost descoperirea granulelor de diamant într-un meteorit care a căzut la 10 septembrie (stil vechi) 1886 lângă satul Novy Urey, districtul Krasnoslobodsky, provincia Penza ( acum Republica Socialistă Sovietică Autonomă Mordoviană).
Granulele de diamant au fost descoperite în substanța meteorită de către profesorii Institutului Silvic din Sankt Petersburg, profesor asociat de mineralogie Mihail Vasilyevich Erofeev și profesor de chimie Pavel Alexandrovich Lachinov (cel mai bine cunoscut pentru munca sa asupra colesterolului, pe care a făcut-o în ultimii ani). a vieţii lui).
Fragmente din meteoritul Novy Urey au fost trimise la Sankt Petersburg de către un fost student al Institutului Silvic, profesorul Pavel Ivanovich Baryshnikov.
Iată fragmente din scrisoarea sa către directorul Institutului Silvic: „...Dis de dimineață mai mulți țărani Novourei la vreo trei verste din sat și-au arat câmpul... Deodată, destul de neașteptat, o lumină puternică a luminat tot cartierul. ; apoi câteva secunde mai târziu s-a auzit o crăpătură groaznică, ca o lovitură de tun sau o explozie, urmată de o secundă, mai puternică. Împreună cu zgomotul de la câteva strânse de la țărani, o minge de foc a căzut la pământ; În urma acestei mingi, nu departe peste pădure, a aterizat altul, mult mai mare decât primul. Întregul fenomen nu a durat mai mult de un minut.
Țăranii, nebuni de frică, nu au știut ce să facă, au căzut la pământ și nu au îndrăznit multă vreme să se deplaseze de pe pod... În cele din urmă, unul dintre ei, oarecum îndrăznit, a mers în acel loc.. și, spre surprinderea lui, a găsit o gaură puțin adâncă; în mijlocul ei, adâncindu-se pe jumătate în pământ, zăcea o piatră neagră foarte fierbinte. Greutatea pietrei i-a lovit pe țărani...
Apoi s-au dus în pădure să caute o a doua piatră, mai mare, dar toate eforturile lor au fost în zadar: pădurea din acest loc reprezintă multe mlaștini și mlaștini și nu au reușit să găsească aerolitul: după toate probabilitățile, a căzut în apă.
A doua zi, unul dintre țăranii aceleiași așezări Urey s-a dus pe câmpul său să se uite la hrișcă. Aici, din întâmplare, a găsit exact aceeași piatră pe care o aduseseră vecinii cu o zi înainte. Piatra a format și o gaură în jurul ei; o parte din piatră era în pământ... Căutările ulterioare pentru țărani în vecinătatea New Urey nu au dus la nimic. Prin urmare, au căzut doar trei bucăți. Cel mai mare dintre ei a căzut, fără îndoială, în pădure în mlaștină; al doilea ca mărime, care a căzut pe pământ arabil sub țărani, a fost cumpărat de mine și trimis la tine pentru biroul mineralogic al institutului și, în cele din urmă, al treilea, găsit de un țăran în hrișcă, a fost mâncat... Boabe aerolit. au fost considerate un medicament universal universal. S-au răspândit zvonuri ridicole despre „vindecarea miraculoasă”, cererile pentru „piatra lui Hristos” s-au intensificat; fericitul proprietar al meteoritului a profitat de ocazie și a vândut pietricela aproape în valoare de greutatea ei în aur, arătând în același timp slăbiciunile unui adevărat farmacist inveterat. Primirea „pietrei lui Hristos” s-a făcut în felul acesta: pacientul, după ce a cumpărat o bucată nesemnificativă de meteorit, a zdrobit-o și a măcinat-o în pulbere, apoi, după ce a amestecat-o cu apă, a băut-o cu evlavie, făcând o rugăciune și semnul crucii..."
Pentru descoperirea diamantelor într-un meteorit, Academia Rusă de Științe i-a acordat lui Erofeev și Lachinov Premiul Lomonosov. Iar istoria nu a păstrat nicio urmă a faptului că măcar cineva a acordat atenție întunericul fără speranță al țăranilor.
Corpul ceresc (sau mai bine zis, o parte din acesta), trimis de Baryshnikov la institut, cântărea 1762,3 g; ulterior s-au mai obținut două fragmente - cântărind 21,95 și 105,45 g. În afară de cele două zeci de grame cheltuite de Erofeev și Lachinov pentru analiză, meteoritul a fost păstrat.
Poate fi văzut acum în Muzeul Minierului din Leningrad.
Am avut această experiență.
LA sfârşitul XIX-leaîn. numărul mineralelor recreate de om in vitro în sticla de laborator a depăşit de mult o sută. Cuarț, hornblendă, tridimit, zircon - un total de 11 minerale - a fost primul primit de profesorul Academiei de Medicină Militară din Sankt Petersburg Konstantin Dmitrievich Hrușciov. A fost printre primii care l-au prezentat munca de laborator asupra sintezei mineralelor presiune ridicata. Hrușciov a inventat un dispozitiv care a jucat un rol important timp de multe decenii: o „bombă” din oțel cu pereți groși, cu o priză în care este introdusă o eprubetă de platină cu reactivi și un capac cu filet masiv din oțel. Fiind încălzit la căldură roșie, un astfel de vas este capabil să reziste luni de zile presiunii substanțelor care reacţionează într-o inserție de platină.
La începutul anilor 1990, Hrușciov a încercat să repete „experimentul” naturii, ducând la apariția granulelor de diamant în meteoriți (după descoperirea lui Erofeev și Lachinov, care au studiat un meteorit de piatră, aceleași descoperiri au fost făcute în substanță. a meteoriţilor de fier). Dar pentru această încercare, „bomba” din oțel nu mai era potrivită.
Iată fragmente din raportul lui K.D. Hrușciov, făcută de el la 4 martie 1893 la o reuniune a Societății Imperiale Mineralogice din Sankt Petersburg: „Pe baza descoperirilor din meteorit, s-ar putea ajunge la concluzia că, sub presiune puternică, carbonul poate fi eliberat din soluție în metalul sub formă de diamant. Am făcut această experiență. După ce am saturat argintul clocotit cu carbon, din care șase la sută se dizolvase, am răcit rapid masa. Presiunea din mijlocul ei nu a putut să nu urce sub acțiunea crustei, care s-a întărit imediat la exterior. Dizolvarea ulterioară a lingoului rezultat a arătat că o parte din carbonul eliberat are proprietățile unui diamant.
Pulberea sa este alcătuită din fragmente și plăci cristaline incolore transparente, care refractează puternic lumina, complet izotropă, zgârie corindon și arde în dioxid de carbon cu un ușor reziduu de cenușă.
Mai multe despre răcirea rapidă
În același 1893, un alt om de știință, profesorul de chimie parizian Henri Moissan, a făcut același experiment ca Hrușciov (Moissan și-a terminat lucrarea puțin mai devreme, el a fost cel care a publicat prima publicație).
Având la acea vreme cea mai bună sursă de încălzire posibilă - cuptorul cu arc electric inventat de el, Moissan a decis să dizolve carbonul (cărbune de zahăr) în fier clocotit. Convingerea profundă a acestui om de știință remarcabil (apropo, un membru corespondent străin Academia RusăȘtiințe.) a fost formulată de el o regulă științifică: „Experiența trebuie obținută întotdeauna!” Aceasta înseamnă că rezultatele unui experiment, un experiment real care îndeplinește legile imuabile ale naturii, trebuie să fie la fel de constante ca aceste legi.
Și dacă da, atunci tot ceea ce nu are legătură cu însăși esența experienței nu contează prea mult.
Probabil, pe baza acestei credințe, Moissan a folosit în experimentul său un oarecum neobișnuit pentru un laborator științific, dar un „sistem de răcire” extrem de simplu pentru fierul topit. A pus un taburet pe jos în laborator, o cadă de lemn pe el, a turnat apă de la robinet în cadă. Iar când a venit timpul să răcească fierul clocotit cu carbon dizolvat în el, profesorul a ridicat creuzetul cu clești și a turnat conținutul într-o cadă cu apă! Din fericire, Moissan și-a pus încă ochelari și șorț înainte, iar hainele care i-au luat foc au fost stinse.
Când lingoul fără formă, care a rămas în cuvă după explozie, a fost dizolvat în acizi, din el au fost izolate mai multe boabe. S-au scufundat într-un lichid cu o greutate specifică de trei, rubin zgâriat și corindon, aproape complet ars în oxigen...
Acestea sunt două incidente din istoria diamantului artificial.
Un candidat pentru cel mai durabil?
În 1975, calculele au fost publicate de chimiștii sovietici V.V. Korshak, V.I. Kasatochkin și K.E. Perepelkin, conform căreia cea mai mare rezistență teoretică a tuturor substanțelor disponibile pe Pământ ar trebui să fie în polimerul liniar al carbonului - carabină. Desigur, o astfel de carabină ultra-puternică trebuie făcută sub formă de mustăți fără defecte. Anterior, se credea că, teoretic, cea mai durabilă substanță este grafitul (13 mii kg / mm 2), pentru carabină, valoarea calculată a rezistenței finale este aproape de două ori mai mare - 22 ... 23 mii kg / mm 2.
De ce este nevoie pentru ca materialul să fie foarte durabil? În primul rând, valorile ridicate ale energiei legăturilor chimice. În al doilea rând, direcțiile acestor legături ar trebui, pe cât posibil, să coincidă și să meargă de-a lungul axei cristalului. În al treilea rând, dacă substanța are o structură polimerică, este necesar ca gradul de polimerizare a acesteia să fie ridicat. A patra condiție obligatorie este absența „punctelor slabe” și a legăturilor slabe în macromoleculă. Toate aceste condiții sunt îndeplinite în carabină, astfel încât valorile record ale rezistenței teoretice calculate, în general, nu sunt surprinzătoare.
Carabină în natură
În 1970, geofizicienii de la Instituția Carnegie au descoperit un nou mineral în craterul de meteorit Rees din Germania, constând din 99,99% carbon. Dar cu siguranță nu a fost diamant sau grafit. Studiile au arătat că mineralul din craterul Rhys este cel mai probabil o varietate naturală de carabină sintetizată cu câțiva ani mai devreme.
Varsta - 14 C fiecare
Metoda de determinare a vechimii descoperirilor istorice în funcție de conținutul de izotop radioactiv carbon 14 C din ele a fost dezvoltată de un fizician celebru, laureat. Premiul Nobel Frank Willard Libby.
Carbon-14 este unul dintre izotopii radioactivi naturali, cu un timp de înjumătățire de 5570 de ani.
Un flux de protoni cosmici, care zboară cu o viteză apropiată de viteza luminii, bombardează continuu Pământul. Deja inauntru straturi superioare atmosferă, protonii se ciocnesc cu nucleele de azot și oxigen. În astfel de ciocniri, atomii sunt distruși, rezultând neutroni liberi care sunt capturați instantaneu de nucleele elementelor de aer, în primul rând, desigur, de nucleele atomilor de azot. Și atunci are loc unul dintre miracolele recunoscute de știință - interconversia elementelor: azotul devine carbon, nu doar simplu, ci carbon radioactiv-14.
Nucleele de carbon-14, în descompunere, emit electroni și din nou se transformă în nuclee de azot.
Cunoscând timpul de înjumătățire al unui izotop, este ușor de calculat cât de mult se pierde în orice perioadă de timp. S-a calculat că aproximativ 7 kg de radiocarbon se descompun pe Pământ pe an. Aceasta înseamnă că o cantitate constantă din acest izotop este menținută în mod natural pe planeta noastră - ca urmare a reacțiilor nucleare care au loc în atmosferă, Pământul „dobândește” aproximativ 7 kg de 14 C anual.
Atmosfera Pământului nu este bogată în carbon. Conține doar 0,03% (în volum) dioxid de carbon CO 2 . Dar în ceea ce privește greutatea, aceasta nu este atât de mică: conținutul total de carbon din atmosferă este de aproximativ 600 de milioane de tone. Și în fiecare miliard de molecule de CO 2 atmosferic există un atom de 14 C. Acești atomi, împreună cu cei obișnuiți, sunt absorbite de plante și de acolo intră în organismele animale și într-o persoană. În orice organism viu există radiocarbon, care se descompune treptat și se reînnoiește. Într-un gram de carbon „viu”, au loc 14 acte de descompunere radioactivă în fiecare minut. Experiența arată că concentrația acestui izotop este aceeași în toată viața de pe planeta noastră, deși din anumite motive geofizice, radiocarbonul „aterizează” mai ales în regiunile polare.
Dar acum organismul moare și încetează să mai fie o verigă în ciclul continuu al carbonului pe Pământ. Noul radiocarbon nu mai intră în el, iar dezintegrarea radioactivă continuă. După 5570 de ani, cantitatea de radiocarbon dintr-un organism mort se va înjumătăți, iar într-un gram de carbon extras dintr-un copac tăiat acum 5570 de ani, contoarele sensibile pe minut vor înregistra nu 14, ci doar 7 evenimente de dezintegrare. Prin urmare, cu ajutorul radiocarbonului, este posibil să se determine vârsta aproape oricărui obiect realizat din materiale de origine vegetală sau animală.
Datarea cu radiocarbon a antichităților este extrem de convenabilă și destul de precisă. Motivul pentru aceasta este timpul de înjumătățire de 14 C - 5570 de ani. Epoca culturii umane este de aceeași ordine...
Această metodă a ajutat la determinarea datelor erupțiilor vulcanice antice și a momentului de dispariție a unor specii de animale. El a ajutat la demascarea mai multor falsuri arheologice, când, de exemplu, cranii cu dinți piliți au fost date ca dovadă a antichității.
Dar meritul principal al metodei ar trebui, aparent, să fie considerat stabilirea timpului erelor glaciare.
Măsurătorile radiocarbonului au arătat: în ultimii 40 de mii de ani, au existat trei ere glaciare pe Pământ. Cel mai recent este acum aproximativ 10.400 de ani. De atunci, Pământul a fost relativ cald.
Mărturia lui Friedrich Wöhler
Acest chimist german, după ce a sintetizat ureea în 1824, a făcut prima breșă în învățăturile vitaliștilor (de la vitalis - vital), care credeau că este imposibil de obținut. materie organică fără ajutorul „forței vitale”. Adevărat, nu au fost în pierdere și au anunțat că, spun ei, ureea este deșeul organismului și, prin urmare, poate fi sintetizată fără ajutorul „forței vitale”. Dar la mijlocul secolului al XIX-lea. această doctrină a început să „explodeze la cusături” sub presiunea unor sinteze organice din ce în ce mai noi. Cu toate acestea, înainte de apariția teoriei structura chimica, creat de Alexander Mikhailovici Butlerov, confuzia a domnit printre organice. Teoriile s-au născut și au murit cu frecvența fluturilor de o zi.
Sunt cunoscute cuvintele lui Wöhler, spuse în 1835: „Chimia organică poate înnebuni acum pe oricine... pare o pădure deasă plină de lucruri minunate, un desiș imens fără ieșire, fără capăt, în care nu îndrăznești să pătrunzi”.
Izomerie și miros
Substanțele cu aceeași compoziție dar cu aranjament spațial diferit se numesc izomeri. Modul în care această diferență afectează proprietățile poate fi judecat prin exemplul unui compus organic destul de simplu - vanilină și izovanilină analogă. Vanilina este una dintre cele mai cunoscute substanțe parfumate, mirosul său plăcut este familiar, aparent, tuturor. Și izovanilina în condiții normale aproape că nu miroase, dar dacă este încălzită, se va răspândi un miros neplăcut, asemănător cu mirosul acidului carbolic. Aromele sunt izbitor de diferite, dar nu există nicio diferență în compoziție.
Caracteristicile compoziției chimice a celulei
1. Ce este un element chimic?
2. Câte elemente chimice sunt cunoscute în prezent?
3. Ce substanțe se numesc anorganice?
4. Ce compuși se numesc organic?
5. Ce legături chimice se numesc covalente?
Aproximativ 2% din masa celulei cade pe urmatoarele opt elemente: potasiu, sodiu, calciu, clor, magneziu, fier, fosfor si sulf Restul elementelor chimice sunt continute in celula in cantitati extrem de mici.
Conținutul lecției Schema lecției și cadrul de sprijin Prezentarea lecției Metode accelerate și tehnologii interactive Exerciții închise (doar pentru uzul profesorului) Evaluare Practică sarcini si exercitii, ateliere de autoexaminare, laborator, cazuri gradul de complexitate al sarcinilor: normal, inalt, teme olimpiade Ilustrații ilustrații: clipuri video, audio, fotografii, grafică, tabele, benzi desenate, eseuri multimedia jetoane pentru pătuțuri iscoditoare umor, pilde, glume, proverbe, cuvinte încrucișate, citate Suplimente extern testare independentă(VNT) manuale vacanțe tematice de bază și suplimentare, articole sloganuri caracteristicile nationale glosar al termenilor Doar pentru profesori












